帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,多发于60岁以上老年人。发病机制为中脑黑质多巴胺能神经元发生变性进而死亡,从而进一步导致纹状体多巴胺含量显著减少而致病。该病主要临床表现包括静止性震颤、运动迟缓、肌强直和姿势步态障碍等运动性症状,还可伴有抑郁、便秘和睡眠障碍等非运动症状。有调查表明,帕金森病在我国患病率约为57/10万;随着人口老龄化的加快,患者数量逐年增加,给家庭和社会造成了沉重负担[1]。药物治疗此病是首选,常用药物有单胺氧化酶B型抑制剂、多巴胺受体激动剂、金刚烷胺等[2]。但是目前的治疗方法仅能改善患者症状,提高患者生活质量,无法达到阻止病情发展,完全根治的目的。
匹莫范色林(pimavanserin)是由美国阿卡迪亚制药(ACADIA Pharmaceuticals)开发的抗帕金森精神症状的新药,其为5-羟色胺2A受体(5-HT2A)的强力选择性抑制剂[3]。该药于2016年4月被美国食品药品管理局(FDA)批准上市,商品名为NuplazidTM,主要用于幻觉和错觉等帕金森精神症状的治疗。本文就其化学性质、药理作用、临床试验、不良反应等方面进行概述,为更好地应用该药以及开发该类新药提供基础资料。
1 化学性质及合成匹莫范色林化学名为1-(4-氟苄基)-3-(4-异丁氧基苄基)-1-(1-甲基哌啶-4-基)脲,结构见图 1。制剂时使用其酒石酸盐,成盐后为白色粉末;LgP计算值为4.67;在水中易溶,生物药剂学分类属于1类药物;熔点为167 ℃,同时伴有分解。
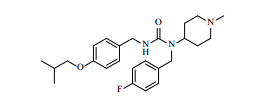
|
图 1 匹莫范色林化学结构 Fig. 1 Chemical structure of pimavanserin |
其合成方法有多种,主要的2个合成路线见图 2。路线1采用光气同化合物A反应生成酯,再同化合物C反应从而得到匹莫范色林[4]。该路线中间步骤需要进行无水处理,量产时较难控制;用到剧毒的光气,对生产人员的健康及周围环境的影响都较大。为克服上述缺点,焦培福等[5]报道了路线2,使用化合物C同氯甲酸酯反应生成D,D再同A反应即生成目标产物。该路线无需无水处理,避免了剧毒的光气,反应条件温和;无需特殊设备,易于进行质量控制及杂质分析。反应完成后加水即析出产物,抽滤、水洗即得到终产物,适合工业化生产。
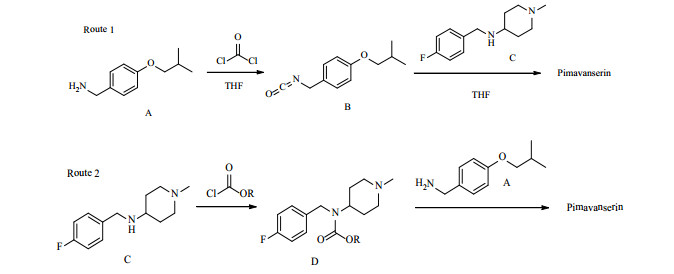
|
图 2 匹莫范色林的合成路线 Fig. 2 Route for synthesis of pimavanserin |
2 药理作用与药动学
匹莫范色林治疗帕金森症引起的幻觉和错觉的机制暂不明确。其通过对5-HT2A受体的反向和拮抗组合作用起效,同时对5-HT2C受体作用很小[6]。
体外实验表明,匹莫范色林可以竞争性拮抗已和同位素标记的酮色林结合的5-HT2A受体,细胞膜和整个细胞的平均pKi值分别为9.30和9.70。该药物显示了对5-HT2A受体反向拮抗作用,平均pIC50为8.73,平均抑制率为93%。该药对5-HT2C受体的亲和性和抑制性较5-HT2A受体低,细胞膜和整个细胞的平均pKi值分别为8.80和8.00[7]。该药对5-HT2B和多巴胺D2受体无亲和性和功能性作用[8]。
体内试验表明,给小鼠ig剂量为3 mg/kg的匹莫范色林后,可以减轻2, 5-二甲氧基-4-碘苯丙胺盐酸盐引起的头痛[9]。给大鼠sc或ig 3 mg/kg的匹莫范色林,均可以减弱地佐环平引起的过度活动[10]。
匹莫范色林的药动学研究是通过双盲安慰剂对照增量试验在男性志愿者身上进行的。1次po20、50、100、200、300 mg单剂量产生的平均血清浓度(Cmax)分别为9.2、20.3、49.7、111.3、151.8 ng/mL。推算至正无穷时血浆药时浓度曲线下面积(AUC)分别为706、1 315、3 742、7 335、10 798 (h·ng)/mL。每天多次给药50、100、150 mg产生的稳态平均Cmax为92.9、193.4、247.5 ng/mL,24 h内血浆AUC为1 838.7、3 804.6、4 680.3 (h·ng)/mL。峰值时间和半衰期分别为6、55 h[11]。8名志愿者进行的试验结果表明,速释的包衣片和直接口服该药溶液有99.7%的生物等效性,表明速释包衣片对生物等效性无影响[12]。
3 临床研究 3.1 帕金森精神病 3.1.1 Ⅱ期临床为验证匹莫范色林的有效性,Ⅱ期临床采用随机、双盲、多中心方案,试验结果中运动功能部分采用帕金森病联合评分标准法中(Unified Parkinson’s Disease Rating Scale,UPDRS)第二部分和第三部分进行评估[13];抗精神病效果采用阳性症状量表评分(Scale for the Assessment of Positive Symptoms,SAPS)和UPDRS中第一部分进行评估。60位帕金森精神病患者使用剂量为20~60 mg/d的匹莫范色林治疗28 d后,部分受试者症状明显改善。在初期安全性评估中,匹莫范色林组(n=24)和对照组(n=28)在UPDRS第二和第三部分的评分均值分别减少3.05和3.86;在初期有效性试验中,幻觉和错觉的SAPS部分的评分值下降了4.6(P=0.09)[14]。在之后的有效性试验阶段,匹莫范色林组幻觉和错觉的阳性症状量表部分评分均值分别下降了1.0(幻觉部分P=0.02,错觉部分P=0.03);UPDRS第一部分总评分下降了1.45(P=0.05)[14-15]。该结果表明匹莫范色林使患者的精神症状明显改善,且未引发运动损害或者其他精神症状,证明了其有效性和安全性。
3.1.2 Ⅲ期临床Ⅲ期临床采用随机、双盲、安慰剂对照方案共进行6周试验,受试者均为40岁以上的帕金森精神病患者。结果采用帕金森精神病阳性症状评分(Parkinson’s Disease-Adapted Scale for the Assessment of Positive Symptoms,SAPS-PD)进行评估。199位患者在经过42 d剂量为34 mg/d匹莫范色林治疗后,9项SAPS-PD总和共下降5.79分(n=95);而安慰剂组仅下降2.73分(n=90,P=0.001 4)。临床整体印象严重程度评分(Clinical Global Impression Severity Score,CGI-S)中,匹莫范色林组和安慰剂组病情严重程度评分分别下降了1.02和0.44(P=0.000 7);临床整体印象改善评分(Clinical Global Impression Improvement Score,CGI-I)分别提高了2.78和3.45(P=0.001 1)。阳性药组共有10人由于不良反应退出试验,而对照组仅有两人退出[16]。
对多个中心临床试验数据进行分析后发现,患者服用匹莫范色林后,同安慰剂相比SAPS-PD评分明显下降,下降值为2.87(P < 0.001);且CGI-S评分和CGI-I评分也明显改善[17]。临床Ⅲ期试验表明,服用匹莫范色林34 mg/d可显著减弱帕金森精神病症状。
3.2 精神分裂症Ⅱ期临床为验证匹莫范色林和利培酮是否比单独使用利培酮更加有效,匹莫范色林治疗精神分裂症Ⅱ期临床试验采用多中心、随机、双盲、安慰剂对照试验,结果采用阳性和阴性症状评分(Positive and Negative Syndrome Scale,PANSS),共进行6周,共423名患有慢性精神分裂症且近期恶化的受试者参与。试验组采用利培酮2 mg/d+20 mg/d匹莫范色林联合给药,对照组只单独给予利培酮2、6 mg/d。治疗43 d后,联合给药组PANSS评分下降23.0分(n=69)。安慰剂组评分分别下降16.3分(n=77,利培酮2 mg/d)和23.2分(n=76,利培酮6 mg/d)[18]。结果表明,匹莫范色林和利培酮联用并未比利培酮单独使用更加有效。但是,其他试验表明匹莫范色林和氟哌啶醇联合给药可以减弱氟哌啶醇引起静坐不能的副作用[19-20]。
4 不良反应统计每日服用34 mg匹莫范色林且发生率大于服用6周安慰剂的不良反应发现,总发生率≥2%的不良反应有恶心(匹莫范色林组7%,安慰剂组4%)、外周水肿(匹莫范色林组7%,安慰剂组2%)、意识模糊(匹莫范色林组6%,安慰剂组3%)、幻觉(匹莫范色林组5%,安慰剂组3%)、便秘(匹莫范色林组5%,安慰剂组小于1%)。由于不良反应,匹莫范色林组中总计8%的受试者退出试验,安慰组中为4%[17, 21]。
患有痴呆相关的精神疾病的老年患者使用此药可能会增加死亡的概率。该药未被批准治疗同帕金森引起的幻觉和错觉无关的痴呆相关的精神疾病。分析表明,较安慰剂组相比,17名受试者死亡风险提升1.6~1.7倍,风险原因有多种,主要来源于心血管原因和感染。匹莫范色林会延长受试者心脏的QT间期,因此该药不应同其他延长QT间期的药品共同服用[21]。
5 药物相互作用药物相互作用研究表明该药同左旋多巴联用时无需调整剂量[22]。当该药同强的CYP3A4抑制剂联用时,最好将剂量调整至17 mg/d。当该药同CYP3A4激动剂联用时,可以适当增加剂量[21]。
6 结语统计超过40%的帕金森症患者伴有精神病症状[23],这无疑为对已行动不便的患者雪上加霜。氯氮平和喹硫平常用于治疗帕金森精神病,但是这两种药常引发多种精神病症状,且喹硫平疗效不尽如人意。匹莫范色林上市后为帕金森患者带来了福音。该药物疗效好,副作用少,为受疾病折磨的广大患者雪中送炭。目前该药未在中国市场上市,起化学结构并不复杂,相信在药物一致性评价过程中会涌现出大量合格优质、价格低廉的仿制产品,造福国内的患者。
| [1] | 孙怡, 杨任民, 韩景献. 实用中西医结合神经病学[M]. 北京: 人民卫生出版社, 1998 : 51 . |
| [2] | 陈生弟. 中国帕金森病治疗指南(第二版)[J]. 中华神经科杂志, 2009,42(5):352–355. |
| [3] | Forsaa E B, Larsen J P, Wentzel-Larsen T, et al. A 12-year population-based study of psychosis in Parkinson disease[J]. Arch Neurol, 2010, 67(8):996–1001. |
| [4] | Vanover K E, Van Kammen D P, Tolf B R, et al. Use of pimavanserin in the treatment of parkinson and symptoms thereof[P].欧洲:EP2173343, 2010-04-14. |
| [5] | 焦培福, 耿巧红, 李辰灿, 等.一种匹莫范色林的制备方法[P].中国:104844502A, 2015-08-19. |
| [6] | Stahl S M. Mechanism of action of pimavanserin in Parkinson's disease psychosis:targeting serotonin 5HT2A and 5HT2C receptors[J]. Cns Spectrums, 2016, 21(4):271–275. doi:10.1017/S1092852916000407 |
| [7] | Bielenica A, Kedzierska E, Koliński M, et al. 5-HT 2, receptor affinity, docking studies and pharmacological evaluation of a series of 1, 3-disubstituted thiourea derivatives[J]. Eur J Med Chem, 2016, 116(7):173–186. |
| [8] | Vanover K E, Weiner D M, Makhay M, et al. Pharmacological and behavioral profile of ACP-103, a novel 5-HT 2A receptor inverse agonist[OL]. (2006-02-09)[2016-08-04]. http://jpet.aspetjournals.org/content/early/2006/02/09/jpet.105.097006.full.pdf. |
| [9] | Hubbard D, Hacksell U, Mcfarland K. Behavioral effects of clozapine, pimavanserin, and quetiapine in rodent models of Parkinson's disease and Parkinson's disease psychosis:evaluation of therapeutic ratios[J]. Behav Pharmacol, 2013, 24(7):628–632. doi:10.1097/FBP.0b013e3283656db6 |
| [10] | Mcfarland K, Price D L, Bonhaus D W. Pimavanserin, a 5-HT2A inverse agonist, reverses psychosis-like behaviors in a rodent model of Parkinson's disease[J]. Behav Pharmacol, 2011, 22(7):681–692. doi:10.1097/FBP.0b013e32834aff98 |
| [11] | Vanover K E, Robbins-Weilert D, Wilbraham D G, et al. Pharmacokinetics, tolerability, and safety of ACP-103 following single or multiple oral dose administration in healthy volunteers[J]. J Clin Pharmacol, 2007, 47(6):704–714. doi:10.1177/0091270007299431 |
| [12] | Vanover K E, Robbins-Weilert D, Wilbraham D G, et al. The effects of food on the pharmacokinetics of a formulated ACP-103 tablet in healthy volunteers[J]. J Clin Pharmacol, 2007, 47(7):915–919. doi:10.1177/0091270007299361 |
| [13] | Goetz C G, Fahn S, Martinez-Martin P, et al. Movement disorder society-sponsored revision of the unified Parkinson's Disease Rating Scale (MDSUPDRS):process, format, and clinimetric testing plan[J]. Mov Disord, 22(1):41-47. |
| [14] | Meltzer H Y, Mills R, Revell S, et al. Pimavanserin, a serotonin 2A receptor inverse agonist, for the treatment of Parkinson's disease psychosis[J]. Neuropsycho-pharmacology, 2010, 35(4):881–892. doi:10.1038/npp.2009.176 |
| [15] | Abbas A, Roth B L. Pimavanserin tartrate:a 5-HT2A inverse agonist with potential for treating various neuropsychiatric disorders[J]. Exp Opin Pharmacother, 2008, 9(18):3251–3259. doi:10.1517/14656560802532707 |
| [16] | Cummings J, Isaacson S, Mills R, et al. Pimavanserin for patients with Parkinson's disease psychosis:a randomised, placebo-controlled phase 3 trial[J]. Lancet, 2014, 383(9916):533–540. doi:10.1016/S0140-6736(13)62106-6 |
| [17] | Mills R, Friedman J H, Ondo W, et al. Efficacy and tolerability of pimavanserin in PD psychosis:analysis of an integrated phase 3 placebo-controlled dataset[J]. Mov Disord, 2015, 30(Suppl 1):S60. |
| [18] | Meltzer H Y, Elkis H, Vanover K, et al. Pimavanserin, a selective serotonin (5-HT) 2A-inverse agonist, enhances the efficacy and safety of risperidone, 2 mg/day, but does not enhance efficacy of haloperidol, 2 mg/day:comparison with reference dose risperidone, 6 mg/day[J]. Schizophr Res, 2012, 141(2/3):144–152. |
| [19] | Gardell L R, Vanover K E, Pounds L, et al. ACP-103, a 5-hydroxytryptamine 2A receptor inverse agonist, improves the antipsychotic efficacy and side-effect profile of haloperidol and risperidone in experimental models[J]. J Pharmacol Exp Therap, 2007, 322(2):862–870. doi:10.1124/jpet.107.121715 |
| [20] | Grahnen A E, Vanover K E, Weiner M, et al. Reduction of haloperidol-induced side effects by ACP-103 in healthy volunteers[J]. Clin Pharmacol Therap, 2005, 77(2):98. |
| [21] | Acadia Pharmaceuticals Inc. Prescribing information for NuplazidTM (pimavanserin) tablets, for oral use[EB/OL]. (2016-04-10)[2016-08-04]. http://www.acadia-pharm.com/wp-content/uploads/2016/04/NUPLAZID-pimavanserin-Package-Insert.Pdf. |
| [22] | Hensler J G, Artigas F, Bortolozzi A, et al. Catecholamine/Serotonin interactions:systems thinking for brain function and disease[J]. Adv Pharmacol, 2013, 68:167–197. doi:10.1016/B978-0-12-411512-5.00009-9 |
| [23] | Yasue I, Matsunaga S, Kishi T, et al. Serotonin 2A receptor inverse agonist as a treatment for Parkinson's disease psychosis:A systematic review and Meta-analysis of serotonin 2a receptor negative modulators[J]. J Alzheimers Disease Jad, 2015, 50(3):733–740. |
 2016, Vol. 39
2016, Vol. 39

