国内仿制药市场已经发展了数年,仿制药水平已经有了很大的提高,但是现在很多消费者还是只相信进口药品(原研厂家)。通过卡托普利片这款常用降压药质量的比对来比较国内厂家生产的药品和原研药品差异性。卡托普利(开博通)1981年时由百时美施贵宝公司开发研制上市,治疗高血压和某些类型的充血性心力衰竭。属于血管紧张素转换酶抑制剂类降压药物,也是第一类普利类降压药物。作为一只历史悠久的普利类降血压老药,其价格低廉,能为国内众多低收入患者所接受,也是临床医生的首选药品之一,适用于治疗各种类型高血压,为国家基本药物目录里的药物。规格有12.5 mg和25 mg两种,包衣主要有素片、薄膜衣片或者糖衣片,包装主要有铝塑和塑料瓶。本文以收集到的百时美施贵宝(原研厂家)以及其他5家国产厂家生产的卡托普利片为样品,按照《中国药典》2015年版第一增补本[1]对其进行全项检验,并对其二硫化物、溶出度、含量测定等项目进行比较研究,为仿制药一致性评价提供参考。
1 仪器与试药Waters e2675高效液相色谱仪(美国Waters公司);Agilent HC-C18色谱柱(250 mm×4.6 mm,5 μm)RCQ-8D溶出仪(天津天大天发公司);XS205电子天平(瑞士梅特勒公司);磷酸二氢钠(分析纯,南京化学试剂有限公司),磷酸(分析纯,南京化学试剂有限公司),甲醇、乙腈(色谱纯,Honey Well有限责任公司);卡托普利二硫化物对照品(中国食品药品检定研究院,批号100319-200602,无需干燥,质量分数100%),卡托普利对照品(中国食品药品检定研究院,批号100318-200602,无需干燥,质量分数99.5%);原研厂家样品IM(批号1404031);国内厂家:DM1(批号1406061)、DM2(批号14021312)、DM3(批号27140201)、DM4(批号20140402)、DM5(批号140901)均为市售品。
2 方法与结果 2.1 卡托普利二硫化物测定 2.1.1 实验条件与方法避光操作。精密称取本品的细粉适量(约相当于卡托普利25 mg),置50 mL置瓶中,加流动相适量,超声处理15 min,放冷,加流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液(8 h内使用),每个厂家制剂做6份平行试验,以均值±RSD代入计算。另取卡托普利二硫化物对照品,精密称定,加甲醇适量溶解,用流动相定量稀释制成约15 μg/mL的溶液,作为对照品溶液。再取卡托普利与卡托普利二硫化物对照品,加甲醇适量溶解,用流动相稀释制成各约0.1 mg/mL与15 μg/mL的混合溶液,作为系统适用性溶液。按高效液相色谱法(附录Ⅴ D)试验,以十八烷基硅烷键合硅胶为填充剂;0.01 mol/L磷酸二氢钠溶液-甲醇-乙腈(70:25:5)(用磷酸调节PH至3.0);检测波长为215 nm;柱温40℃。取系统适用性试验溶液50 μL,注入液相色谱仪,卡托普利峰与卡托普利二硫化物峰之间的分离度应大于4.0。取对照品溶液50 μL,注入液相色谱仪,调节检测灵敏度,使卡托普利二硫化物色谱峰的峰高约为满量程的50%;再精密量取供试品溶液与对照品溶液各50 μL,分别注入液相色谱仪,记录色谱图;供试品溶液的色谱图中如有卡托普利二硫化物保留时间一致的色谱峰,按外标法以峰面积计算,不得过卡托普利标示量的3.0%。
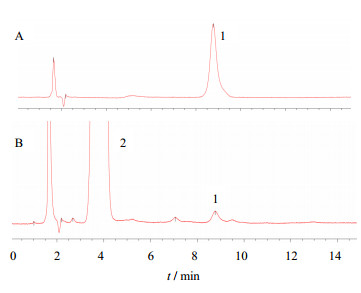
2.1.2 二硫化物结果与评价卡托普利二硫化物是卡托普利在合成中的中间体[2],是卡托普利制剂中的一个已知杂质。卡托普利与空气接触后易降解出该杂质,所以本实验都在供试溶液配制3 h内进样。杂质含量的高低反映了药品的纯度,影响药品的安全性、有效性,应该严格加以控制。二硫化物对照品及供试品色谱图见图 1,不同厂家间二硫化物结果见表 1。
|
1-卡托普利二硫化物;2-卡托普利 1-captopril-disuphide; 2-captopril 图 1 卡托普利二硫化物对照品(A)和样品(B)色谱图 Fig. 1 Chromatogram of captopril-disuphide reference (A) and sample (B) |
| 表 1 卡托普利二硫化物计算结果 Table 1 Contents of captopril-disuphide |
可以看出虽然二硫化物都小于标准规定限度3.0%,但是最高和最低相差2.45%。空气中的水分会促进卡托普利降解为二硫化物,观察发现二硫化物含量较高的都是塑料瓶包装,且包装较为简易,可能在贮存期间吸收了水分导致。二硫化物含量的高低还与各厂家的合成路线,制剂水平,包衣方法有关。
2.2 卡托普利的溶出度测定 2.2.1 实验条件与方法照溶出度测定法(附录XC第二法),以水900 mL为溶出介质,转速为75 r/min,依法操作,经20 min时,取溶液适量,滤过,取续滤液作为供试品溶液;另精密称取卡托普利对照品适量,加水溶解并定量稀释制成约28 μg/mL(25 mg规格)和14 μg/mL(12.5 mg规格),作为对照品溶液,平行2份。照含量测定项下的方法测定,计算每片的溶出量,限度为标示量的80%。各厂家与原研厂家平均溶出度结果进行比较,20 min溶出度合格率为100%,结果见表 2。
| 表 2 各厂家卡托普利溶出度结果 Table 2 Results of the dissolution of the various manufacturers |
2.2.2 溶出曲线的绘制
为了进一步考察该药品的溶出行为,依上述标准操作,分别在5、10、15、20、30 min分别取样5 mL并及时补充37 ℃的溶出介质,依次对几个时间点进行测定。每个厂家制剂取6片进行平行试验,结果以x±s计算结果。并以原研厂家为参比制剂,绘制溶出曲线。结果见图 2。

|
图 2 各厂家卡托普利片溶出曲线 Fig. 2 Dissolution curves of each manufacturer Captopril Tablets |
2.2.3 溶出行为相似度的评价
采用FDA发布的《口服固体制剂溶出度试验技术指导原则中》推荐的相似因子f2来评价各厂家的溶出曲线与参比制剂之间的差异性,50≤f2≤100则认为两条溶出曲线是相似的。f2=50×log{[1+(1/n)∑t=1nl (Rt−Tt)2]− 0.5×100}[3],采用5、10、15、20 min 4个时间点计算,统计结果见表 3。
| 表 3 卡托普利溶出曲线f2相似因子评价 Table 3 Similarity factor f2 of dissolution curve of Captopril Tablets |
由表 2、图 2可以看出,虽然在标准规定的溶度时间点20 min,各厂家的溶出度均大于标准规定的80%,但是各厂家间的溶出行为还是存在差异性。在前10 min,只有一个厂家的溶出度数值接近参比试剂。在相似行为的评价中有两家的相似程度较差。这可能与各厂家的产品晶型、制剂工艺、原辅料来源均有关系。
2.3 卡托普利定量测定[1]用十八烷基硅烷键合硅胶为填充剂,以0.01 mol/L磷酸二氢钠-甲醇-乙腈(70:25:5)(用磷酸调节pH值至3.0)为流动相;测定波长为215 nm;柱温为40 ℃。取本品20片,(糖衣片去除糖衣)精密称定,研细。精密称取适量(约相当于卡托普利10 mg),置100 mL量瓶中,用流动相适量,振摇使卡托普利溶解,用流动相稀释至刻度,摇匀,滤过,精密量取续滤液20 μL,注入液相色谱仪,记录色谱图,另取卡托普利对照品,精密称定,加流动相溶解并定量稀释制成约0.1 mg/mL的溶液,同法测定,平行2份,按外标法以峰面积计算,即得。每个厂家制剂做6份平行试验,以均值±RSD代入计算。本品含卡托普利应为标示量的90.0%~110.0%。用同一标准溶液,同一液相仪器进样,计算结果见表 4。
| 表 4 卡托普利及卡托普利二硫化物测定结果 Table 4 Results of captopril and captopril-disuphide |
3 讨论
总体来看各厂家的卡托普利片质量都在标准范围之内,都是合格的产品。因为这是一种降血压的常用药,用量比较大,如果从经济实用的角度考虑,完全可以选择国内厂家的产品。
但是在卡托普利二硫化物(杂质)这个项目中,有些厂家的含量偏高。这与包装工艺、制剂工艺、合成路线等有关。特别是用塑料瓶包装的,是100片/瓶的规格,打开后用药时间较长,存放中难免会吸潮造成二硫化物的增加。如果加上生产中的二硫化物含量本来就很高,很可能超过限度,影响疗效。所以建议厂家在降低包装成本与保证药品质量之间找到一个很好的平衡点。
溶出曲线表明,原研厂家与其他厂家间的溶出行为存在差异。在药品生产过程中原辅料的粒度、晶型、制粒的均一性、辅料的黏度、压片的硬度等均会影响溶出度的结果。而溶出行为又会影响生物利用度,从而影响疗效[4]。各厂家在制剂工艺的改进中,不能只以溶出终点作为依据。还要加入溶出行为的考察,力争提高工艺水平。
| [1] | 中国药典[S].第一增补本. 2010. |
| [2] | 周群, 樊学忠, 张倩, 等. 卡托普利中间体的制备工艺改进[J]. 应用化工, 2009(11):1692–1693. |
| [3] | 谢沐风. 简介"药品品质再评价"工程(溶出度研究系列一)[J]. 中国药品标准, 2005,6(6):42. |
| [4] | 傅蓉, 马明欣, 潘强, 等. 国产卡托普利片溶出度对比分析[J]. 中国药师, 2012,1(7):954–956. |
 2016, Vol. 39
2016, Vol. 39

