2. 中国医科大学药学院, 辽宁 沈阳 110001;
3. 大连医科大学药学院, 辽宁 大连 116044
2. College of Pharmacy, China Medical University, Shenyang 110001, China ;
3. College of Pharmacy, Dalian Medical University, Dalian 116044, China
雷公藤多苷是从卫矛科植物雷公藤Tripterygium wilfordii Hook. F.去皮根中提取精制的有效部位混合物,为我国首先研究利用的抗炎免疫调节中药提取物[1]。雷公藤多苷片与其他雷公藤制剂相比具有用量小、不良反应少等优点,早在1984年就投入临床使用,广泛应用于治疗类风湿性关节炎、肾病综合征、白塞综合征、麻风、自身免疫性肝炎及皮肤病等疾病,疗效显著,其生理活性是由二萜内酯、生物碱、三萜等多种成分协同产生[2-4]。雷公藤多苷片是目前临床上使用较多的非甾体类免疫抑制剂。
目前国内雷公藤多苷片还没有很完善的质量控制标准,报道中多以有效成分的含量测定为指标进行控制[5-9],以至不同厂家的产品存在不同程度的差异,为了准确地控制雷公藤多苷片中有效成分群的含量,建立雷公藤多苷片的指纹图谱[10],对其临床用药的有效性和安全性有很大的意义。本实验采用高效液相色谱法建立雷公藤多苷片指纹图谱,对市售的多个厂家的雷公藤多苷片进行指纹图谱研究,并利用主成分分析法(PCA)对指纹图谱进行统计分析,为更好地控制雷公藤多苷片的内在质量提供有用的参考。
1 仪器与试药Agilent LC 1100型高效液相色谱仪(美国Agilent公司),Agilent 1100型DAD检测器(美国Agilent公司),Chemstation for LC 3D色谱工作站(美国Agilent公司),AE200电子天平(Mettler),KQ2200B超声仪(昆山市超声仪器有限公司)
雷公藤粉末(江苏A制药有限公司),雷公藤多苷片(M1,江苏A制药有限公司,批号140319、140422、140513),雷公藤多苷片(M2,浙江B天然药物有限公司,批号131102),雷公藤多苷片(M3,黄石C制药有限公司,批号20140101),雷公藤多苷片(M4,上海D制药有限公司,批号140201),雷公藤多苷片(M5,安徽E药业有限公司,批号130701),雷公藤多苷片(M6,浙江F有限公司,批号1404123B),雷公藤多苷片(M7,湖南G药业有限公司,批号20140201),中性氧化铝(天津市科密欧化学试剂有限公司),乙腈(国药集团化学试剂有限公司),醋酸乙酯(国药集团化学试剂有限公司)。
2 方法与结果 2.1 供试品溶液的制备采用均匀取样法从雷公藤多苷片中取出15片,研细成粉,精密称取400 mg,置于25 mL三角烧瓶中。加入20 mL醋酸乙酯,超声提取30 min,滤过,滤液过15 g中性氧化铝柱,用30 mL醋酸乙酯洗脱,收集全部过柱后的洗脱液。回收醋酸乙酯,得残存物,加1.5 mL乙腈溶解,0.45 pm微孔滤膜滤过,备用。
2.2 色谱条件[6]色谱柱为Agilent C18色谱柱(200 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱(0~70 min,35:65→100:0);体积流量1.0 mL/min;柱温30 ℃;检测波长218 nm;进样量20 μL。
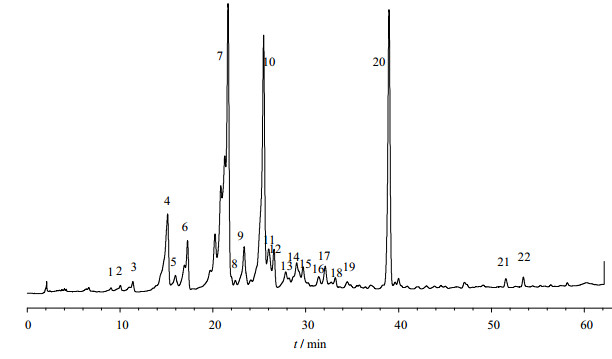
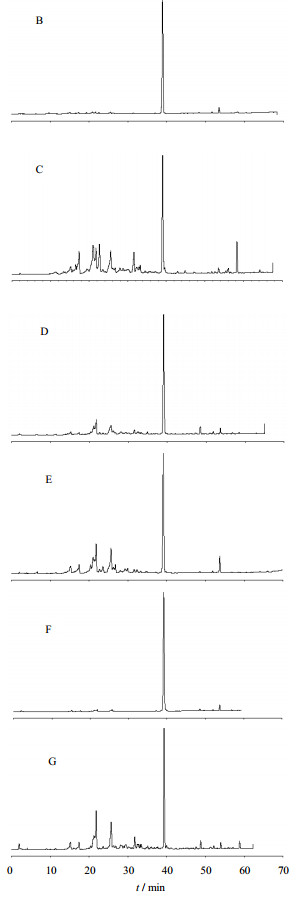
2.3 指纹图谱方法学建立与测定按上述方法制备样品,测定了7个厂家的指纹图谱,色谱图差距较大,其中厂家A的指纹峰较多,因此以厂家A的3批雷公藤多苷片为供试品,注入色谱仪,记录色谱图,其典型的HPLC的色谱指纹图谱见图 1。共确立22个共有峰,其中20号色谱峰较强,且为7个厂家共有的色谱峰,选定其为内参比峰。其余6各厂家色谱图见图 2。
|
图 1 雷公藤多苷片(厂家A)的HPLC色谱指纹图谱 Fig. 1 HPLC fingerprint of TGT |
|
图 2 其余各厂家的HPLC色谱图 Fig. 2 HPLC Chromatogram of TGT of rest of the manufacturers |
2.3.1 稳定性试验
取厂家A雷公藤多苷片样品的供试品溶液,分别在0、2、4、8、12 h进样测定。以20号峰为内参比峰,计算各共有峰的色谱相对保留时间和相对峰面积。结果显示,22个共有峰的色谱相对保留时间的RSD均小于0.58%、相对峰面积的RSD均小于5.78%。
2.3.2 精密度试验取厂家A雷公藤多苷片样品的供试品溶液,连续进样5次,计算各共有峰的色谱相对保留时间和相对峰面积。结果22个共有峰的色谱相对保留时间的RSD均小于0.54%、相对峰面积的RSD均小于4.65%。
2.3.3 重复性试验取厂家1雷公藤多苷片样品,平行取5份,按供试品溶液制备方法提取,得供试品溶液,分别进样检测,计算各共有峰的色谱相对保留时间和相对峰面积。结果显示,22个共有峰的色谱相对保留时间的RSD均小于0.66%、相对峰面积的RSD均小于5.85%。
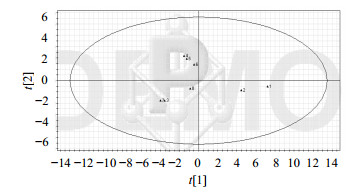
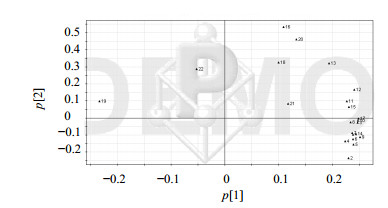
2.3.4 指纹图谱的评价方法采用SIMCA-P软件进行PCA统计分析,以各主要色谱峰的保留时间和峰面积为变量得到score图和loading图。由score图可见厂家A的片剂和多苷提取物聚集在一个区域,而其他厂家则分散在不同区域,其中浙江产地的厂家B和F紧密聚集在同一区域,结果见图 2、3。
|
图 2 Score分布图 Fig. 2 Score plots |
|
图 3 Loading分布图 Fig. 3 Loading plots |
3 讨论
目前市售的雷公藤多苷片共有11家(2015年新增3家),本研究收集购买了7家产品进行研究比较,并采用SIMCA-P软件进行PCA统计分析,可更加直观的表明不同产地、不同厂家的雷公藤多苷片的区分情况,且划分区域明显,提示不同厂家因所用药材产地不同,所含化学成分及其含量有较大差别。本研究为更好地控制雷公藤多苷片的内在质量提供了有用的参考。
| [1] | 姚骥如, 孙莹, 罗顺葵, 等. 雷公藤多苷的临床应用进展[J]. 中国新药与临床杂志, 2010,29(3):179–182. |
| [2] | 郭雪红. 雷公藤多苷的药理作用及临床应用概述[J]. 中成药, 2010,32(7):1199–1202. |
| [3] | 张月琴. 雷公藤多苷抗炎作用的研究[J]. 医药导报, 2012,31(3):295–297. |
| [4] | Wong K F, Yuan Y, Luk J M. Tripterygium wilfordii bioactive compounds as anticancer and anti-inflammatory agents[J]. Clin Exp Pharmacol Physiol, 2012, 39(3):311–320. doi:10.1111/j.1440-1681.2011.05586.x |
| [5] | 鲍立曾, 刘法千, 熊仕强. HPLC法测定雷公藤多苷中雷公藤内酯醇的含量[J]. 药物分析杂志, 2007,27(6):896–898. |
| [6] | 庄莹, 宋敏, 杭太俊, 等. 雷公藤多苷片中雷公藤总内酯及雷公藤内酯醇的测定[J]. 药物分析杂志, 2008,28(1):36–40. |
| [7] | 刘法千, 鲍立曾, 熊仕强. HPLC法测定雷公藤多苷中雷公藤内酯甲的含量[J]. 中国药品标准, 2007,8(4):38–40. |
| [8] | 农凤鸣, 陆兴毅. HPLC法测定雷公藤多苷片中雷公藤内酯甲的含量[J]. 中国药师, 2011,14(4):507–509. |
| [9] | 何昱, 石森林, 张茹萍, 等. 雷公藤多苷主要有效成分的含量研究[J]. 药物分析杂志, 2013,33(2):197–200. |
| [10] | 梁健, 沈熊, 朱孝国, 等. 雷公藤多苷片的HPLC指纹图谱[J]. 中国临床药学杂志, 2013,22(1):9–13. |
 2016, Vol. 39
2016, Vol. 39


