目前,糖尿病已成为威胁人类健康的第三大重大疾病,仅次于心脑血管疾病和肿瘤[1-2]。随着近年来其发展趋势的年轻化和大众化,新型胰岛素类似物的开发逐渐成为众多研究者关注的焦点[3-6]。聚乙二醇化重组人胰岛素注射液(PEG-Det)属生物工程一类新药,是通过对地特胰岛素(Det)聚乙二醇(PEG)修饰后得到,其应用前景非常广阔。本试验通过研究PEG-Det在毒性剂量暴露下的毒代动力学与毒效动力学的动态变化,探究其系统暴露程度和持续时间以及在体内的蓄积情况,为该药的进一步临床试验提供参考。
1 材料 1.1 药品及主要试剂聚乙二醇化重组人胰岛素注射液(PEG-Det,规格9.5 mg/3mL,批号20110401)、PEG-Det溶媒(规格10 mL/支,批号20110401),均由重庆富进生物医药有限公司提供。抑肽酶(规格5 mg/瓶,批号6247884),比活>5 500 IU/mg,为美国罗氏公司产品(进口分装)。
胰岛素放射免疫分析试剂盒,北京北方生物技术研究所,批号为20111120、20120120,主要用于定量检测犬血浆样品中胰岛素水平;犬C肽放射免疫分析试剂盒,美国Millipore公司,批号为1963996A,主要用于定量检测犬血浆样品中C肽水平。
1.2 主要仪器Thermo Scientific Sorvall ST 16R低温离心机(美国Thermo公司);Accu-Chek Performa卓越型血糖仪(罗氏公司);GAMMA-C12计数仪(德国DPC公司);2470 WIZARD2全自动伽玛计数仪(美国Perkin Elmer公司);LXJ-IIB低速大容量多管离心机(上海安亭科学仪器厂);GL-802A型微型台式真空泵(海门市其林贝尔仪器制造有限公司);DK-98-IIA型电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.3 实验动物健康成年Beagle犬32只,体质量6~8 kg,雌雄各半,由安徽阜阳市维光实验动物中心提供,实验动物生产许可证号:SCXK(皖)2011-001。所有动物均有检疫证书和个体档案,研究方案经实验动物管理与使用委员会(Institutional Animal Care and Use Committee,IACUC)认证批准。动物实验操作均在GLP实验室进行。动物饲养于天津药物研究院新药评价有限公司动物实验楼,温度设定范围20~26 ℃,湿度设定范围40%~70%,换气次数不少于8次全新风/h,光照时间为12 h/12 h明暗交替。犬粮由北京科澳协力饲料有限公司提供,自由饮用城市生活自来水。
2 方法 2.1 动物分组及给药32只Beagle犬按体质量随机分为4组:溶媒对照组和PEG-Det低、中、高剂量组,每组8只,雌雄各半;根据预试验结果及相关技术指导原则,PEG-Det低、中、高剂量组的剂量分别设定为37.5、75.0、150.0 µg/kg,分别相当于临床拟用剂量的1.97、3.95、7.89倍;所有动物每周于颈背部sc给药2次,给药体积为0.2 mL/kg,连续重复给药9个月,动物给药后6 h统一饲喂。实验中期即给药3个月时各组统一剖杀2只动物,高剂量组1只雄性动物于给药d125死亡。
2.2 血样采集及血糖测定血药浓度采血时间:分别于d1(首次给药)、M3(d89,给药3个月)、M9(d260,给药9个月)的0(药前)、0.5、2.0、4.0、6.0、12.0、24.0、48.0、72.0(药后)h于前肢隐静脉采血;多次给药稳态波峰、谷采血时间:d78、d82、d85、d246、d250、d253、d257的0 h(药前)、6 h(药后),于前肢隐静脉采血。用肝素抗凝采血管从前肢隐静脉采血约2 mL,加入含肝素钠抗凝的真空采血管中,4℃、3 000 r/min离心20 min,制备血浆,分装2管,其中一份加入抑肽酶(500 kU/mL)以防血液中所含C肽发生蛋白酶水解,样品于-20 ℃保存,直至测定。与血药浓度采血时间点同步进行血糖测定,于前肢隐静脉采血,即刻采用血糖仪检测全血血糖。
2.3 Beagle犬校正后血药浓度测定由于正常动物体内含内源性胰岛素,它将干扰血药浓度测定。通常胰岛素和C肽在体内是等分子分泌,测定血浆中犬C肽水平可用于校正内源性胰岛素的水平。本研究采用定量检测特异性犬C肽试剂盒,与胰岛素同步检测血浆中犬C肽浓度以扣除犬内源性胰岛素对外源性胰岛素测定的影响。
Iext=It-CtI0/C0
Iext是注射后t时间的校正胰岛素浓度,It是注射后t时间的总胰岛素浓度,Ct是t时的C肽浓度,I0是初始内源性胰岛素浓度,C0是初始时C肽浓度[7-8]。
采用放射免疫分析(RIA)法测定的各时间点总胰岛素浓度减去时间点利用C肽校正过的内源性胰岛素浓度,得到校正后的胰岛素浓度。
2.4 毒代动力学参数计算及蓄积评价单次和多次给药的血药浓度-时间测定数据采用DAS 3.0(北京博之音科技有限公司)药动程序,非房室模型拟合计算毒代动力学参数,包括:药时曲线下面积(AUC0-t、AUC0-∞和AUCss)、峰浓度(Cmax)、消除相半衰期(t1/2z)、清除率(CLz)和达峰时间(tmax),其中tmax、Cmax采用实测值,AUC采用统计矩法计算。计算蓄积指数(R),即末次给药的Cmaxss和AUC0-tss分别与首次给药的Cmax1和AUC0-t1的比值(RCmax=Cmaxss/Cmax1,RAUC=AUC0-tss/AUC0-t1),以评价是否存在蓄积效应。
3 结果 3.1 血糖测定结果32只健康Beagle犬单次或多次sc不同剂量(0、37.5、75.0、150.0 µg/kg)PEG-Det后平均血糖浓度-时间曲线见图 1。结果表明,Beagle犬给药后随血药浓度升高的同时,伴随着血糖的降低,且与剂量呈一定相关性。给药后2 h血糖开始下降,4~6 h内降至最低,且维持在一较低水平内,随着血药浓度的降低,血糖水平逐渐升高。具体血糖变化趋势为:首次给药,各剂量组于给药后的12 h基本恢复到给药前的血糖基础水平;给药中期(d89),低和中剂量组在给药后的12 h能恢复到给药前的血糖基础水平,而高剂量组在给药后的72 h才恢复到给药前水平;给药后期(d260),低、中剂量组动物血糖降低程度明显减弱,24 h后血糖恢复到基础水平,而高剂量组的血糖在72 h恢复到药前基础水平。上述结果提示,随给药时间的延长,动物给药后血糖降低的程度呈下降趋势,持续时间呈上升趋势,并与给药剂量呈正相关;随给药频率增加,血糖降低幅度减小,降低了由药物所致低血糖以及由此而引起的风险。
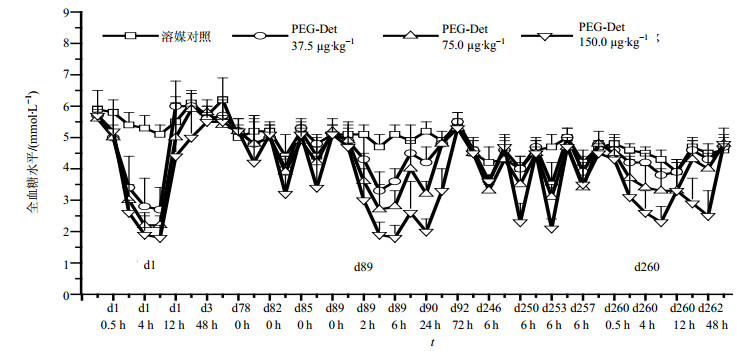
|
图 1 Beagle犬单次或多次sc不同剂量PEG-Det后的血糖-时间变化曲线图 Fig. 1 Mean blood glucose level-time curves after single or multiple sc administration of PEG-Det in Beagle's dogs |
3.2 RIA法测定犬血浆胰岛素浓度的方法学确证
标准曲线:配制不同浓度的PEG-Det溶液,使其终浓度分别为:5、15、45、135、405 μU/mL(按1 mg相当于10.5 U换算后配制而成,U表示为胰岛素效价);在此浓度范围内,药物浓度对数与B/B0(各管计数与零标准管计数的比值)呈Logistic线性相关。PEG-Det注射液的平均标准曲线方程为:Y=0.759+104.406/[1+(X/40.343)0.856](n=24),分析方法的线性范围为5~405 μU/mL(X为待测样品浓度,Y为样品测定的cpm值)。在标准曲线范围内,将PEG-Det配制成低、中、高(30、60、150 μU/mL)3个浓度的质控(QC)样品,测定的批间、批内精密度和准确度均在-15%~15%范围内。QC样品在25 ℃或4 ℃储存1 d、-20 ℃储存1 d或60 d、-20 ℃经历3次冻融循环等5种不同条件下均可稳定保存,准确度在-15.1%~2.8%。当稀释度不大于1:16时,用犬空白血浆稀释样品对测定结果的影响不大。该方法特异性良好,胰高血糖素、促黄体生成素、卵泡刺激素、胰岛素原、生长抑素等5种肽类或蛋白类激素对测定的交叉反应率均≤0.27%。以上方法学验证结果表明,本研究所建立的RIA方法能满足PEG-Det非临床毒代动力学研究的基本要求。
3.3 RIA法测定犬血浆C肽浓度的方法学确证标准曲线:采用试剂盒提供的犬C肽标准品,制备其终质量浓度为0.172、0.344、0.688、1.375、2.750、5.500、11.000、22.000 ng/mL的溶液;在此浓度范围内,药物浓度对数与B/B0呈Logistic线性相关。PEG-Det注射液的平均标准曲线方程为:Y=0.424+101.308/[1+(X/2.040)1.025](n=7)。分析方法的线性范围为0.172~22.000 ng/mL。在标准曲线范围内,将犬C肽配制成低、中、高(0.7、1.8、7.0 ng/mL)3个浓度的质控(QC)样品,测定的批间、批内精密度和准确度均在-15%~15%。
3.4 校正后的犬血浆中胰岛素浓度测定健康Beagle犬单次或多次sc不同剂量PEG-Det后的平均药时曲线变化比较见图 2。结果显示,Beagle犬sc给药后的血药浓度随时间呈动态变化,并与剂量呈正相关。给药后血浆药物缓慢释放呈逐渐升高趋势,在药后2~24 h内血药浓度一直维持在相对高的水平范围内,其后逐渐降低,72 h时仍能检测到血浆中药物浓度(平均约降至峰浓度的1/10~1/3)。但随给药次数的增加,血药浓度逐渐趋于平稳。Beagle犬单次与多次sc PEG-Det在相同时间不同剂量下的血药浓度随时间的动态变化趋势较为一致;但在相同剂量下,随给药频率的增加平均药时曲线分布更加趋于平缓。另外,经多次给药后的波峰-谷稳态浓度测定结果显示,其血浆药物浓度变化已基本趋于稳态。
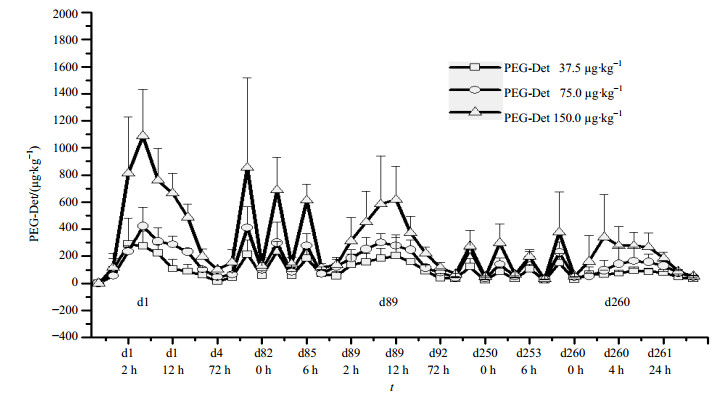
|
图 2 Beagle犬单次或多次sc不同剂量PEG-Det后的药时曲线图 Fig. 2 Mean plasma concentration-time curves after single or multiple sc administration of PEG-Det in Beagle's dogs |
3.5 毒代动力学(TK)参数计算和分析
将校正后的胰岛素浓度数据用DAS 3.0药动学计算程序进行数据处理,Beagle犬单次或多次sc不同剂量PEG-Det在不同时间的平均TK参数比较列于表 1,平均AUC0-72h和Cmax变化曲线比较见图 3。结果显示,Beagle犬单次(d1)sc PEG-Det 3个不同剂量(37.5、75.0、150.0 µg/kg)后,AUC和Cmax与剂量呈正相关,其平均AUC(0-72h)分别为(6 187±2 256)、(12 157±1 466)和(27 542±5 066)μU/mL·h;平均Cmax为(318.2±167.9)、(427.4±132.6)和(1 133.2±396.7)μU/mL。多次给药中期(d89),AUCss和Cmax均与剂量呈正相关,达稳态AUCss和AUC0-72 h均分别为(8 322±3 010)、(12 223±2 575)和(21 772±6 512)μU/mL·h;Cmax为(238.8±117.3)、(320.4±71.8)和(681.4±347.7)μU/mL。多次给药末期(d260),AUCss和Cmax均与剂量呈正相关,达稳态AUCss和AUC(0-72h)均分别为(4 429±508)、(7 316±2 209)和(10 897±2 929)μU/mL·h;Cmax为(110.7±30.3)、(178.2±108.2)和(394.6±274.7)μU/mL。低、中和高3个剂量的Cmax均随给药频率的增加而逐渐降低;高剂量组的AUC随给药频率增加逐渐降低,而低和中剂量在给药中期(d89)的AUC变化不明显,但在给药末期(d260)呈现下降趋势。各剂量组在给药不同阶段的消除半衰期t1/2z变化范围约为20~30 h,体现其长效的作用特点。达峰时间Tmax和清除率CLz/F均在一定范围内波动,不与剂量相关。
| 表 1 Beagle犬sc不同剂量PEG-Det后的平均TK参数比较 Table 1 Comparison of mean TK profiles after single or multiple sc administration of PEG-Det in Beagle's dogs |
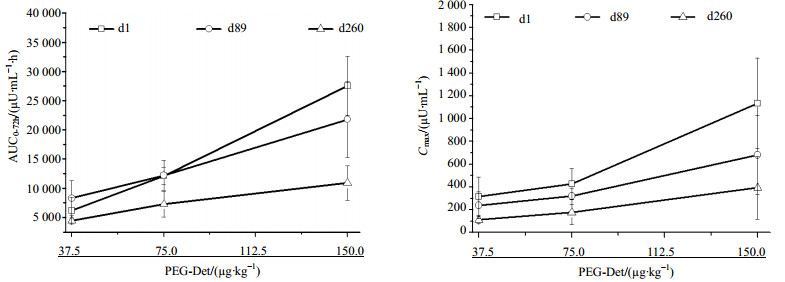
|
图 3 Beagle犬单次或多次sc PEG-Det后的平均AUC0-72h和Cmax与剂量的变化曲线图 Fig. 3 Comparison on mean AUC0-72h and Cmax-dose curves after sc administration of PEG-Det in Beagle's dogs |
3.6 多次给药后药物蓄积评价
Beagle犬sc不同剂量PEG-Det后的蓄积指数计算结果见表 2。结果显示,随给药次数增加,RCmax逐渐降低,给药末期(d260)与给药中期(d89)相比,降低近1倍,且R值均<1;在给药中期(d89)的高剂量组和给药末期(d260)的低、中和高3个剂量组的RAUC<1,且有随给药剂量和给药次数增加而降低的趋势。在重复给药近9个月(d260)后,3个剂量组的平均血浆峰浓度为首次给药的40%~50%间,药物暴露量(AUC)也为首次给药的45%~85%,提示Beagle犬经多次sc给药后体内无药物蓄积。
| 表 2 Beagle犬单次或多次sc不同剂量PEG-Det后的蓄积指数 Table 2 Accumulation index profiles after single or multiple sc administration of PEG-Det |
4 讨论
PEG-Det属生物技术I类新药,TK研究是毒性研究的一个重要组成部分。Det作为已上市的新一代长效胰岛素类似物,其降糖疗效平稳而持久,个体变异小,低血糖和体质量增加发生率均较低[9~12]。据其用药说明提示,Det的消除相半衰期约为5~7 h,最长作用持续时间达24 h,因此患者临床应用时只需每日注射1次或2次。本研究中Beagle犬重复sc不同剂量的PEG-Det后,消除相半衰期t1/2z均在20~30 h波动。相比Det,PEG-Det药效作用时间显著延长,且每周给药两次即可维持有效的药物浓度,这大大降低了由低血糖带来的安全性风险。PEG-Det的长效作用机制是由于对Det进行的PEG化修饰。PEG可使蛋白质或多肽分子上形成保护层,增大相对分子质量并增加药物的水溶性。相对分子质量的增大会降低肾小球的清除速率,增加药物在体内循环的半衰期,从而获得长效缓释的作用[13-15]。
基于生物技术药物的特点,本研究采用了灵敏度极高的RIA法检测血浆中胰岛素和C肽浓度,并同步检测血糖水平的动态变化,以进行毒代动力学-毒效学(TK-TD)模型的相关性分析。结果显示,PEG-Det经多次给药后,犬血浆中胰岛素浓度趋于平稳,波峰/波谷比例减小;同步监测的血糖降低幅度也随给药时间和频率增加逐渐变小,显示TK-TD两者研究结果具有一定的一致性,提示该药在临床应用时,如果设定合理的给药剂量和间隔,不仅能很好地维持长效药效浓度的发挥,还能降低由低血糖带来的安全性风险。此外,末次给药期与首次相比,蓄积指数(RCmax和RAUC)均小于1,提示连续给药9个月后体内无药物蓄积。但同时发现随着给药频率的增加,暴露量(AUC和Cmax)却呈降低趋势,这是由于PEG-Det在长期给药后可刺激动物细胞膜产生胰岛素受体数量上调,从而受体与药物结合最终导致了血药浓度的降低。
由此可见,PEG化的Det确实能改善和提高TK-TD特性,延长半衰期,降低清除率,增加暴露量,减小血清峰-谷浓度比率,延缓药物体内作用时间,具有长效作用及良好的安全性。另外,对于药物进入体内的作用及消除机制尚待深一步的研究。
| [1] | Ginter E, Simko V. Global prevalence and future of diabetes mellitus[J]. Adv Exp Med Biol, 2012, 771:35–41. |
| [2] | 张晓春. 糖尿病发展现状分析[J]. 临床医学实践, 2015,24(10):184–186. |
| [3] | 曹凤林, 郑少雄. 胰岛素类似物:糖尿病治疗的新选择[J]. 医学综述, 2007,13(1):32–34. |
| [4] | Caparrotta T M, Evans M. PEGylated insulin Lispro, (LY2605541)-a new basal insulin analogue[J]. Diabetes Obes Metab, 2014, 16(5):388–395. doi:10.1111/dom.12196 |
| [5] | Rendell M. Insulin degludec:a long-acting modern insulin analogue with a predictable pharmacokinetic/pharmacodynamic profile[J]. Drugs Today (Barc), 2013, 49(6):387–397. |
| [6] | Szypowska A, Golicki D, Groele L, et al. Long-acting insulin analogue detemir compared with NPH insulin in type 1 diabetes:a systematic review and meta-analysis[J]. Pol Arch Med Wewn, 2011, 121(7-8):237–246. |
| [7] | Jacobsen L V, Sogaarb B, Riis A. Pharmacokinetics and pharmacodynamics of a premixed formulation of soluble and protamine-retarded insulin aspart[J]. Eur J Clin Pharmacol, 2000, 56(5):399–403. doi:10.1007/s002280000159 |
| [8] | 毛晓明, 梁秉文, 绕亚萍, 等. 胰岛素经皮给药的药代动力学研究[J]. 中国药学杂志, 2000,35(11):760–762. |
| [9] | Goldman-Levine J D, Lee K W. Insulin detemir-a new basal insulin analog[J]. Ann Pharmaeother, 2005, 39(3):502–507. doi:10.1345/aph.1E334 |
| [10] | Pieber T R, Treichel H C, Hompesch B, et al. Comparison of insulin detemir and insulin glargine in subjects with Type 1 diabetes using intensive insulin therapy[J]. Diabet Med, 2007, 24(6):635–642. doi:10.1111/dme.2007.24.issue-6 |
| [11] | Orozco-Beltrán D, Artola-Menéndez S. Prospective observational study of insulin detemir in patients with poorly controlled type 2 diabetes mellitus initiating insulin therapy for the first time (SOLVE Study)[J]. Aten Primaria, 2016, 48(2):95–101. doi:10.1016/j.aprim.2015.02.010 |
| [12] | Haak T, Tiengo A, Draeger E, et al. Lower within-subject variability of fasting blood glucose and reduced weight gain with insulin detemir compared to NPH insulin in patients with type 2 diabetes[J]. Diabetes Obes Metab, 2005, 7(1):56–64. doi:10.1111/dom.2005.7.issue-1 |
| [13] | 董红霞, 童玥, 钱晓暐, 等. 聚乙二醇化蛋白质多肽类药物定点修饰策略[J]. 药学与临床研究, 2013,21(4):360–365. |
| [14] | Turecek P L, Bossard M J, Schoetens F, et al. PEGylation of Biopharmaceuticals:A Review of Chemistry and Nonclinical Safety Information of Approved Drugs[J]. J Pharm Sci, 2016, 105(2):460–475. doi:10.1016/j.xphs.2015.11.015 |
| [15] | Kolate A, Baradia D, Patil S, et al. PEG-a versatile conjugating ligand for drugs and drug delivery systems[J]. J Control Release, 2014, 192:67–81. doi:10.1016/j.jconrel.2014.06.046 |
 2016, Vol. 39
2016, Vol. 39


