2. 北京协和医学院药用植物研究所 中草药物质基础与资源利用教育部实验室, 北京 100193;
3. 黑龙江中医药大学 药学院, 黑龙江 哈尔滨 150040
2. Peking Union Medical College, The Lab. of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Institute of Medicinal Plant Development, Beijing 100193, China ;
3. College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China
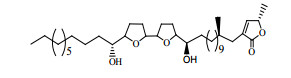
番荔枝Annona squamosa为番荔枝科(Annonaceae)番荔枝属植物,原产美洲,为热带和亚热带地区著名水果,其果外形酷似荔枝[1]。番荔素(annonaceous acetogenins,ACGs)是番荔枝植物(主要是种子中)所含的强效抗肿瘤活性成分[2],曾被喻为“明日抗癌之星”[3-5]。ACGs具有广谱抗肿瘤活性,在人肝癌细胞、人乳腺癌、鼠淋巴癌细胞、人胰腺癌、人肺癌等多种癌症都有较好的生长抑制作用[6-9]。其机制可能与抑制线粒体呼吸链传递,使细胞产生的能量受阻,从而杀死肿瘤细胞有关[10-11]。在化学结构上,ACGs是一类含有四氢呋喃环(THF)的长碳链脂肪内酯类化合物,其基本化学结构为35~37个碳原子构成的化学骨架[12],Bullatacin是ACGs中含量较高的一个药效成分(图 1)。ACGs脂溶性强,没有特征紫外吸收,加之所含成分复杂,使得含量测定非常困难。ACGs水溶性差(25℃在水中的溶解度<1 μg/mL),难于给药。抗肿瘤活性筛选中可以用DMSO溶解后以培养基稀释给药[13],但体内研究中以油溶液口服给药居多[14],尚未见有适合静脉注射给药的剂型。本文尝试将ACGs制备成纳米混悬剂,在解决ACGs难溶难给药的基础上,期望借助于肿瘤组织对纳米粒的高通透性和滞留效应(EPR)提高药效、降低剂量和副作用。
|
图 1 Bullatacin化学结构 Fig. 1 Chemical structure of Bullatacin |
1 仪器和材料
KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司);PURELAB Classic综合纯水仪(英国ELGA公司);Zetasizer nano ZS型粒度仪(英国Malvern Instruments公司);LGJ-10B冷冻干燥机(北京四环科学仪器厂有限公司);RJ-TGL-16C型高速台式离心机(无锡市瑞江分析仪器有限公司);Meppler Toledo AL204电子天平(梅特勒-托利多仪器有限公司);S-4800型扫描电子显微镜(日本Hitachi公司);SHA-B水浴恒温振荡器(金坛国旺实验仪器厂);UltiMate 3000高效液相色谱仪(美国DIONEX仪器公司);JEM-1200-EX透射电子显微镜(日本电子株式会社);Hel-VAP旋转蒸发仪(Heidolph公司);Biotek酶联免疫检测仪(美国伯腾仪器公司);Spectra/Por Float-A-Lyzer透析管(美国Spectrum公司)。
ACGs(中国医学科学院药用植物研究所斯建勇教授提取分离,批号20160112),经HPLC检测其中5个主要成分K20、GK23、K437、Bullatacin、K16的质量分数分别为3.470%、1.593%、7.729%、37.387%、8.984%,ACGs总质量分数为59.163%;TPGS(西安海斯夫生物科技有限公司,批号20151203);SPC(广州白云山汉方现代药业有限公司,批号A4140170);紫杉醇注射液(北京协和药厂,国药准字H10980069);番荔素纳米混悬剂(ACGs-NSPs,自制);乙腈、甲醇(赛默飞世尔科技有限公司)为色谱纯,其余均为分析纯。
健康Balb/c小鼠,雌性,18~20 g,北京斯贝福实验动物有限公司,SPF级,许可证编号:SCXK(京)2016-0002。4T1乳腺癌细胞株(北京协和医学院基础所细胞中心);RPMI1640培养基(美国Hyclone公司);胎牛血清、青霉素和链霉素双抗(美国Gibco公司);96孔无菌培养板(美国Corning公司)。
2 方法与结果 2.1 ACGs-NSPs的制备研究发现,单独使用TPGS为稳定剂时,制备的ACGs-NSPs具有很强的溶血性。因TPGS本身并不溶血,分析认为溶血性主要来源于ACGs本身。之后以TPGS为基础,对处方进行了摸索,结果发现加入适量大豆卵磷脂SPC,能在一定程度上降低纳米混悬剂的溶血性。增加SPC用量,溶血性降低,但粒径有较大增加,综合考虑和比较,ACGs:TPGS:SPC(质量比7:5:2)比例制备的ACGs-NSPs粒径较小,同时溶血性能满足小鼠体内研究的需要,故选用这个处方制备ACGs-NSps。将ACGs 7 mg和TPGS 5 mg、SPC 2 mg(7:5:2)溶于0.30 mL甲醇中,在超声(25 ℃、250 W)条件下,匀速缓慢注入到7 mL去离子水中,37 ℃减压旋转蒸发除去甲醇,补充去离子水至7 mL,即得ACGs-NSPs(1 mg/mL)。
2.2 ACGs-NSPs粒径测定及TEM观察制备的ACGs-NSPs用Zetasizer nano ZS型电位仪测定纳米混悬剂的粒径、粒度分布和表面电位。将ACGs-NSPs(1 mg/mL)用去离子水稀释到质量浓度为0.10 mg/mL,取6 μL滴到300目的铜网上,静置5 min,滤纸吸干液体,室温静置10 min后,滴加6 μL 1%醋酸铀染色90 s后滤纸吸干液体,室温下自然晾干,透射电镜下观察纳米粒子的形态和大小。
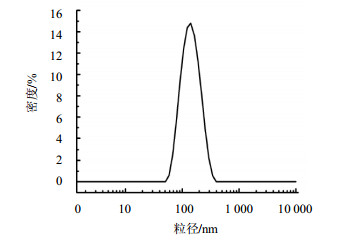
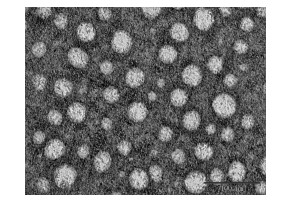
Zetasizer nano ZS型电位仪测定ACGs-NSPs平均粒径为(129.03±1.03)nm,PDI为0.134±0.03,zeta为(−17.7±0.16)mV,粒径分布如图 2。TEM照片显示纳米混悬剂呈现球形,大小较均匀(图 3)。
|
图 2 ACGs-NSPs的粒径分布图 Fig. 2 Particle size distribution of ACGs-NSPs |
|
图 3 ACGs-NSPs TEM照片 Fig. 3 Transmission electron microscope images of ACGs-NSPs |
2.3 ACGs-NSPs不同介质稳定性考察
配制2×PBS溶液(pH 7.4)、1.8%的氯化钠溶液、10%的葡萄糖溶液,各取0.5 mL加入等体积的ACGs-NSPs混匀,得到等渗的ACGs-NSPs的PBS、0.9%氯化钠、5%葡萄糖悬浮液,37.0 ℃恒温孵育,分别在0、1、3、5、12 h取样,Zetasizer nano ZS型粒度仪测定粒径并记录其粒径变化情况。
ACGs-NSPs在0.9%生理盐水、5%葡萄糖溶液、pH7.4的PBS溶液中较稳定,其粒径均在30 nm内变化,说明ACGs-NSPs稳定性良好,可使用以上3种注射溶媒的任意一种调节至等渗后进行静脉注射;常温下放置7 d后粒径无显著变化,较为稳定。
2.4 ACGs-NSPs红细胞膜毒性实验取不同浓度的ACGs-NSPs 1 mL,调等渗后分别加入等体积的4%红细胞悬液,使其终质量浓度为500、250、125、62.5、40 μg/mL,37℃孵育4 h,5 000 r/min离心5 min,取上清,酶联免疫检测仪540 nm测吸光度(A)值,计算溶血率。
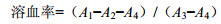
|
其中A1为ACGs-NSPs与等体积4%红细胞悬液混合的吸光度值,A2为ACGs-NSPs与等体积去离子水混合的吸光度值,A3为4%红细胞悬液与等体积去离子水混合的吸光度值,A4为4%红细胞悬液与等体积生理盐水混合的吸光度值。
溶血性试验(表 1)显示,单独使用TPGS时,制备的ACGs-NSPs溶血,处方中加入适量大豆卵磷脂SPC,如在ACGs:TPGS:SPC(质量比7:5:2)比例下,制备的ACGs-NSPs能兼顾较小的粒径和可接受的溶血性。此时,在ACGs浓度不高于40 μg/mL时,纳米混悬剂不显示溶血性,故将40 μg/mL设为ACGs-NSPs静脉注射最高浓度。见表 1。为尽快获知ACGs-NSPs在抗肿瘤方面的体内外表现,暂时未在ACGs-NSPs溶血性改善方面做进一步探讨。如果随后的研究证明ACGs-NSPs在抗肿瘤方面表现突出,再行开展相关研究。
| 表 1 ACGs-NSPs不同浓度的溶血率 Table 1 Hemolysis rates of ACGs-NSPs in different concentration |
2.5 载药量的测定
精密称取ACGs样品2 mg,置于10 mL量瓶中,加甲醇溶解,定容至刻度摇匀,得到浓度200 μg/mL的ACGs储备液。用色谱甲醇稀释成浓度分别为100、50、25、10、5、1 μg/mL的系列标准液。色谱柱Princeton SPHER-100 C18(250 mm×4.6 mm,5 μm),流动相为乙腈-水梯度洗脱(70:30)0~45 min;(65:35)46~55 min;(70:30)56~60 min),体积流量1.0 mL/min,柱温30 ℃,检测波长210 nm,进样量20 μL。
ACGs为含有多种成分的混合物,除几个主要成分外,还含有若干低含量的成分,故难以用HPLC对ACGs进行准确的定量分析。Bullatacin是ACGs中含量较高的一个药效成分,本研究拟以Bullatacin为指标性成分,通过对Bullatacin的定量分析来衡量ACGs-NSPs的载药量和进行体外释放等。将ACGs标准溶液以HPLC进行分析,记录其指标成分Bullatacin的峰面积,以药物峰面积Y对药物浓度X进行线性回归得标准曲线方程。
取5 mL ACGs-NSPs将其冻干后,精确称质量,加入适量乙腈溶解破坏纳米混悬剂使药物释放出来,HPLC法测定载入纳米混悬剂内的药物含量,根据以下公式测定载药量(drug loading,DL)。
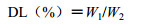
|
其中W1为实测的5 mL纳米混悬剂中ACGs的质量,W2为制备5 mL ACGs-NSPs冻干后实测质量。
采用HPLC对ACGs进行含量测定,记录指标成分Bullatacin的峰面积,以峰面积(Y)对ACGs质量浓度(X,μg/mL)进行线性回归,得到ACGs标准曲线为Y=0.157 72 X−0.363 2,R2=0.999,线性范围5~200 μg/mL,其载药量为(45.03±0.72)%。
2.6 体外释放取4 mL ACGs-NSPs(1 mg/mL),加到即用型透析管(MWCO相对分子质量为8 000~10 000)中,平行3份,以PBS溶液(pH 7.4)为释放外液,在37℃和100 r/min磁力搅拌条件下考查药物释放情况(每隔24 h更换一次释放外液),于不同时间点取40 μL释放内液,加入360 μL甲醇混匀,13 000 r/min离心20 min取上清,HPLC同2.5中的方法测定番荔素含量,计算累积释放百分比。
ACGs-NSPs在pH 7.4的PBS溶液中192 h累计释放百分比达95%左右,4 h内累积释放为20%左右,如图 4(A、B),图 4-B显示ACGs-NSPs并无明显突释现象,可能是吸附在纳米粒表面的药物较少,图 4-A看出药物从纳米粒中释放缓慢,具有一定缓释作用,有利于维持体内药物浓度[15]。
|
图 4 ACGs-NSPs释放曲线(n=3) Fig. 4 Relaese curves of ACGs-NSPs (n=3) |
2.7 ACGs-NSPs对4T1细胞的抑制率
4T1细胞用1640培养基(含10%胎牛血清、100 U/mL的青霉素、链霉素)于37 ℃、5% CO2细胞培养箱中培养,细胞增长到对数生长期时用胰酶消化,加入培养基悬浮细胞,以每孔104个左右接种于96孔板中,37 ℃、5% CO2条件下培养。24 h后弃去培养基,将ACGs-NSPs与其DMSO溶液用培养基(含100 U/mL的青霉素、链霉素)稀释至药物质量浓度为0.05、0.125、0.25、0.5、0.75、1.25、2.5、5、20 μg/mL后加入到96孔板中。每个质量浓度3个复孔,各150 μL,以含100 U/mL的青霉素、链霉素的培养基为空白对照组。继续培养24 h后,每孔加入5 mg/mL的MTT溶液20 μL,孵育4 h。小心吸弃各孔上层液体,加入DMSO 150 μL/孔,置于微孔板振荡器上振荡10 min,使结晶物溶解。酶联免疫荧光仪检测570 nm下的吸光度值(A),计算细胞抑制率,根据GraphPad prism软件计算半数抑制浓度(IC50)。

|
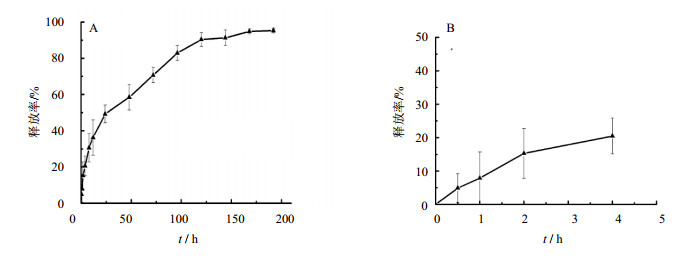
以ACGs的DMSO溶液为对照,MTT法检测ACGs-NSPs在不同浓度下的细胞毒性,图 5显示,与ACGs的溶液相比,ACGs-NSPs表现出更强的细胞毒性,并随着浓度增加,ACGs-NSPs对4T1的细胞毒性表现出剂量依赖性。
|
图 5 ACGs-NSPs和ACGs溶液对4T1细胞的抑制率(x±s,n=3) Fig. 5 4T1 cell inhibition rate of ACGs-NSPs and DMSO solutions (x±s, n=3) |
GraphPad Prism5.0软件计算ACGs-NSPs和溶液对4T1细胞的IC50值分别为3.221和4.464 μg/mL,根据SPSS软件比较两组之间显著性差异(P<0.05),说明ACGs-NSPs抑瘤效果显著强于溶液组,可能是纳米粒能够通过非特异性内吞作用或吞噬作用内化入胞,使其抑瘤作用增强[16]。
2.8 ACGs-NSPs的药效学实验体外培养的4T1乳腺癌细胞用1640培养基配成细胞悬液,细胞密度为5×106个/mL,取0.2 mL接种于雌性Balb/c小鼠右前肢腋下,7 d后肿瘤长至100 mm3左右开始实验。筛选肿瘤大小相对一致的荷瘤小鼠,随机分为5组,每组10只:阴性对照组iv给予生理盐水0.2 mL,阳性对照组iv给予PTX注射液5 mg/kg[16],ACGs-NSPs高、中、低剂量组分别iv 0.4、0.2、0.1 mg/kg的ACGs-NSPs。各组每2天给药1次,实验过程中每天称量动物体质量变化,观察小鼠活动情况并记录小鼠死亡情况。末次给药后处死小鼠,完整剥离腋窝皮下转移瘤体,称量质量,计算抑瘤率。

|
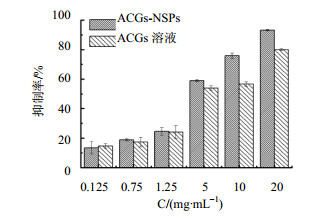
4T1荷瘤小鼠在给药期间体质量变化曲线见图 6-B,生理盐水组体质量呈上升趋势,高剂量ACGs-NSPs组体质量有降低趋势,中、低剂量和阳性对照组增长速率相对缓慢。整个实验过程中(图 6A),高剂量组在给药第8天死亡1只,第10天死亡2只,同时高剂量ACGs-NSPs组小鼠出现炸毛、瘦小的现象,提示高剂量的ACGs-NSPs具有较大毒副作用。
|
图 6 给药后各组小鼠存活(A)及体质量(B)变化曲线(n=10) Fig. 6 Mortality curves (A) and relative body weight changes (B) of mice after iv administration with saline, PTX injection, and ACGs-NSPs (n=10) |
各实验组对4T1荷瘤小鼠的抑瘤率结果见表 2,与阴性对照组相比,ACGs-NSPs高、中和低剂量组与紫杉醇组的抑瘤作用差异极显著(P<0.01),抑瘤率分别为76.09%、74.34%、42.03%、61.17%。ACGs-NSPs高、中剂量组的抑瘤率显著高于与阳性药紫杉醇注射液(P<0.05),而给药剂量却较紫杉醇注射液低一个数量级,提示ACGs可能是比紫杉醇更强的抗肿瘤药物,具有很好的进一步开发前景。从小鼠体质量、实验期间死亡率和抑瘤率三个方面综合考虑,认为0.2 mg/kg的静脉注射剂量可用于ACGs-NSps进一步抗肿瘤研究的合适剂量。
| 表 2 ACGs-NSPs对4T1小鼠的抑瘤率(n=10) Table 2 Inhibitory rate of ACGs-NSPs in 4T1 tumor-bearing mice (n=10) |
2.9 统计学分析
数据采用SPSS17.0统计软件处理,实验数据均由x±s表示,组间比较采用单因素方差分析。
3 讨论ACGs为黏稠状半固体状态,脂溶性强,不溶于水(25℃在水中的溶解度<1 μg/mL),以及其溶血性均限制其给药途径,本实验以TPGS、SPC为载体,超声-沉淀法成功制备ACGs-NSPs,初步解决了ACGs的难于给药的问题。TPGS是维生素E的水溶性衍生物,是一种性能优良的非离子型表面活性剂,可显著提高纳米制剂的包封率[15-16]。近年来的研究发现,TPGS具有P-gp抑制作用,可有效地克服肿瘤多药耐药并提高抗肿瘤药物的疗效,已广泛应用于抗肿瘤药物的递送系统中[17-18]。本研究尝试用TPGS做稳定剂,成功制备了粒径小(平均粒径为(129.03±1.03)nm,多分散指数PDI为0.134±0.03、稳定性良好、载药量达(45.03±0.72)%的纳米混悬剂,制备的ACGs-NSPs呈现表面光滑的球形。由于TPGS具有潜在的逆转多药耐药功能,所制备的ACGs-NSPs有望对耐药性瘤株也能发挥作用。这也是本研究以TPGS为主要稳定剂制备ACGs-NSPs的原因。
但研究过程中意外发现,制备的ACGs-NSps其具有较强的的溶血性,静脉注射会带来隐患。在排除TPGS带来溶血性之后,从SPC为载体制备的ACGs脂质体不会溶血推断,SPC有可能改善ACGs-TPGS纳米混悬剂的溶血性,通过实验证实这一方法可行,并最终确定制备纳米混悬剂处方比例为ACGs:TPGS:SPC(7:5:2)。但SPC改善ACGs-TPGS纳米混悬剂溶血性的机制有待于进一步探讨。
ACGs-NSPs在PH 7.4的PBS溶液中192 h累计释放百分比达95%左右,并无明显突释现象,4 h内虽无突释现象,但释放速率也相对较快,可能由于吸附在纳米混悬剂表面的药物在释放介质中迅速溶解所导致。ACGs-NSPs总体上释放缓慢,也说明了纳米混悬剂具有一定的缓释作用,有利于维持体内药物浓度,增强药效。
通过MTT实验结果看出,ACGs-NSPs对4T1细胞毒性表现出浓度相关性,且抑瘤效果显著强于其DMSO溶液组(P<0.05),这可能是由ACGs-NSPs通过细胞内吞作用进入细胞内,Dintaman等[19]研究表明TPGS是一个有效的P-gp介导的药物耐药和转运的抑制剂,大幅度增加癌细胞对药物的摄取,而细胞膜表面的P-gp对番荔素的DMSO溶液外排,所以ACGs-NSPs有更强的抑瘤效果。
从实验过程中各组动物体质量变化和抑瘤率来看,ACGs-NSPs高剂量组体质量明显下降且死亡率较高(3/10),可能由于剂量偏高带来的毒副作用所致,而中剂量组小鼠状态良好,体质量变化正常,无死亡现象,且抑瘤率(74.34%)与高剂量组(76.09%)无显著性差异,故以后将以ACGs-NSPs中剂量为基础进行进一步的抗肿瘤研究。根据文献报道可知ACGs可以逆转多药耐药性,同时TPGS也可以逆转ADR效应,接下来尝试耐药性细胞株进行实验,以期其更多的治疗效果,为肿瘤药物的发展提供更好的应用价值。
| [1] | 孙丽蕊, 朱虹, 甘礼社, 等. 番荔枝皮化学成分及其抗肿瘤活性的研究[J]. 中国中药杂志, 2012,37(14):2100–2103. |
| [2] | 孙兰, 余竞光, 李德宇. HPLC法测定番荔枝科植物中番荔素含量[J]. 药学学报, 2001,36(9):683–685. |
| [3] | 姚祝军, 吴毓林. 番荔枝内酯-明日抗癌之星[J]. 有机化学, 1995,15(2):120–132. |
| [4] | 韩金玉, 于良涛, 王华. 泡番荔枝辛-明日抗癌之星[J]. 中草药, 2002,33(4):380–382. |
| [5] | 李艳芳, 符立梧. 番荔枝内酯抗肿瘤作用研究进展[J]. 中国药理学通报, 2004,20(3):245–247. |
| [6] | Kuwabara K, Takada M, Iwata J, et al. Design syntheses and mitochondrial complexⅠinhibitory activity of novel acetogenin mimics[J]. Eur J Biochem, 2000, 267(9):2538–2546. doi:10.1046/j.1432-1327.2000.01263.x |
| [7] | Chang F R, Liaw C C, Lin C Y, et al. New adjacent Bis-tetrahydrofuran Annonaceous acetogenins from Annona muricata[J]. Planta Med, 2003, 69(3):241–246. doi:10.1055/s-2003-38485 |
| [8] | Yuan S S, Chang H L, Chen H W, et al. Annonacin, amono-tetrahydrofuran acetogenin, arrests cancer cells at the G1 phase and causes cytotoxicity in a Bax-and caspase-3 related pathway[J]. Life Sci, 2003, 72(25):2853–2861. doi:10.1016/S0024-3205(03)00190-5 |
| [9] | Kim E J, Suh K M, Kim D H, et al. Asimitrin and 4-hydroxytrilobin, new bioactive annonaceous acetogenins from the Seeds of Asimina triloba possessing a bis-tetrahydrofuran ring[J]. J Nat Prod, 2005, 68(2):194–197. doi:10.1021/np040184l |
| [10] | Morre D J, Cabo R, Farley C, et al. Mode of action of bullatacin, a potent antitumor acegotenin:inhibition of NADH oxidase activity of Hela and HL-60, but not liver, plasma membranes[J]. Life Sci, 1995, 56:343–348. |
| [11] | 程春旭, 高颜茹. 抗肿瘤药物作用机制的研究进展[J]. 吉林医学, 2009,30(23):3080–3083. |
| [12] | 袁斐, 白钢钢, 苗筠杰. 番荔枝内酯类化合物对耐阿霉素乳腺癌细胞MCF-7/ADR体外活性的影响[J]. 中草药, 2014,45(19):2815–2819. |
| [13] | 黄银久, 宋宝安, 金林红. SRB法和MTT法抗肿瘤药物筛选结果相关性研究[J]. 生物学杂志, 2009,26(4):13–16. |
| [14] | 徐莎莎, 李祥, 陈建伟, 等. 番荔枝内酯滴丸制剂工艺及其含量测定[J]. 中国实验方剂学杂志, 2012,18:16–19. |
| [15] | 郭静静, 李仙义, 袁海龙, 等. 波棱甲素纳米混悬剂胶囊的制备及体外溶出度测定[J]. 中草药, 2012,43(3):467–470. |
| [16] | 武娜, 张利红, 程玲, 等. 金丝桃苷固体纳米晶体的制备及其体外释放研究[J]. 中草药, 2015,46(12):1759–1763. |
| [17] | 郑楠楠, 吴琳华, 唐景玲. 聚乙二醇维生素E琥珀酸酯在药剂学中的应用进展[J]. 中国药学杂志, 2014,49(16):1373–1376. |
| [18] | Guo Y, Luo J, Tan S, et al. The applacations of vitamin E TPGS in drug delivery[J]. Eur J Pharm Sci, 2013, 49(2):175–186. doi:10.1016/j.ejps.2013.02.006 |
| [19] | Dintaman J M, Silverman J A. Inhibition of P-glycoprotein by D-αlpha-tocopheryl polyethylene glycol 1000 succinate (TPGS)[J]. Pharm Res, 1999, 16(10):1550–1556. doi:10.1023/A:1015000503629 |
 2016, Vol. 39
2016, Vol. 39


