2. 承德医学院附属医院, 河北 承德 067000
2. Affiliated Hospital of Chengde Medical University, Chengde 067000, China
卵巢早衰即卵巢提前衰老,一般女性在48~50周岁左右卵巢衰老,但在40周岁以前卵巢内卵泡消耗殆尽,不能分泌激素,并出现身体器官失去营养,则属于卵巢早衰范畴。卵巢早衰的诊断标准为:年龄<40周岁;停经4个月以上;促卵泡刺激素(FSH)>40 mIU/mL,促黄体生成素(LH)>30 mIU/mL,雌二醇(E2)<25 mIU/mL。卵巢早衰主要的病理机制为卵巢储备能力的降低,抗缪勒管激素(AMH)由窦卵泡分泌,可在卵巢损伤早期更准确评估卵巢储备及剩余卵泡数[1-2];肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)通过抑制大鼠FSH刺激的颗粒细胞分化与芳香化酶活性,刺激颗粒黄体细胞前列腺素F2α(PGF2α)的生成,加速卵泡闭锁及黄体细胞凋亡[3]。本实验通过观察补肾调冲方对卵巢早衰大鼠血清中FSH、LH、E2及TNF-α、IFN-γ蛋白表达的影响,为补肾调冲方干预卵巢早衰的临床应用提供依据。
1 材料 1.1 动物SPF级SD雌性大鼠60只,12周龄,体质量250~280 g,由北京华阜康生物科技股份有限公司提供,许可证号SCXK(京)2014-0004,自然光照射,通风良好。
1.2 药物及主要试剂中药配制:补肾调冲方含菟丝子15 g、黄精15 g、熟地15 g、肉苁蓉10 g、巴戟天10 g、当归10 g、川芎6 g、紫石英15 g、五味子6 g,所有饮片由承德医学院附属医院附属中药房同济大药房药剂科提供,专业药剂师保证浓度和品质。每100克药材加800 mL水按常规方法进行煎煮,滤汁浓缩至生药2.5 g/mL,4 ℃冰箱储存。
结合雌激素片,规格:每片0.625 mg,购自新疆新资源生物制药有限责任公司,生产批号20150608。雷公藤多苷片,规格:每片10 mg,购自远大医药黄石飞云制药有限公司,生产批号201506172。
大鼠的FSH、LH、AMH酶联免疫吸附试验(ELISA)检测试剂盒,购自上海联科生物技术有限公司;兔抗鼠TNF-α多克隆抗体,购自北京博奥森公司;兔抗鼠IFN-γ多克隆抗体,购自北京中杉金桥生物科技有限公司;即用型免疫组化试剂盒,购自北京四正柏生物科技有限公司。
1.3 主要仪器Thermo ExcelsiorTMES自动组织脱水机(美国Thermo Electron Corporation);显微镜照相系统(德国Lecia公司);Multiskan MK3酶标仪(芬兰Thermo公司有限公司)。
2 方法 2.1 动物模型的制备及分组给药健康雌性SD大鼠60只,体质量250~280 g,随机分为6组:对照组,模型组,补肾调冲方高、中、低剂量组,结合雌激素片(阳性药)组,每组10只。除对照组外,其余各组均ig雷公藤多苷片造模。雷公藤多苷片研碎后加等体积双蒸水融化,根据前期实验[4],以给药剂量75 mg/kg连续ig 14 d。造模结束后称质量,连续行阴道涂片两个性周期,动情周期紊乱提示造模成功。造模结束后24 h,ig给予补肾调冲方,高、中、低剂量分别为24、12、6 g/kg(以生药计,根据每千克体质量用药量的人鼠比例换算,12 g/kg为临床等效用药剂量);结合雌激素片水溶液制法同雷公藤多苷片水溶液,以75 µg/kg剂量ig给药。除模型组和对照组自由饮水外,各给药组给药体积均为0.1 mL/kg,连续给药36 d,于处死动物前10 d,每日行阴道涂片检测。
2.2 取材腹主动脉取血,处死动物,常规无菌操作方法取卵巢、子宫组织称质量。
2.3 血清性激素水平的检测将大鼠血液标本静置,取上层血清,3 000 r/min离心16 min,取上层血清置于EP管中,严格按照ELISA试剂盒说明书要求,测定FSH、LH、AMH水平,在Multiskan MK3酶标仪上,450 nm波长依序测量各孔吸光度(A)值。
2.4 免疫组化法染色切片脱蜡,PBS洗3次,微波炉内不同温度进行抗原修复,加H2O2处理,滴加封闭液,PBS洗3次后滴加稀释好的TNF-α、IFN-γ抗体(1:100)孵育30 min后,4 ℃过夜。次日给予辣根过氧化物酶标记链霉卵白素工作夜,37 ℃孵育25 min,滴加生物偶联素的二抗工作液,37 ℃孵育25 min,二氨基联苯胺(DAB)显色,苏木素复染。中性树胶封片,显微镜下观察染色结果。
免疫组化染色结果处理:卵巢组织标本中细胞胞浆出现淡黄色或黄色颗粒状着色为阳性表达。摄像,采用IPP 6.0软件在同等条件下检测每张组织切片中的TNF-α及IFN-γ表达的积分光密度(A)值。
2.5 统计学方法所得数据使用SPSS 21.0进行分析,结果采用x±s表示,各组间采用单因素方差分析方式。
3 结果 3.1 血清FSH、LH、AMH水平的测定与对照组比较,模型组血清中FSH、LH水平明显升高,AMH水平明显降低(P<0.05);与模型组比较,补肾调冲方低、中、高剂量组及结合雌激素片组血清FSH、LH水平明显降低,AMH水平显著升高(P<0.01);与结合雌激素片组比较,补肾调冲方中、高剂量组FSH、LH、AMH水平无显著性差异,低剂量组差异显著(P<0.05)。
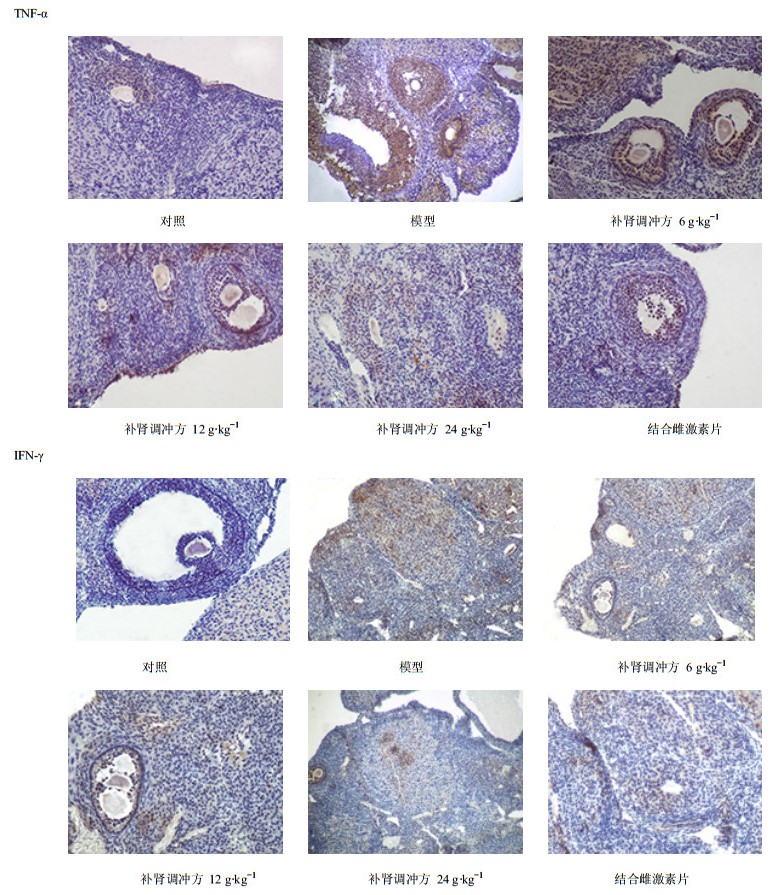
3.2 免疫组化法检测TNF-α、IFN-γ蛋白的表达与对照组比较,模型组TNF-α、IFN-γ蛋白表达显著升高(P<0.05);与模型组比较,补肾调冲方各组及结合雌激素片组TNF-α、IFN-γ蛋白表达明显降低(P<0.01),说明补肾调冲方有抑制卵泡过度凋亡、闭锁的作用;与结合雌激素片组比较,补肾调冲方低、中剂量组TNF-α、IFN-γ蛋白表达差异显著(P<0.05),高剂量组差异不显著。见表 2和图 1。
| 表 1 各组大鼠血清FSH、LH、AMH的水平变化(x±s, n=10) Table 1 Changes of serum FSH, LH, and AMH levels of rats in each group (x±s, n=10) |
| 表 2 大鼠卵巢TNF-α、IFN-γ蛋白的表达(x±s, n=10) Table 2 Expression of TNF-α and IFN-γ protein in rat ovary (x±s, n=10) |
|
图 1 大鼠卵巢TNF-α、IFN-γ蛋白的表达情况 Fig. 1 Protein expression of TNF-α and IFN-γ in rat ovary |
4 讨论
近年来卵巢早衰发病率呈逐年上升的趋势,受到妇科届广泛的关注。西医认为此现象的发生可能由多因素导致,其中环境、社会及遗传因素、自身免疫性因素、医源性因素等均导致卵泡提前闭锁甚至或早耗竭,卵巢储备能力降低[5-6]。中医并无卵巢早衰这一病名,相关论述多见于“血枯”“血竭”“经闭”等。相对于西医的局部治疗,中医多从整体论治,以肾气-天癸-冲任-胞宫性腺轴为基础,从源头论治,提高甚至恢复卵巢储备能力,使卵巢功能恢复到应有的年龄水平,补肾调冲方在此基础上产生,从肾论治、调理冲任,使之达到“和”的状态。补肾调冲方由以补肾为主的菟丝子、巴戟天、川芎、黄精、熟地、肉苁蓉和以调理冲任为主的当归、紫石英、川芎、五味子等两部分药组成,具有滋补肝肾,调理冲任之效,其作用既能补肾气之虚,又能祛实开结,则肾气盛,任冲脉通,月事以时下[7]。
雷公藤多苷片本为临床上治疗风湿免疫类疾病药,大量使用造成女性卵巢储备功能下降,至闭经。前期实验研究表明雷公藤多苷片可致卵巢早衰大鼠始基卵泡数减少,卵泡发育不良,从而导致高促性腺激素性卵巢功能低下。由Elisa实验可知:补肾调冲方各组可降低血清FSH及LH水平,与模型组比较,差异显著(P<0.01),说明补肾调冲方可改善高促性腺性卵巢功能低下,提高卵巢对激素水平的敏感性。
卵巢早衰的病理机制主要为卵巢储备功能降低[8],卵巢储备是指卵巢内卵泡发育为可受精卵母细胞的能力,主要取决于卵母细胞的质量及数量。AMH作为窦卵泡分泌的激素能抑制始基卵泡的募集,防止其过早过快的消耗,能更好的反应卵巢内窦卵泡的数量。体外培养发现AMH可抑制FSH依赖性的窦前卵泡生长,减弱FSH介导的颗粒细胞芳香化酶活性及LH受体的表达,抑制颗粒细胞对FSH的敏感性,从而在优势卵泡选择中发挥作用[9]。本研究显示:模型组血清AMH水平与给药组及对照组比较,明显降低(P<0.01),说明雷公藤多苷片可导致窦前卵泡及小窦卵泡生成的AMH明显减少,抑制始基卵泡募集作用减弱,从而加速了卵泡的耗竭,导致卵泡闭锁,最终导致卵巢功能过早衰竭。补肾调冲方各组血清AMH水平明显升高(P<0.05),说明补肾调冲方可改善卵巢早衰大鼠的卵巢功能,防止卵泡的过度耗竭和闭锁,提高卵巢储备力。
TNF-α是由单核细胞和巨噬细胞共同分泌的多活性细胞因子,可通过旁分泌或自分泌的方式引起细胞的增殖与凋亡;研究表明在某些阶段下调血清及卵巢组织中TNF-α的表达,对受损卵巢起保护作用,减轻卵巢损伤[10]。IFN-γ为多功能的细胞调节因子,其对生殖轴控的研究主要集中在对卵巢的作用上[11]。在正常情况下,卵泡从始基卵泡发育至成熟卵泡、排卵和闭锁,细胞因子参与了全过程的调控。多通过内分泌、旁分泌或自分泌机制实现[12]。根据Russell等的报道[13],卵泡闭锁是由IFN-γ开始并启动一系列细胞因子而引起。且IFN-γ与FSH/LH呈显著正相关,表明随着IFN-γ的升高,卵巢储备功能逐渐下降。IFN-γ可导致卵巢的抗原靶细胞损伤或凋亡,由于卵巢的过度损伤及凋亡,造成卵泡过度闭锁,排卵障碍,形成卵巢早衰[14]。本研究显示,与对照组比较,模型组TNF-α、IFN-γ蛋白表达明显升高(P<0.01),图片显示模型组TNF-α、IFN-γ黄染颗粒数量多且黄染色深,阳性表达率最高。说明雷公藤多苷片可导致TNF-α、IFN-γ等因子在早衰卵巢中的升高,致卵泡过度闭锁甚至凋亡;与模型组比较,补肾调冲方各组TNF-α、IFN-γ蛋白的表达明显降低(P<0.05),图片显示黄染颗粒数量减少,颜色较浅,阳性表达率较低;与结合雌激素片组比较,补肾调冲方高剂量组TNF-α、IFN-γ蛋白表达无显著性差异,图片显示黄染颗粒数量及颜色无显著差异(P>0.05)。说明补肾调冲方可降调TNF-α、IFN-γ蛋白表达,尤其高剂量组作用明显,减少了对卵巢抗原靶细胞的损伤,降低细胞凋亡率,降低了卵泡闭锁的速度,促进了卵巢组织的修复,从而降低了卵巢过早耗竭的速度。
综上所述,补肾调冲方治疗卵巢早衰的作用机制之一可能是通过改善高促性腺性卵巢功能低下,提高卵巢对激素水平的敏感性,通过提高卵巢局部始基卵泡募集因子AMH的水平,降低FSH、LH的水平,降调TNF-α、IFN-γ蛋白的表达,促进卵泡的生长发育,抑制卵泡的过度耗竭与闭锁,恢复始基卵泡的正常募集状态,从而抑制卵巢功能的过早衰竭。
| [1] | 徐琳, 任莉, 等. AMH、FSH、E2在卵巢早衰诊断中的价值[J]. 中国优生与遗传杂志, 2011,19(3):96–99. |
| [2] | Meduri G, Massin N, Guibourdenche J, et al. Serum anti-Müllerian hormone expression in women with premature ovarian failure[J]. Hum Reprod, 2007, 22(1):117–123. |
| [3] | 高慧, 杨涓, 等. 补肾调冲方对卵巢早衰大鼠卵巢相关细胞因子TNF-α, IFN-γ表达的影响[J]. 国医论坛, 2008,23(3):32–39. |
| [4] | 高慧, 杨涓. 药物型卵巢早衰动物模型的研究[J]. 国医论坛, 2007,22(3):22–26. |
| [5] | 赵倩, 叶宸, 等. 卵巢早衰的研究现状及进展[J]. 生殖与避孕, 2014,34(1):59–64. |
| [6] | Wang X F, Zhang L, Wu Q H, et al. Investigation of mechanism of premature ovarian failure regulation by kidney-tonifying herbs and liver-clearing herbs in dingjing decoction[J]. Chin Herb Med, 2015, 7(4):328–333. |
| [7] | 夏天, 高慧, 柴淑娟, 等. 韩冰教授运用冲任学说治疗卵巢功能失调性疾病的研究总结[J]. 天津中医药, 2011,28(4):271–273. |
| [8] | 张大伟, 李翠萍, 等. 补肾调周法对卵巢早衰模型大鼠血清INHB、VEGF的影响[J]. 实验方剂学, 2011,17(12):213–216. |
| [9] | La Marca A, Pati M, Orvieto R, et al. Serum anti-mullerian hormone levels in women with secondary amenorrhea[J]. Fetil Steril, 2006, 85(5):1547–1549. doi:10.1016/j.fertnstert.2005.10.057 |
| [10] | 邹晓萍, 董化江, 等. 蕨麻正丁醇提取物对急性卵巢缺血再灌注损伤大鼠肿瘤坏死因子-α的影响[J]. 新乡医学院学报, 2014,31(5):321–323. |
| [11] | 石占荣, 黄冬梅, 等. 干扰素-γ维持治疗对中晚期卵巢癌无进展生存期及生存率的影响[J]. 中国妇幼保健院, 2015(30):5895–5897. |
| [12] | Yamada Y, Saton K. Folliculogenesis and regulating factors[J]. Nippon Rin-sho, 1997, 55(11):2822. |
| [13] | Russell P. The clinic pathological features premature ovarian failure[J]. VerhDtsch Ges Pathol, 1997, 87:197. |
| [14] | 谢江燕, 何畏, 等. 卵巢早衰患者CD4+、CD25+调节性T细胞的变化及干扰素-γ、转化生长因子-β1的表达[J]. 华西医学, 2011,17(12):377–379. |
 2016, Vol. 39
2016, Vol. 39


