2. 中国药科大学 江苏省药效研究与评价服务中心, 江苏 南京 210009;
3. 江苏吴中苏药医药开发有限责任公司, 江苏 南京 210009
2. Jiangsu Center for Pharmacodynamics Research and Evaluation, China Pharmaceutical University, Nanjing 210009, China ;
3. Jiangsu Wuzhong Su Medicine Development Co Ltd, Nanjing 210009, China
山茱萸药材(购自河南省社旗县天鑫对外贸易有限公司,经中国药科大学中药学院楼凤昌教授鉴定为山茱萸科植物山茱萸Cornus officinalis Sieb.et Zucc.的果肉,质量符合2015年版《中国药典》标准);经如下方法提取:(1)用3倍量95%乙醇加热回流1.5 h,提取3次,提取液浓缩至无醇味,进行硅胶柱色谱分离,氯仿-甲醇梯度洗脱,收集含莫罗苷和马钱苷的流份。(2)山茱萸用乙醇回流加热,浓缩至无醇味,用水稀释,静置、滤过,分别得固体和滤液。固体用乙醇加热煮沸溶解,趁热滤过,滤液加氢氧化钠饱和溶液调pH值,搅拌、滤过,碱液用水稀释,加稀盐酸调pH值,有黄色沉淀析出,滤过,沉淀用乙醇重结晶。滤液过D101型大孔吸附树脂,用水和乙醇梯度洗脱,收集洗脱液,浓缩,用乙醇溶解,滤过,滤液浓缩,60 ℃真空干燥,研成粉末。将两部分混合得山茱萸总萜。1 g山茱萸总萜相当于43.5 g药材,批号110309,经测定本品主要含熊果酸、齐墩果酸(三萜酸类)和莫罗苷、马钱苷等(环烯醚萜苷类)成分,4种成分质量分数之和为67.3%。
1.2 药品及主要试剂盐酸二甲双胍片,0.25 g/片,批号20101212,北京中惠药业有限公司;葡萄糖(批号TPT10323)、三酰甘油(TG,批号ZGY10307)、总胆固醇(TC,批号ZDG10287)、高密度脂蛋白(HDL,批号ZGM10313)、低密度脂蛋白(LDL,批号ZDM10270)、糖化血清蛋白(GSP,批号TGT10247)、糖化血红蛋白(HbA1c,批号TTH10229)检测试剂盒,威特曼生物科技(南京)有限公司;小鼠胰岛素(Ins)检测试剂盒(ELISA法,批号EZG02AZ01),上海依科赛生物制品有限公司;其余试剂均为市售分析纯。
1.3 动物SPF级KK/DPJ-Ay/J(KKay)自发性糖尿病小鼠,8~10周龄,雌雄各半;SPF级C57BL/6J小鼠,用于对照,8~10周龄,雌雄各半,均购自北京华阜康生物科技股份有限公司,生产许可证号为SCXK(京)2014-0004。
动物均饲养于使用型屏障系统内,许可证号为SYXK(苏)2012-0035,空气洁净度10 000级,温度20~25 ℃,湿度40%~70%,氨浓度≤14 mg/m3,换气10~20次/h,动物照度15~20 lx,工作照度150~300 lx,噪音≤60 dB,昼夜明暗交替时间12 h/12 h,雌雄分开饲养,每笼均5只。
对照小鼠饲以全价颗粒饲料,购自江苏省协同医药生物工程有限责任公司;KKay鼠饲以专用辐照灭菌高脂饲料,购自北京华阜康生物科技股份有限公司,其质量均符合GB14924.1-2001《实验动物配合饲料通用质量标准》。
1.4 主要仪器FEJ-200电子天平,福州富日衡之宝电子有限公司;BS210S精密电子天平,德国赛多利斯;TDL80-2B台式离心机,上海安亭科学仪器厂;强生稳豪ONE TOUCH Ultra血糖仪及血糖试纸、Safire2多功能酶标仪,瑞士TECAN公司;Autolab618全自动生化分析仪,意大利AMS公司。
2 方法 2.1 剂量设置与分组将60只筛选合格(空腹血糖值≥11.0 mmol/L为合格糖尿病小鼠)的KKay自发性糖尿病小鼠,按预先测定的血糖值随机分层分为6组:模型(0.5% CMC-Na)组,二甲双胍(阳性药,0.2 g/kg)组,山茱萸总萜高、中、低剂量(0.20、0.10、0.05 g/kg,根据体表面积折算,受试剂量分别约是山茱萸药材《中国药典》人推荐剂量的4倍、2倍和1倍)组,每组10只,雌雄各半。另设10只C57BL/6J小鼠(雌雄各半)作为对照(0.5% CMC-Na)组。
受试药物按上述剂量设置,采用0.5% CMC-Na研磨配制所需浓度药液,按10 mL/kg体积ig给药,每天1次,连续给药5周。
2.2 一般状况观察每天给药前观察动物精神、行为等一般状况;给药前及给药期间每周测定1次小鼠体质量。
2.3 血糖测定给药前及给药期间每周测定血糖1次,上午给药前禁食2 h后,剪尾采血,用血糖试纸测定血糖。
2.4 葡萄糖耐量试验(IPGTT)于第5周给药1 h后ip葡萄糖(2.5 g/kg)进行IPGTT,眼眶采血20 µL,3 500 r/min离心10 min,分离血清,采用葡萄糖试剂盒测定葡萄糖注射后0、0.5、1.0、2.0 h的血糖值(BG0 h、BG0.5 h、BG1.0 h、BG2.0 h)。根据血糖值绘制血糖-时间曲线,参考文献方法[3],按以下公式求算各组血糖-时间曲线下面积:
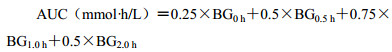
|
IPGTT试验完毕3 d后,小鼠摘眼球采血,肝素抗凝,取全血检测HbA1c,其余血液3 500 r/min离心15 min分离血浆,测定GSP、TG、TC、LDL和HDL水平。另取部分血浆,采用ELISA试剂盒测定Ins水平。按下式计算胰岛素抵抗指数(IR):
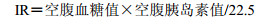
|
计量数据均以x±s表示,采用SPSS 16.0软件进行统计学分析,先做单因素方差分析(ANOVA),根据方差是否齐性,分别进行t检验或q’检验(Dunnett’t法)。
3 结果 3.1 一般状况观察结果与C57BL/6J小鼠比较,KKay小鼠出现明显的肥胖,自发活动量减少,具有糖尿病相关的明显多饮、多尿症状。与模型组比较,给药期间各受试药物组小鼠毛色、排便、排尿、自发活动等一般状况未见明显影响,试验期间无动物死亡。
KKay小鼠体质量显著高于对照组C57BL/6J小鼠(P<0.01),表现出明显的肥胖。山茱萸总萜可以剂量相关性的减轻KKay小鼠体质量,其中高剂量组第1、2和5周差异显著(P<0.05),结果见表 1。
| 表 1 山茱萸总萜对KKay小鼠体质量的影响(x±s, n=10) Table 1 Effect of TCF on body weight of KKay mice (x±s, n=10) |
3.2 对KKay小鼠血糖的影响
在全部试验期间,与对照组C57小鼠比较,KKay小鼠血糖水平显著升高(P<0.01),山茱萸总萜各剂量组自给药第1周起即可剂量相关性地显著降低KKay小鼠血糖水平(P<0.05、0.01),且全部给药5周期间均具有显著改善作用,结果见表 2。
| 表 2 山茱萸总萜对KKay小鼠血糖的影响(x±s, n=10) Table 2 Effect of TCF on blood glucose of KKay mice (x±s, n=10) |
3.3 对KKay小鼠IPGTT的影响
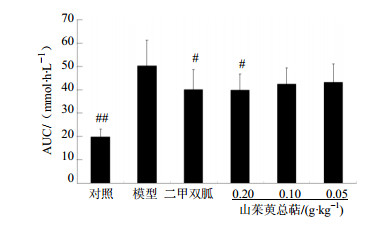
与模型组比较,高、中、低剂量山茱萸总萜均能显著降低1 h时间点的血糖水平(P<0.05),高剂量组2 h血糖水平亦显著降低(P<0.05),提示山茱萸总萜可明显改善KKay小鼠的葡萄糖耐量,高剂量组对于模型小鼠血糖-时间曲线下面积也有明显的降低作用(P<0.05),结果见表 3、图 1。
| 表 3 山茱萸总萜对KKay小鼠IPGTT血糖的影响(x±s, n=10) Table 3 Effect of TCF on blood glucose in IPGTT of KKay mice (x±s, n=10) |
|
与模型组比较:#P<0.05 #P < 0.05 ##P < 0.01 vs model group 图 1 山茱萸总萜对KKay小鼠IPGTT血糖-时间曲线下面积的影响(x±s, n=10) Fig. 1 Effect of TCF on AUC of blood glucose-time curve of KKay mice (x±s, n=10) |
3.4 对KKay小鼠HbA1c、GSP、Ins水平及IR的影响
与对照组C57小鼠比较,KKay小鼠HbA1c、GSP和Ins水平均显著升高(P<0.01),提示模型动物具有明显的高血糖和高胰岛素症状。与模型组比较,山茱萸总萜可剂量相关性的降低KKay小鼠HbA1c和GSP水平,高、中剂量组均达到统计学显著差异(P<0.01),低剂量组GSP水平也有明显降低(P<0.05)。山茱萸总萜高、中剂量组Ins水平均有显著降低(P<0.05),同时对于KKay小鼠IR指数均有显著的改善作用(P<0.01),2个剂量组作用强度相当。山茱萸总萜低剂量组Ins水平有降低趋势,IR指数亦有显著降低(P<0.01),结果见表 4。
| 表 4 山茱萸总萜对KKay小鼠HbA1c、GSP、Ins和IR的影响(x±s, n=10) Table 4 Effects of TFC on serum HbA1c, GSP, Ins, and IR of KKay mice (x±s, n=10) |
3.5 对KKay小鼠血脂水平的影响
与对照组比较,KKay小鼠HDL、LDL、TG和TC水平均显著升高(P<0.05、0.01),提示模型动物具有明显的高血脂和脂质代谢紊乱症状。与模型组比较,山茱萸总萜高剂量组可显著降低LDL、TG和TC水平(P<0.01),中剂量组LDL和TC水平也明显降低(P<0.05),低剂量组未见明显改善作用。山茱萸总萜各剂量组HDL水平均无明显影响,见表 5。
| 表 5 山茱萸总萜ig给药对KKay小鼠血脂水平的影响(x±s, n=10) Table 5 Effects of TFC on serum HDL, LDL, TG, and TC levels of KKay mice (x±s, n=10) |
4 讨论
前期研究显示,山茱萸总萜对于重度肥胖(平均体质量维持在50~60 g)、重度糖尿病db/db小鼠模型(空腹血糖平均值24~30 mmol/L)具有一定的降血糖作用,但作用强度相对较弱(血糖下降比率为10~30%),药效作用不明显[4]。本试验选择具有中度肥胖(平均体质量维持在30~40 g)、中度糖尿病KKay小鼠模型(空腹血糖平均值15~20 mmol/L),进一步考察山茱萸总萜改善Ⅱ型糖尿病相关高血糖、高血脂、胰岛素抵抗相关方面的作用。
KKay小鼠是一种毛色基因(ay)突变Ⅱ型KK糖尿病小鼠,是在KK小鼠的基础上转入突变毛色基因(ay)而成,呈黄色,由Lataste于1977年首次公布。ay基因不仅影响小鼠的毛色而且可引起代谢紊乱,出现肥胖、高血糖、脂质代谢紊乱和高胰岛素血症等代谢异常综合征,其发病是在遗传易感的基础上加环境因素而诱发。与人类Ⅱ型糖尿病表现极为相似,属于中度糖尿病模型[5]。
山茱萸总萜可以剂量相关性的减轻KKay小鼠体质量,其中高剂量组具有明显改善。山茱萸总萜各治疗组自给药第1周起即可剂量相关性地显著降低KKay小鼠血糖水平,且全部给药5周期间均具有显著改善作用,山茱萸总萜0.2 g/kg剂量组降血糖作用强度与二甲双胍0.2 g/kg基本相当。
血液中的葡萄糖可与白蛋白和其他蛋白分子N末端发生非酶促糖化反应,形成GSP。由于血清中白蛋白的半衰期约为21 d,所以GSP测定可反映患者过去2~3周平均血糖水平。HbA1c是经过缓慢的、不可逆的、非酶促反应而结合形成的产物,它的测定反映的是过去2~3个月中血糖的平均水平[6]。GSP及HbA1c检查可反映糖尿病治疗中的真正状态,提供较为可靠的血糖信息[7]。与正常动物比较,KKay小鼠血清GSP和HbA1c水平均明显升高,而山茱萸总萜可剂量相关性的降低KKay小鼠GSP和HbA1c水平。由此可见,本品对于此模型具有显著的降低血糖作用。
2型糖尿病的发病重要的机制是外周组织出现胰岛素抵抗,继而引起的葡萄糖利用的障碍[8]。葡萄糖耐量试验可在一定程度上揭示机体外周组织对葡萄糖的利用情况。本试验中山茱萸总萜可明显改善KKay小鼠的葡萄糖耐量。如前所述,KKay小鼠具有高胰岛素血症的特征,血清胰岛素检测结果显示山茱萸总萜中、高剂量组可显著性的降低KKay小鼠的胰岛素水平。这些结果表明山茱萸总萜可能改善此种状态下机体的胰岛素抵抗。
血脂异常是糖尿病并发大血管病变的主要危险因素之一,同时也是引起胰岛素抵抗的重要因素。糖尿病血脂异常的特点为TG增高、HDL-C降低、LDL-C轻、中度增高,加之氧化的OxLDL-C增多[9]。纠正脂代谢紊乱是治疗糖尿病及其并发症的重要手段。与对照组C57小鼠比较,KKay小鼠具有明显的脂质代谢紊乱症状。与模型组比较,山茱萸总萜可剂量相关性的降低KKay小鼠LDL、TG和TC水平,其中高、中剂量组改善明显。本实验中KKay小鼠血清HDL-C水平明显高于正常动物,此结果与文献报道一致[3],但是与糖尿病患者临床变化有所不同,具体原因不明,可能与模型动物伴有的过度高血脂及脂肪肝症状有关,而山茱萸总萜对HDL-C水平未见明显影响。
综上可见,山茱萸总萜对KKay小鼠具有显著的降血糖作用,降低血清HbA1c和GSP,明显改善模型动物的糖耐量,改善胰岛素抵抗,降低胰岛素水平,对于KKay小鼠的高血脂也有明显的改善作用。通过与db/db模型小鼠药效学研究的对比分析,本实验结果表明山茱萸总萜在治疗血糖水平显著升高的重度糖尿病方面药效偏弱,但对于伴有胰岛素抵抗和脂质代谢紊乱的轻、中度2型糖尿病患者方面具有良好的临床应用前景。
| [1] | 李伟, 许惠琴, 陶玉菡, 等. RP-HPLC法测定山茱萸环烯醚萜总苷中马钱苷和莫诺苷含量[J]. 南京中医药大学学报, 2014,30(1):90–92. |
| [2] | 孙亚京, 刘丽冰, 颜思思, 等. 山茱萸总萜调控伴胰岛素抵抗的PCOS大鼠及其卵巢颗粒细胞分泌作用的机制[J]. 云南中医学院学报, 2014,37(6):9–16. |
| [3] | Yang Z, Wang L, Zhang F, et al. Evaluating the antidiabetic effects of Chinese herbal medicine:Xiao-Ke-An in 3T3-L1 cells and KKAy mice using both conventional and holistic omics approaches[J]. BMC Complement Altern Med, 2015. doi:10.1186/s12906-015-0785-2 |
| [4] | 徐志猛, 朱晶晶, 江振洲, 等. 山茱萸总萜对db/db糖尿病小鼠的降血糖作用[J]. 中国药科大学学报, 2016,47(3):337–341. |
| [5] | King A J. The use of animal models in diabetes research[J]. Br J Pharmacol, 2012, 166(3):877–894. doi:10.1111/j.1476-5381.2012.01911.x |
| [6] | 许翔, 丁莉莉. 血清糖化白蛋白检测在糖尿病控制中的应用[J]. 实用医技杂志, 2006,13(3):340–341. |
| [7] | 沈秀金. 同时测定血糖、糖化血清蛋白与糖化血红蛋白对糖尿病监测的重要性[J]. 实用医技杂志, 2008,15(26):3633–3635. |
| [8] | Jack L L. Pathogenesis of type 2 diabetes mellitus[J]. Arch Med Res, 2005, 36(3):197–209. doi:10.1016/j.arcmed.2005.01.003 |
| [9] | 韩丽蓓, 李小玲, 刘金凤, 等. 原发性血脂异常与2型糖尿病合并血脂异常中医证素及血脂指标对照研究[J]. 北京中医药大学学报中医临床版, 2011,18(4):1–5. |
 2016, Vol. 39
2016, Vol. 39


