2. 中国农业科学院农产品加工研究所主食加工技术研究院, 黑龙江 哈尔滨 150040;
3. 聊城大学农学院 食品科学与工程系, 山东 聊城 252000;
4. 哈尔滨工业大学化工学院 食品科学与工程系, 黑龙江 哈尔滨 150090
2. Institute of Food Science and Technology CAAS/Institute of Staple Food Processing Technology, Harbin 150040 ;
3. Liaocheng University, Agricultral College, Liaocheng 252000 ;
4. Department of Food Science and Engineering, Harbin Institute of Technology, Harbin 150090
黑木耳Auricularia auricula(L.ex Hook.)Underw.是一种营养丰富的大型真菌[1],黑木耳多糖(Auricularia auricula polysaccharides,AAP)具有免疫增强[2]、抗氧化[3]、抗肿瘤[4-5]、降血糖[6]等生物活性。红松Pinus koraiensis Sieb.et Zucc.是一种主要生长于中国东北地区的松科常绿乔木[7],红松多酚(Pinus koraiensis polyphenols,PKP)具有免疫调节活性[8]。灵芝多糖(Ganoderma lucidum polysaccharides,GLP)是灵芝最具生物活性的成分物质,并具有极其突出的免疫学功能[9]。中国已经成为世界上癌症发病率最高的国家,辅助放疗是癌症综合治疗的重要组成部分,其中最常用的就是60Co-γ射线。免疫是机体的基本防御屏障,放疗会一定程度上直接破坏机体免疫细胞,从而降低机体的免疫功能,进而抑制机体免疫的抗肿瘤效果[10]。研究发现[11],联合使用免疫增强剂可能发生协同或拮抗作用,有可能使免疫激活效果大于或小于单一使用效果。因此有必要寻找合理、高效的免疫增强剂进行协同作用。在体内外实验用Chou-Talalay法证明AAP和PKP协同具有很好的抗氧化作用基础上[12-13],本研究设计使用PKP和AAP进行协同,讨论其对辐射导致的免疫损伤的修复作用,并结合实际应用,与公认具有极好免疫损伤修复作用的GLP进行对比。
1 材料与方法 1.1 药物及主要试剂没食子酸标准品(质量分数>99.0%,批号NACC60010),天津百伦斯生物技术有限公司;瑞氏-姬姆萨复合染液、D-Hanks’洗液、RPMI-1640培养液、红细胞裂解液、噻唑蓝MTT、二甲基亚砜DMSO,北京索莱宝科技有限公司;胎牛血清,浙江天杭生物与科技有限公司;伴刀豆凝集素A(ConA)、脂多糖(LPS),美国Sigma公司;葡萄糖、苯酚、硫酸、福林酚等试剂为国产分析纯。
黑木耳子实体购自中国哈尔滨市南极市场,经王振宇教授鉴定为木耳科木耳属木耳Auricularia auricula(L.ex Hook.)Underw.的子实体;红松球果采自大兴安岭,经王振宇教授鉴定为松科松属红松Pinus koraiensis Sieb.et Zucc.的球果;破壁灵芝孢子粉(GLP)由总后军需研究院提供,经王振宇教授鉴定为灵芝科灵芝属灵芝Ganoderma lucidum(Leyss.ex Fr.)Karst.的破壁孢子粉。
1.2 动物实验用昆明种小鼠,雌雄各半,体质量(27±2)g,由黑龙江中医药大学提供,许可证号SYXK(黑)2013-012。
1.3 主要仪器ALC-110.4分析天平,德国艾科勒ACCULAB公司;LEICA DM4000B正置智能荧光显微镜,德国韦茨拉尔·徕卡(Wetzlar Leica)公司;721分光光度计,上海精密科学仪器有限公司;TGL-16G台式离心机,上海安亭科学仪器厂;HEPACLASS100 CO2细胞培养箱,美国Thermo Electron公司;MODEL 550酶标仪,美国bio-rad公司。
2 方法 2.1 AAP和PKP的提取及检测分别取黑木耳子实体和红松球果去除脂肪,用0.1 mol/L NaOH提取AAP、70%乙醇提取PKP,得到提取液。粗多糖加入无水乙醇析出多糖,粗多酚经大孔树脂D101梯度洗脱收集50%乙醇洗脱片段,干燥多糖和多酚备用[13]。参考NY/T16762008食用菌粗多糖[14]测定AAP和GLP中多糖水平,参考GB/T8313200茶叶中多酚和儿茶素[15]测定PKP和TP中多酚水平。结果显示,AAP和GLP多糖质量分数分别为(81.28±2.54)%和(27.30±1.20)%,PKP中多酚质量分数分别为(48.30±1.36)%。
2.2 动物分组及给药取60只小鼠,随机区组设计法分成对照组、模型组、AAP组、PKP组、AP(AAP与PKP协同)组及GLP组,每组10只,雌雄各半。适应性饲养1周后,采用60Coγ射线一次性全身均匀照射,总照射吸收量4.0 Gy,吸收剂量率1 Gy/min建立辐射模型(对照组除外)。
根据预实验选择最佳给药剂量,约为半数致死剂量(LD50)百分之一,每天给药,AAP组ig 75.0 mg/kg(以多糖水平计)AAP,PKP组ig 25.0 mg/kg(以多酚水平计)PKP,AP组ig 37.5 mg/kg AAP+12.5 mg/kg PKP(以多糖、多酚水平计),GLP组ig 75.0 mg/kg(以多酚水平计)GLP,对照组和模型组ig生理盐水。每天给药1次,连续给药30 d。
2.3 脏器指数的测定给药结束后,停水停食24 h,称小鼠体质量,摘眼球取血后脱臼处死,迅速取出胸腺、肝脏、脾脏、心脏、肾脏和脑,剔除器官上的脂肪和结缔组织,生理盐水漂洗,滤纸擦干后称质量,并按照下式计算小鼠脏器指数。
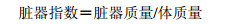
|
小鼠摘除眼球取血,瑞士-吉姆萨染液染色血涂片,显微镜下观察外周血白细胞的形态及数量变化,每张血涂片做200个分类计数。
2.5 碳廓清实验给药结束后停水停食24 h,分别取6组小鼠,10 mL/kg在其尾静脉处注射稀释3~4倍的印度墨水。墨汁注入即计时,分别在2(t1)、10 min(t2)内眦静脉丛处取20 μL血,立即加入到2 mL 0.1% Na2CO3溶液中,并在600 nm处测定2、10 min时的吸光值(A1、A2)。处死小鼠,分别取其肝脏和脾脏,生理盐水漂洗,滤纸擦干后称质量,计算小鼠吞噬指数(α)。
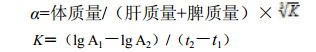
|
给药结束后停水停食24 h,颈椎脱臼处死小鼠,75%酒精中浸泡5 min杀菌,无菌状态下剪开腹部皮肤取出脾脏,放在75 μm细胞筛网上,加入少量D-Hanks’洗液,用注射器芯轻轻磨碎,收集滤液1 000 r/min离心5 min,弃上清;加入3 mL红细胞裂解液,裂解5 min,1 000 r/min离心5 min,弃上清;加入5 mL D-Hanks’洗液清洗,1000 r/min离心5 min,弃上清,重复2次;加入适量体积的RPMI-1640培养液使细胞浓度在1×106个/mL。将每份脾细胞悬液分两孔加入96孔板,每孔100 μL细胞悬液,一空加入5 μL Con A,另一孔做对照,测定Con A诱导的B淋巴细胞增殖反应。置于37 ℃、5% CO2培养箱中培养48 h后,每孔加入5 mg/mL MTT 10 μL,混匀,继续培养4 h;取出培养板,离心,吸弃上清液,加入100 μL DMSO,混匀,使紫色结晶完全溶解,酶标仪检测570 nm处AConA和A对照值,计算刺激指数(Stimulation Index,SI)。将Con A孔换成LPS,同法测定LPS诱导的B淋巴细胞增殖反应。
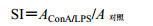
|
采用SPSS 17.0统计软件进行统计分析,结果均以x±s表示,组间差异采用单因素方差(ANOVA)LSD法分析。
3 结果 3.1 辐射后给药对小鼠器官指数的影响如表 1所示,与对照组比较,模型组小鼠脾脏、心脏和胸腺的器官指数显著降低(P<0.05),其中脾脏和胸腺呈极显著差异(P<0.01),肝脏指数也有一定降低,说明电离辐射会一定程度上降低小鼠器官指数,并且30 d内无法消除此损伤。与模型组比较,给药PKP、AP、GLP可以显著升高脾脏、心脏和胸腺指数(P<0.05、0.01),给药AAP可以显著升高心脏、胸腺指数(P<0.05、0.01)。表中AP和GLP组脾脏、心脏和胸腺的器官指数与模型组差异显著(P<0.05),其中脾脏和胸腺指数与对照组差异显著(P<0.05),说明ig AP和GLP可以一定程度上升高器官指数,但无法彻底消除此损伤。LSD法进行多重比较结果显示,与AAP和PKP比较,给药AP显著升高脾脏指数(P<0.05),说明ig AP与ig单一AAP或PKP对脾脏损伤修复差异显著,AP能更有效地修复辐射后脾脏表观损伤。
| 表 1 辐射后给药对小鼠器官指数的影响(x±s, n=10) Table 1 Effect of drug administration after radiation on organ index of mice (x±s, n=10) |
3.2 辐射后给药对小鼠白细胞数量及形态影响
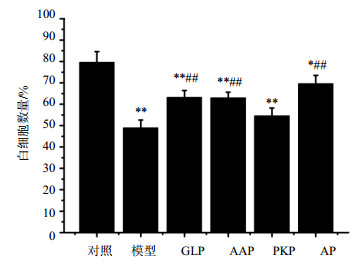
外周血白细胞主要是中性粒细胞、淋巴细胞和单核细胞[16],当机体受到损伤时,最常见的形态变化是异型淋巴细胞和形成幼稚白细胞[17]。如图 1所示,与对照组比较,模型组小鼠辐射后正常外周血白细胞数量显著降低,呈极显著差异(P<0.01),表明辐射会明显破坏小鼠正常外周血白细胞,且在30 d内不能消除损伤。与模型组比较,辐射后给药AAP、AP、GLP都能极显著升高正常外周血白细胞数量(P<0.01),AAP和GLP组与对照组比较差异极显著(P<0.01),AP组呈显著差异(P<0.05),说明给药AAP、AP、GLP能一定程度上缓解辐射后正常外周血白细胞损伤,但无法彻底恢复。LSD法进行多重比较结果显示,与AAP和PKP比较,给药AP显著升高外周血白细胞数量(P<0.05),说明ig AP与ig单一AAP或PKP对外周血白细胞损伤修复差异显著,AP能更有效地修复辐射后外周血白细胞损伤。
|
图 1 辐射后给药对小鼠正常外周血白细胞数量的影响(x±s, n=10) Fig. 1 Effect of drug administration after radiation on normal white blood cell counts of mice (x±s, n=10) |
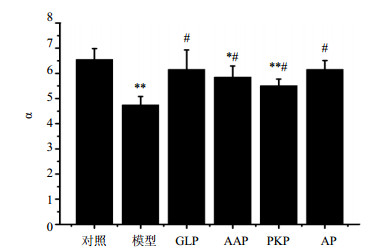
3.3 辐射后给药对小鼠巨噬细胞吞噬活性的影响
如图 2所示,与对照组比较,模型组小鼠辐射后α显著降低,呈极显著差异(P<0.01),表明辐射会明显降低小鼠巨噬细胞的吞噬作用,且在30 d内不能消除损伤。与模型组比较,辐射后给药AP和GLP能显著升高α(P<0.05);与对照组比较无显著差异(P>0.05),说明AP和GLP能显著升高小鼠巨噬细胞的吞噬作用,且基本可恢复正常水平。LSD法进行多重比较结果显示,与AAP和PKP比较,给药AP能显著升高α(P<0.05),说明ig AP与ig单一PKP对α修复差异显著,AP能更有效地修复辐射后小鼠巨噬细胞的吞噬作用。
|
图 2 辐射后给药对小鼠巨噬细胞吞噬作用的影响(x±s, n=10) Fig. 2 Effect of drug administration after radiation on phagocytosis of macrophage in mice (x±s, n=10) |
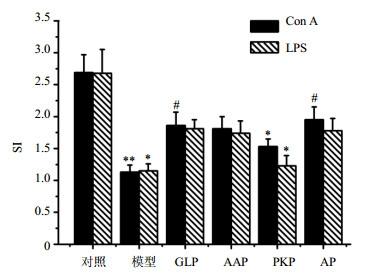
3.4 辐射后给药对脾淋巴细胞转化能力的影响
如图 3所示,与对照组比较,模型组小鼠辐射后脾T淋巴细胞SI即脾淋巴细胞增殖能力显著降低,呈极显著差异(P<0.01);脾B淋巴细胞增殖能力显著降低(P<0.05),说明辐射会显著降低ConA和LPS协助下脾细胞向T淋巴细胞和B淋巴细胞的转化能力,且在30 d内不能消除这种损伤。与对照组比较,辐射后给药AP和GLP能显著升高T淋巴细胞增殖能力(P<0.05),与对照组比较无显著差异(P>0.05)。与模型组比较,辐射后给药AAP、PKP、AP和GLP都能一定程度升高B淋巴细胞增殖能力,但差异不显著(P>0.05);其中AAP、AP和GLP组与对照组比差异不显著(P>0.05)。LSD法进行多重比较结果显示,与AAP和PKP组比较,给药AP显著升高脾T、B淋巴细胞SI(P<0.05),说明ig AP与ig单一PKP对脾T、B淋巴细胞增殖能力修复差异显著,AP能更有效地修复辐射后小鼠在ConA和LPS协助下脾细胞向T和B淋巴细胞的转化能力。
|
图 3 辐射后给药对小鼠脾淋巴细胞增殖能力的影响(x±s, n=10) Fig. 3 Effect of drug administration after radiation on splenocytes proliferation ability of mice (x±s, n=10) |
4 讨论
放疗是非手术治疗癌症最重要的方法。每年世界约有1亿人确诊为癌症,其中超过半数需要放疗[18]。电离辐射是放疗的形式之一,最常见的是60Co γ射线,但这种治疗方法同时会引起DNA损伤和一系列并发症[19]。60Co γ辐射后会引起严重的贫血、免疫缺陷、败血症、全血细胞减少等病症[20]。当停止辐射一段时间后造血干细胞可自行修复,造血系统会逐渐恢复[21]。研究显示,电离辐射会引起非特异性免疫和特异性免疫,能引起脾T、B淋巴细胞的减少[22],胸腺功能紊乱,外周血淋巴细胞凋亡[23],降低肝脏和脾脏巨噬细胞吞噬清除碳粒能力[24]等。
免疫调节是植物多酚类化合物重要生理功能之一,主要通过清除自由基保护免疫器官、组织和细胞受损,促进干扰素、白细胞介素等细胞因子的产生,激活巨噬细胞、NK细胞、T淋巴细胞和B淋巴细胞等。PKP是松中提取出的是类黄酮单体的混合物,主要是单体酚类(儿茶素、表儿茶素和花旗松素)和缩合黄酮(原花青素)的混合体;此外还含有微量的酚酸(如对羟基苯甲酸、原儿茶酸、没食子酸、香草酸、对香豆酸、咖啡酸和阿魏酸)和糖基化产物(黄酮醇或酚酸的吡喃葡萄糖衍生物)作为微量成分[25]。研究显示PKP可以增加免疫器官指数,增强脾脏T淋巴细胞增殖能力和巨噬细胞的吞噬能力[7, 26]。真菌多糖具有显著的免疫调节活性,能够激活适应性细胞免疫应答,还能有效地激活淋巴细胞,诱导特异性抗体的产生。GLP是灵芝中的主要活性成分,由葡萄糖、阿拉伯糖、木糖、半乳糖、岩藻糖、甘露糖、鼠李糖等单糖以β-(1→3)、β-(1→6)或β-(1→3)、β-(1→4)连接而成,具有很强的免疫调节活性。研究显示,GLP可以提高血液中白细胞和淋巴细胞数,提高脾淋巴细胞转化率和巨噬细胞的吞噬指数[27-29]。AAP是黑木耳中提取的最主要的活性成分,主要由葡萄糖以β-(1→3)键连接而成,研究显示黑木耳多糖可以提高小鼠脾脏和胸腺的器官指数,促进巨噬细胞的吞噬活性,提高淋巴细胞的增殖[30-31]。
本研究中辐射后小鼠肝脏、脾脏、心脏、胸腺等器官明显减小。肝脏是体内主要的代谢器官,辐射后给药AAP、PKP、AP和GLP可能会改善肝脏集中在中央静脉周围的内皮肿胀、终端肝小静脉狭窄、局部薄壁组织萎缩和胶原蛋白增生等损伤,从而增大肝脏[32]。脾脏可以识别和清除不易被噬菌体识别的细菌芽胞及过滤掉血液中衰老或损伤的血细胞[33],辐射后给药PKP、AP和GLP可能会显著减少辐射造成的白髓、红髓及脉管系统的损伤,进而促进脾脏体积增大[34-35]。心脏是脊椎动物身体中最重要的器官,主要作用是推动血液流向各器官、组织以供应氧和营养物质,并带走代谢的终产物。辐射后给药AAP、PKP、AP和GLP可能会显著缓解辐射后毛细血管内皮细胞的碱性磷酸酶活性缺失导致的心肌损伤、心肌细胞退化进而造成的血管周围以及间质出现纤维化等,从而增大心脏体积[36]。胸腺是是机体细胞免疫的重要免疫器官,是造血干细胞增殖分化为T淋巴细胞的重要场所,并是周围淋巴器官发育所必需的。胸腺细胞对辐射的敏感性很高,是最早开始衰老的器官[37]。辐射后给药AAP、PKP、AP和GLP可能能促进胸腺细胞的二次生长从而增加胸腺体积。电离辐射会显著降低血液髓质造血功能和白细胞数量,进而降低白细胞吞噬作用从而抑制血液免疫活性[38-39]。由于机体受损时外周白细胞最易产生异常,白细胞是人体非特异性免疫的第二道防线之一,因此常被作为非靶向细胞来测评生物辐射剂量[40]。本研究中小鼠辐射后正常外周血白细胞数量降低,辐射后给药AAP、PKP、AP和GLP可以一定程度上缓解辐射后外周血白细胞减少的损伤,但无法恢复到正常水平。巨噬细胞的吞噬作用也是机体非特异性免疫第二道防线之一。当较大的碳粒作为异物经静脉被注入小鼠血循环系统后,正常情况下可被肝脏和脾脏中巨噬细胞吞噬。碳廓清指数可以反映巨噬细胞的吞噬能力[1]。本研究中小鼠辐射后吞噬指数降低,辐射后给药AP和GLP可能是由于多糖是强烈的促细胞分裂原,巨噬细胞受到刺激发生增殖作用从而升高小鼠巨噬细胞的吞噬作用,并且效果显著,基本恢复正常水平。T和B淋巴细胞作为细胞免疫和体液免疫组成了机体的特异性免疫。ConA和LPS可以显著刺激脾细胞分化,细胞因子的增殖和分泌。ConA是最有效的凝集素之一[41],能显著促进脾细胞向T淋巴细胞转化能力,升高T淋巴细胞的增殖能力[42]。LPS能显著促进脾细胞向B淋巴细胞转化。本研究中小鼠辐射后在ConA和LPS协助下刺激脾T和B淋巴细胞指数即脾淋巴细胞增殖能力降低,辐射后给药AP和GLP能促进脾细胞向T淋巴细胞转化从而增强T淋巴细胞增殖能力,但促进脾细胞向B淋巴细胞转化能力不明显。
本研究表明,比较单一使用AAP和PKP,AP更能显著提高小鼠肝脏、脾脏、心脏和胸腺的器官指数,正常外周血白细胞数量,肝脏及脾脏吞噬作用和脾T及B淋巴细胞增殖能力;对比GLP,AP显著的结合了AAP和PKP的优点,最大程度的对辐射后小鼠的免疫损伤进行了修复。以上证明协同AAP和PKP综合了多糖和多酚在免疫调节的途径,从特异性免疫和非特异性免疫对辐射后小鼠进行了修复。今后可根据本研究对AAP和PKP的联合使用继续开发一种复合抗辐射或增强免疫功能食品,这在食品保健等研究领域具有广阔的应用前景。
| [1] | 张华.黑木耳中性多糖片段硫酸酯对辐射诱导氧化应激防护作用[D].哈尔滨:哈尔滨工业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10213-1013045074.htm |
| [2] | Wang D, Hu Y, Fan Y, et al. Immunoenhancing activity of sulfated Auricularia auricula polysaccharides[J]. Carbohyd Polym, 2012, 89(4):1117–1122. doi:10.1016/j.carbpol.2012.03.082 |
| [3] | Khaskheli S G, Zheng W, Sheikh S A, et al. Characterization of Auricularia auricula polysaccharides and its antioxidant properties in fresh and pickled product[J]. Int J Biol Macromol, 2015, 81:387–395. doi:10.1016/j.ijbiomac.2015.08.020 |
| [4] | Song G, Du Q. Isolation of a polysaccharide with anticancer activity from Auricularia polytricha using high-speed countercurrent chromatography with an aqueous two-phase system[J]. J Chromatogr A, 2010, 1217(38):5930–5934. doi:10.1016/j.chroma.2010.07.036 |
| [5] | 张秀娟, 耿丹, 于慧茹, 等. 黑木耳多糖对荷瘤小鼠红细胞免疫功能的影响[J]. 中草药, 2006,37(1):94–96. |
| [6] | 尹红力, 赵鑫, 佟丽丽, 等. 黑木耳多糖体外和体内降血糖功能[J]. 食品科学, 2015,36(21):221–226. |
| [7] | 刘冉, 王振宇, 崔杰, 等. 前体物质和诱导子对红松松多酚合成的影响[J]. 北京林业大学学报, 2013,35(5):22–27. |
| [8] | 王东.松多酚微球的制备及其对~(60) Co-γ射线辐射防护作用的研究[D].哈尔滨:哈尔滨工业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10213-1015981437.htm |
| [9] | 林志彬. 灵芝抗肿瘤活性和免疫调节作用的研究进展[J]. 北京大学学报:医学版, 2002,34(5):493–498. |
| [10] | 王小方, 郭小毛. 乳腺癌辅助放疗对抗肿瘤免疫影响的研究进展[J]. 中国癌症杂志, 2014(5):392–396. |
| [11] | Bai H, Liu R, Chen H, et al. Enhanced antioxidant effect of caffeic acid phenethyl ester and Trolox in combination against radiation induced-oxidative stress[J]. Chem Biol Interact, 2014, 207(25):7–15. |
| [12] | 张乃珣, 王振宇, 尹红力, 等. 红松多酚和黑木耳多糖对辐射诱导小鼠氧化损伤的防护作用[J]. 营养学报, 2016,38(3):278–284. |
| [13] | 张乃珣, 尹红力, 赵鑫, 等. 黑木耳多糖和松多酚协同对辐射小鼠氧化损伤的修复作用[J]. 药物评价研究, 2016,39(5):719–726. |
| [14] | 食用菌粗多糖测定[S]. NY/T16762008. |
| [15] | 茶叶中多酚和儿茶素测定[S]. GB/T83132008. |
| [16] | 王岩, 洪燕英, 刘密凤. 白细胞形态识别能力分析[J]. 中国卫生检验杂志, 2011(12):2920–2922, 2925. |
| [17] | 商宝文. 周围血片中白细胞、红细胞、血小板形态观察的临床意义[J]. 中级医刊, 1984(9):39–41. |
| [18] | Xu G, Bednarz B, Paganetti H. A review of dosimetry studies on external-beam radiation treatment with respect to second cancer induction[J]. Phys Med Biol, 2008, 53(13):193–241. doi:10.1088/0031-9155/53/13/R01 |
| [19] | Halliwell B, Aruoma O I. DNA-damage by oxygen-derived species[J]. Febs Lett, 1991, 281(1-2):9–19. doi:10.1016/0014-5793(91)80347-6 |
| [20] | Rodel F, Frey B, Gaipl U, et al. Modulation of inflammatory immune reactions by low-dose ionizing radiation:molecular mechanisms and clinical application[J[[J]. Curr Med Chem, 2012, 19(12):1741–1750. doi:10.2174/092986712800099866 |
| [21] | Hekim N, Cetin Z, Nikitaki Z, et al. Radiation triggering immune response and inflammation[J]. Cancer Lett, 2015, 368(2):156–163. doi:10.1016/j.canlet.2015.04.016 |
| [22] | Harrington N P, Chambers K A, Ross W M, et al. Radiation damage and immune suppression in splenic mononuclear cell populations[J]. Clin Exp Immunol, 1997, 107(2):417–424. doi:10.1111/cei.1997.107.issue-2 |
| [23] | Cui Y F, Gao Y B, Yang H, et al. Apoptosis of circulating lymphocytes induced by whole body γ-irradiation and its mechanism[J]. J Environ Pathol Tox, 1999, 18(3):185–189. |
| [24] | Sheel M, Engwerda C R. The diverse roles of monocytes in inflammation caused by protozoan parasitic diseases[J]. Trends Parasitol, 2012, 28(10):408–416. doi:10.1016/j.pt.2012.07.008 |
| [25] | Figuero E, Soory M, Cerero R, et al. Oxidant/antioxidant interactions of nicotine, Coenzyme Q10, Pycnogenol and phytoestrogens in oral periosteal fibroblasts and MG63 osteoblasts[J]. Steroids, 2006, 71(13-14):1062–1072. doi:10.1016/j.steroids.2006.09.003 |
| [26] | 黄雨洋.红松多酚分离鉴定及抗氧化抗癌功能研究[D].哈尔滨:东北林业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10225-1014411651.htm |
| [27] | 李建军.灵芝多糖免疫调节作用与抗肿瘤作用的关系及作用机制的研究[D].广州:第一军医大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-90023-2007211537.htm |
| [28] | 陈亚非, 陈金显. 灵芝多糖免疫调节及抗肿瘤作用综述[J]. 中国食品添加剂, 2002(4):36–41. |
| [29] | 江振友, 林晨. 灵芝多糖对小鼠细胞免疫功能调节作用的实验研究[J]. 微生物学杂志, 2003(2):51–54. |
| [30] | 张会新, 刘洪雨, 刘畅, 等. 黑木耳多糖对小鼠免疫功能的影响[J]. 动物医学进展, 2009(7):23–25. |
| [31] | 张秀娟, 于慧茹, 耿丹, 等. 黑木耳多糖对荷瘤小鼠细胞免疫功能的影响研究[J]. 中成药, 2005(6):691–693. |
| [32] | Benson R, Madan R, Kilambi R, et al. Radiation induced liver disease:A clinical update[J]. J Egypt Natl Canc Inst, 2016, 28(1):7–11. doi:10.1016/j.jnci.2015.08.001 |
| [33] | Sabatino A D, Carsetti R, Corazza G R. Post-splenectomy and hyposplenic states[J]. Lancet, 2011, 378(9785):86–97. doi:10.1016/S0140-6736(10)61493-6 |
| [34] | Trip A K, Sikorska K, Sandick J W, et al. Radiation-induced dose-dependent changes of the spleen following postoperative chemoradiotherapy for gastric cancer[J]. Radiother Oncol, 2015, 116(2):239–244. doi:10.1016/j.radonc.2015.07.036 |
| [35] | Yi J, Zhu R, Wu J, et al. Ameliorative effect of betulinic acid on oxidative damage and apoptosis in the splenocytes of dexamethasone treated mice[J]. Int Immunopharmacol, 2015, 27(1):85–94. doi:10.1016/j.intimp.2015.04.050 |
| [36] | 曹飞.富H_2溶液的辐射防护效应及其机制研究[D].上海:第二军医大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-90024-1012404806.htm |
| [37] | 谢靖.紫薯素对~(60)Coγ辐射导致的小鼠胸腺细胞损伤的抑制作用及机制[D].青岛:中国海洋大学, 2011. |
| [38] | Day R M, Kupper M B, Mog S R, et al. Genistein protects against biomarkers of delayed lung sequelae in mice surviving high-dose total body irradiation[J]. J Radiat Res (Tokyo), 2008, 49(4):361–372. doi:10.1269/jrr.07121 |
| [39] | Ran Y, Xu B, Wang R, et al. Dragon's blood extracts reduce radiation-induced peripheral blood injury and protects human megakaryocyte cells from GM-CSF withdraw-induced apoptosis[J]. Phys Medi, 2016, 32(1):84–93. doi:10.1016/j.ejmp.2015.09.010 |
| [40] | Kadam S B, Shyama S K, Almeida V G. Evaluation of the in vivo genotoxic effects of gamma radiation on the peripheral blood leukocytes of head and neck cancer patients undergoing radiotherapy[J]. Mutat Res-Gen Tox En, 2013, 752(1-2):42–46. doi:10.1016/j.mrgentox.2013.01.003 |
| [41] | Stojanovi M M, Ivkovi I P, Petrui V, et al. In vitro stimulation of Balb/c and C57 BL/6 splenocytes by a recombinantly produced banana lectin isoform results in both a proliferation of T cells and an increased secretion of interferon-gamma[J]. Int Immunopharmacol, 2010, 10(1):120–129. doi:10.1016/j.intimp.2009.10.007 |
| [42] | Gholamnezhad Z, Rafatpanah H, Sadeghnia H R, et al. Immunomodulatory and cytotoxic effects of Nigella sativa and thymoquinone on rat splenocytes[J]. Food Chem Toxicol, 2015, 86:72–80. doi:10.1016/j.fct.2015.08.028 |
 2016, Vol. 39
2016, Vol. 39


