2. 浙江省水环境与海洋生物资源保护重点实验室, 浙江 温州 325035
2. Zhejiang key lab of water environmental and marine bio-resources protection, Wenzhou 325035, China
羊栖菜Sargassum fusiforme(Harv.)Setch是一种营养丰富的药食两用海藻,享有“长寿菜”的美誉,隶属于褐藻门马尾藻科马尾藻属,广泛分布在西太平洋沿海,尤以浙江沿海分布最多。中国药典古籍中早有记载羊栖菜用于治疗甲状腺相关疾病,现代医学研究进一步表明,羊栖菜不仅是一种非常有潜力的天然抗氧化剂,而且对治疗肿瘤、心血管疾病、降低血糖和延缓衰老等都有一定的效果[1-2]。日本已有羊栖菜相关的饮品和保健品的开发和销售,其主要成分为羊栖菜多糖(Sargassum fusiforme polysaccharides,SFPS)。然而,SFPS保健作用的分子机制仍不清晰,是否存在副作用也未有详细评估。
SFPS主要成分为褐藻糖胶、褐藻胶和褐藻淀粉,而羊栖菜的许多生物活性,如抗氧化[3-5],抗肿瘤和调节免疫[6-7]等与褐藻糖胶密切相关。目前,SFPS提取工艺比较成熟[8-9],纯化分级得到进一步完善,然而,不同的提取和纯化工艺所得到的SFPS的成分组成存在较大的差异。本实验室采用85 ℃热水煮提、乙醇沉淀、氯化钙去除褐藻胶等多种工序提取得到一组SFPS。前期研究表明,SFPS具有很强的抗氧化和抗衰老作用[4]。但是,部分抗氧化与抗衰老药物对成熟个体生育能力有一定的副作用[10-11],因此,本实验通过喂食亲本黑腹果蝇不同浓度的SFPS,评估SFPS是否影响成熟个体的生育能力并探讨其可能的分子机制。
本研究以黑腹果蝇为模式生物,对照(0%)、低(0.033%)、中(0.167%)、高(0.500%)4个浓度梯度的SFPS分别喂食亲本雌雄蝇,持续15 d后交配,评估前期SFPS处理后,对亲本雌雄蝇生育能力以及子代果蝇的生长发育的影响。并进一步利用荧光定量PCR(qRT-PCR)技术检测果蝇生殖与发育相关基因Vasa[12]、Achi[13]、Figla[14]和mTOR[15]的mRNA水平的变化情况,以确定SFPS对果蝇生殖与发育影响的可能机制。
1 材料 1.1 药材、提取工艺及主要试剂羊栖菜,采自浙江省温州市洞头沿海海岸,经浙江省温州市羊栖菜研究所吴明江教授鉴定为马尾科马尾藻属羊栖菜Sargassum fusiforme(Harv.)Setch。
采摘新鲜羊栖菜,烘干至恒重,粉碎,筛网过滤,除去未粉碎杂质。称取粉末500 g,加入无水乙醇,水浴回流提取3次,每次2 h。收集滤渣,加入15 L蒸馏水加热蒸煮3遍,分别为4、3、2 h。两层纱布滤过,收集滤液65 ℃旋蒸浓缩各至5 L,离心收集上清液,继续浓缩至总量为3 L。浓缩液加入无水乙醇至浓度为80%,醇沉过夜。收集上清液,4 800 r/min离心10 min。收集上清液,加入4 mol/L氯化钙至不再产生沉淀,离心取上清液,80%乙醇醇沉过夜,取沉淀常规干燥,真空干燥,得到SFPS[16]。
从500 g羊栖菜粉末中提取SFPS,其主要成分为褐藻糖胶,干燥后净重27.81 g,得率为5.56%,总糖质量分数为83.21%,糖醛酸及蛋白质的质量分数均较低,分别为3.67%和3.45%,表明SFPS为酸性多糖,多糖中的蛋白质可能不是游离蛋白质,而是与多糖结合的糖蛋白[17]。这些多糖性质分析表明SFPS的纯度较高。
玉米-糖-酵母基本培养基、琼脂、氯化钙、氯化钠、氯化钾、无水磷酸氢二钠、磷酸二氢钾、异丙醇、氯仿,均购自国药集团化学试剂有限公司;蔗糖、丙酸(西陇化工股份有限公司);酵母浸出粉、干酵母粉(上海蓝季科技发展有限公司);乙醇(安徽安特食品股份有限公司);Trizol® Reagent(美国ambion公司);HiScript® QRT Super Mix for qPCR、RNase Free DNase酶(中国南京诺唯赞生物科技有限公司);SYBR Green II(日本大阪Toyobo公司)。
1.2 实验动物野生型黑腹果蝇,由温州大学生命与环境科学学院遗传学实验室提供,收集8 h内羽化未交配的成虫,雌雄分开,在温度为(25±1)℃,相对湿度为45%~65%的条件下普通培养基饲养备用。
1.3 主要仪器1525高效液相色谱仪,包括2487紫外检测器、717plus自动进样器及Breeze工作站,购自英国Waters科技有限公司;MS105DU电子天平(上海梅特勒-托利多仪器有限公司);HH-2数显恒温水浴锅(江阴市保利科研器械有限公司);Milli-Q超纯水仪(德国Millipore公司);HWS智能型恒温恒湿培养箱(宁波江南仪器厂);挑蝇板、果蝇管(海门市健力实验器材厂);洁净工作台(苏净集团安泰空气技术有限公司),Applied Biosystems Veriti PCR仪、LightCycler 480 Ⅱ(瑞士Roche公司)。
2 方法 2.1 对黑腹果蝇繁殖力的影响收集8 h内羽化的果蝇,CO2麻醉后区分雌雄,随机分为8组(雌蝇4组、雄蝇4组),每组100只,分别放在含有0.0%(对照组)、0.033%、0.167%和0.500%热提SFPS的培养基中饲养。15 d后每组各取30只,每10只为一小组,共3组,与普通雌雄蝇配对。转入普通培养基使其受精产子,待子代果蝇(F1代)开始孵化时,每24 h观察并记录羽化子代数量,培养3 d后,体视显微镜观察体型变化,分析天平称取体质量(每15只果蝇为一组)变化[17]。
2.2 基因序列与引物设计鉴于果蝇发育相关基因的重要性,根据昆虫发育过程中相关基因的上下游关系、相互作用方式以及功能特点确定,研究的基因中包括生殖细胞分子标记基因Vasa,调控卵细胞发育成熟转录因子Figla,雄性减数分裂阻滞基因Achi,调控生长发育相关基因mTOR以及内参基因RP49[18]。引物序列(表 3),由深圳华大基因科技服务有限公司合成。
| 表 1 基因及其特异引物 Table 1 Genes and specific primers |
| 表 2 SFPS对雌蝇子代数量的影响(x±s, n=3) Table 2 Effect of SFPS on offspring quantity of female D. melanogaster(x±s, n=3) |
| 表 3 SFPS对雌蝇子代体质量的影响(x±s, n=3 Table 3 Effect of SEPS on offspring weight of female D. melanogaster (x±s, n=3) |
2.3 RNA提取和cDNA合成
收集多糖处理15 d后亲代果蝇及F1子代果蝇,采用Trizol法提取总RNA,并用RNase Free DNase酶消化残留的基因组DNA。以总RNA为模板,参照HiScript反转录试剂盒说明书进行操作将mRNA反转录为cDNA,并保存于-20 ℃备用。
2.4 qRT-PCR实验以cDNA为模板,分别以各基因特异引物进行PCR扩增。利用Rotor-Gene荧光定量PCR仪进行实时荧光定量PCR,反应体系按SYBR Green II说明书进行,正向和反向引物各1 μL,最终反应体系为20 μL,RP49为内参基因。利用溶解曲线分析引物的特异性扩增,每组3次重复。试验得到的数据用LinRegPCR和Rotor-Gene软件计算,并利用相对定量分析法进行分析。
2.5 数据处理实验数据采用SPSS 16.0和Prism 5软件处理,以x±s表示,各组均数间差异采用LSD-t检验。
3 结果 3.1 对雌性果蝇繁殖能力及子代生长发育的影响与对照组比较,随着亲代雌蝇饲喂SFPS浓度的增加,低、中浓度组的子代雌雄果蝇数量显著增多(P<0.05),但高浓度SFPS处理后,子代雌雄果蝇的数量明显下降(P<0.05)。见表 2。
研究发现,子代果蝇体质量也与母本喂食SFPS的浓度密切相关。与对照组比较,SFPS处理后的雌性果蝇子代的体质量呈明显上升趋势(P<0.05),低、中浓度SFPS对子代体质量增加综合表现较优。中浓度组雌性后代平均体质量高达(9.60±1.09)mg,与对应的对照组比较增加近27.5%;而雄性后代则在低浓度(0.033%)组中体质量增加最大,约19%,与对照组比较差异显著(P<0.05)。见表 3。
通过观察子代果蝇每天的羽化量,探讨母本果蝇被不同浓度SFPS处理后,其子代果蝇的生长发育是否受到影响。研究表明,前3天0.033%和0.167% SFPS组每天羽化量与对照组较一致,随后每天羽化量都有所增加,第10天达到最高值,其中0.033%组表现最优,0.167%组次之,而0.500%组与对照组比较,每天羽化量相对较少。母本果蝇喂食SFPS后,其子代平均的羽化时间约为10.9 d,与对照组(10.9 d)比较未出现显著性差异。见图 1。
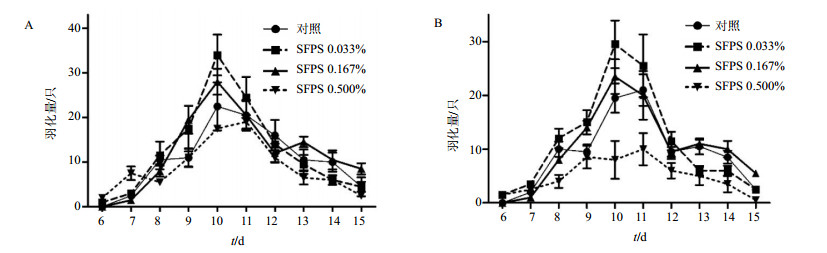
|
图 1 SFPS喂食果蝇后,F1代雌蝇幼虫(A)以及雄蝇幼虫(B)每天羽化量(x±s, n=3) Fig. 1 When mother flies fed with SFPS, number of everyday eclosion for F1 female (A) and male (B) D. melanogaster generation (x±s, n=3) |
尽管与对照组比较未出现显著性差异,但SFPS处理后的雄性子代的平均羽化时间都略大于平均水平,约为11.4 d。考虑到SFPS对于后代雌雄果蝇数量的影响可能会导致羽化时间的变化,于是本研究进一步分析了SFPS处理母本果蝇后,其子代的雌雄比例。雌雄比例随着母本果蝇喂食SFPS后都呈现不同程度增加,而中浓度SFPS处理后子代果蝇的雌雄比例高达(1.26±0.19),与对照组比较具有极显著差异(P<0.01)。见表 2。
综上所述,喂食低、中浓度的SFPS可以有效地提高母本果蝇的生育能力,并且与对照组的子代果蝇比较,喂食低、中浓度SFPS母本果蝇后,能有效地促进子代后续的生长和发育。
3.2 对雄性果蝇生殖力及其子代生长发育的影响由表 4可知,中、高浓度组子代果蝇数量显著增加,并且0.167% SFPS组的综合表现最优。与对照组比较,0.167% SFPS浓度组的子代果蝇数量(表 4)和体质量(表 5)都显著上升(P<0.05)。
| 表 4 SFPS对雄蝇子代数量的影响(x±s, n=3) Table 4 Effect of SFPS on offspring quantity of male D. melanogaster(x±s, n=3) |
| 表 5 SFPS对雄蝇子代体质量的影响(x±s, n=3) Table 5 Effect of SFPS on offspring weight of male D. melanogaster(x±s, n=3) |
与喂食母本果蝇SFPS不同的是,0.033% SFPS父本果蝇喂食组的雌性子代果蝇数量呈下降趋势(P<0.05),高浓度组却显著增加(P<0.05),见表 4。与对照组比较,父本果蝇喂食SFPS后,其子代果蝇的体质量都明显增加(表 5),其中0.167%浓度组变化最为显著,雌性和雄性后代分别为(9.50±0.99)mg和(7.59±0.98)mg,分别比对应的对照组增加近26.4%和25.7%。
本研究也分析了父本果蝇SFPS处理后,其子代果蝇每天的羽化量和平均的羽化时间。F1代果蝇每天羽化量中,雌性果蝇每天羽化量变化相近(图 2A),而雄性果蝇每天羽化量变化浮动较大(图 2B)。
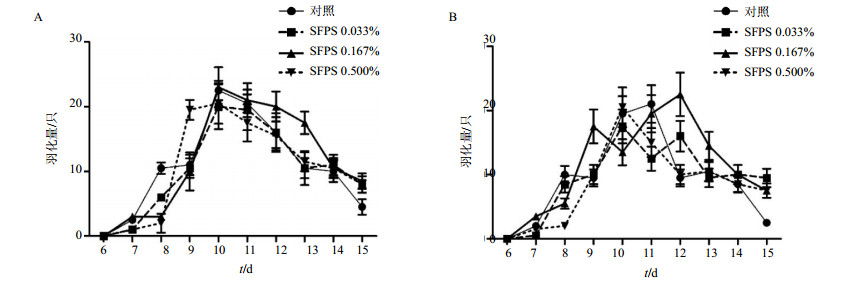
|
图 2 SFPS喂食父本果蝇后,F1代雌蝇幼虫(A)以及雄蝇幼虫(B)每天羽化量(x±s, n=3) Fig. 2 When father flies fed with SFPS, number of everyday eclosion for F1 female (A) and male (B) D. melanogastergeneration (x±s, n=3) |
另外,研究发现,子代果蝇的雌雄比例随父本果蝇喂食SFPS浓度升高而升高(表 4)。与母本果蝇喂食SFPS后相似,父本果蝇喂食SFPS后,其子代果蝇的平均羽化时间未受显著影响,但其雄性子代的平均羽化时间(11.4 d)比对照组略有升高。
综上所述,喂食中、高浓度的SFPS可以有效地提高父本果蝇的生育能力并促进其子代果蝇的生长和发育,而0.167%的SFPS对父本果蝇的作用效果最优。
3.3 对亲代果蝇生殖相关基因的影响与对照组雄性果蝇比较,SFPS处理后父本果蝇Achi的mRNA表达水平显著上升(P<0.01、0.001)(图 3A)。当母本果蝇经SFPS处理后,雌蝇0.033%组Achi的mRNA的表达水平比对照组雌性果蝇的表达水平提高了近6倍(P<0.001),但需要注意的是,相对于雄蝇,雌蝇中Achi mRNA的绝对水平很少。
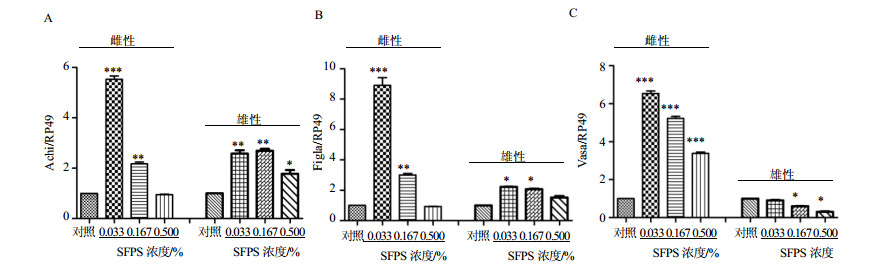
|
与对照组比较:*P<0.05 **P<0.01 ***P<0.001,下同 *P < 0.05 **P < 0.01 ***P < 0.001 vscontrol group, same as below 图 3 SFPS对果蝇生殖发育相关基因Achi(A)、Figla(B)和Vase(C)的影响(x±s, n=3) Fig. 3 Effects of SFPS on reproductive associated genes, Achi (A), Figla (B) and Vasa (C) of D. melanogaster (x±s, n=3) |
在雌蝇0.033%组中,Figla mRNA的表达水平约是对照组的9倍(图 3B)。而Vasa基因,SFPS处理后在雌雄果蝇中出现了相反的变化。在雌性实验组中,SFPS促进雌蝇Vasa mRNA的表达,低浓度的SFPS对雌蝇Vasa mRNA的促进作用最显著;而在雄性实验组中,SFPS处理后却抑制雄蝇Vasa的mRNA表达水平(图 3C)。
综上所述,研究发现,持续喂食SFPS后,亲本果蝇中与生殖发育相关基因在mRNA水平上显著提高,这可能是SFPS影响亲本生育能力的内在联系。
3.4 对子代果蝇生长发育基因mTOR的影响当亲本果蝇持续给予SFPS后,子代果蝇的体型和体质量都发生了显著变化,本研究检测了mTOR基因在各组子代中的表达模式。当亲本喂食SFPS后,大部分子代果蝇中mTOR的表达水平显著升高,并且mTOR在子代雌蝇中比子代雄蝇中升高的更明显。然而,亲本喂食SFPS的剂量与子代中mTOR的mRNA表达水平变化,并未表现出一一对应的关系。亲本经0.033%和0.500%浓度SFPS处理后,其子代果蝇的mTOR表达水平显著上升,然而经0.167%浓度组处理后的子代并没有显示出任何变化(图 4)。在雄性子代中,高浓度实验组中mTOR基因表达上升较为明显,在0.167%浓度组中反而没有变化甚至略微下降趋势(图 4B)。
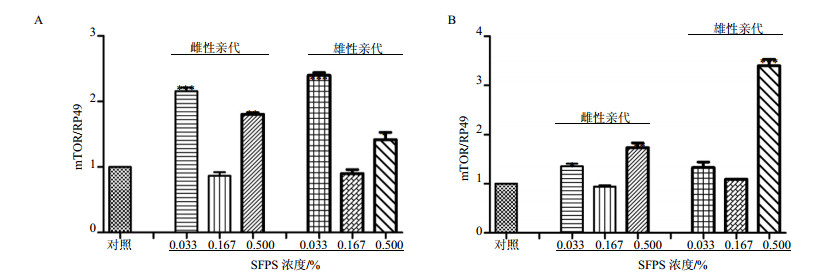
|
图 4 SFPS对子代雌性(A)和子代雄性(B)mTOR基因的影响(x±s, n=3) Fig. 4 Expression levels of mTOR mRNA in female offspring (A) and male offspring (B), when father and mother flies fed with different doses of SFPS (x±s, n=3) |
综上所述,当亲本喂食低、高浓度的SFPS后,其子代果蝇的mTOR表达水平普遍升高,子代雌蝇变化更为显著,雄蝇mTOR的转录可能还受到其他信号通路的影响。
4 讨论羊栖菜是一种药食两用的经济型海藻,其营养丰富却价格低廉。同时也有研究表明,羊栖菜也发挥着抗氧化、抗肿瘤、抗炎症、缓解疲劳等功效[1]。我国的羊栖菜养殖面积很大,但主要以低廉价格的干菜形式出口日本。因此,开发羊栖菜的药用价值既有实际的科学价值,更具潜在的经济效益。SFPS是羊栖菜中一类主要的活性成分,季宇彬等研究发现SFPS通过调控p53基因表达而发挥抗肿瘤的作用[20-21],而且SFPS的抗氧化活性与其抗肿瘤[22]、降血糖活性[23-24]密切相关。本课题组前期研究发现,经疏水树脂分离的水提SFPS组分具有清除自由基,保护小鼠的急性氧化肝损伤的作用[4, 10]。但关于SFPS的安全性评估和毒理学研究还不清晰,本实验初步探讨SFPS对生育能力的影响。因黑腹果蝇具备遗传背景清晰、基因组与人类基因组保守性高、生命周期短、繁殖快等优势,所以利用黑腹果蝇作为模式生物,通过喂食SFPS,评估其对动物生育力及子代生长发育的影响及其可能的分子机制。
喂食SFPS能普遍地提高亲本果蝇的生育能力及其子代果蝇的发育状态。然而,SFPS对雌雄果蝇的影响存在不同的剂量依赖性。在设立的4个浓度梯度实验组中,低浓度SFPS对母本果蝇生殖力的促进作用最优,随着SFPS喂食浓度的升高,母本果蝇的生殖力却逐渐下降(表 3),这与其生育相关基因Achi、Figla和Vasa的表达模式十分吻合(图 3)。TGIF家族成员Achi是一种减数分裂阻滞基因,并可调控果蝇生殖细胞发育与成熟过程,尤其在精子发生与成熟过程中发挥着关键作用;Figla基因调控卵细胞发育,是果蝇发育成熟相关的标记之一;而Vasa则是果蝇生殖细胞的标记基因。推测喂食SFPS可能直接或间接调控生殖发育相关基因,如Achi、Vasa和Figla等的转录水平,影响性腺发育和生殖细胞的成熟,最终影响母本果蝇的生育能力。此外,尽管子代果蝇并不喂食SFPS,本研究发现子代果蝇的个体发育与亲本喂食不同浓度的SFPS存在一定的相关性。有研究表明,PI3K/Akt/mTOR信号通路与个体发育、细胞生长、分化和增殖密切相关[15]。当亲本喂食低和高浓度的SFPS后,其子代果蝇的mTOR表达水平普遍升高,而子代雌蝇变化更为显著。本课题组还发现喂食SFPS后,其子代果蝇的雌雄比例也受到显著影响,但相关机制仍不清楚。有研究表明,饮食模式与个体的基因组学和表观遗传学密切相关。推测喂食SFPS后可能对果蝇的基因组的表达模式产生影响,同时,其还可能影响亲代和子代的表观遗传学,但内在的机制有待进一步研究。
综上所述,本课题组采取热提醇沉方法得到性质稳定的SFPS,以黑腹果蝇为模式生物,选取合适浓度SFPS进行处理。结果表明,低和中浓度SFPS分别对雌性和雄性果蝇的生育力有显著的促进作用。本研究为接下来SFPS的活性研究奠定科学基础,并为SFPS的开发提供依据。
| [1] | 张展, 刘建国. 羊栖菜的研究评述[J]. 海洋水产研究, 2002,9(23):67–69. |
| [2] | 季宇彬, 高世勇. 羊栖菜多糖体外抗肿瘤作用及其作用机制的研究[J]. 中草药, 2003,34(12):1111–1114. |
| [3] | Wang W, Lu J B, Wang C, et al. Effects of Sargassum fusiforme polysaccharides on antioxidant activities and intestinal functions in mice[J]. Int J Biol Macromol, 2013, 58(1):127–132. |
| [4] | Wu M J, Wu Y, Qu M, et al. Evaluation of antioxidant activities of water-soluble polysaccharides from brown alga Hizikia fusiformis[J]. Int J Biol Macromol, 2013, 56(3):28–33. |
| [5] | Zhou J, Hu N, Wu Y L, et al. Preliminary studies on the chemical characterization and antioxidant properties of acidic polysaccharides from Sargassum fusiforme[J]. J Zhejiang Univ Sci B, 2008, 9(1):721–727. |
| [6] | Chen X M, Nie W J, Yu G Q, et al. Antitumor and immunomodulatory activity of polysaccharides from Sargassum fusiforme[J]. Food Chem Toxicol, 2012a, 50(1):695–700. |
| [7] | Chen X M, Nie W J, Yu G Q, et al. A polysaccharide from Sargassum fusiforme protects against immunosuppression in cyclophosphamide-treated mice[J]. Carbohyd polym, 2012b, 90(2):1114–1119. doi:10.1016/j.carbpol.2012.06.052 |
| [8] | 司晓喜, 袁智泉, 邱贺媛, 等. 海藻有效成分的提取分离研究进展[J]. 延边大学学报, 2011,37(2):103–104. |
| [9] | 尹尚君, 徐涛, 刘丽平, 等. 羊栖菜岩藻黄质的提取工艺研究[J]. 食品工业科技, 2011,4:272–274. |
| [10] | Ferreira C, Sousa M, Rabaça A, et al. Impact of metformin on male reproduction[J]. Curr Pharm Des, 2015, 21(25):3621–3633. doi:10.2174/1381612821666150710150041 |
| [11] | Alves M G, Martins A D, Vaz C V, et al. Metformin and male reproduction:effects on Sertoli cell metabolism[J]. Br J Pharmacol, 2014, 171(4):1033–1042. doi:10.1111/bph.12522 |
| [12] | 陈玉冬, 邹志华, 王艺磊, 等. vasa基因研究进展[J]. 动物学杂志, 2010,45(4):173–180. |
| [13] | 张鹏杰. RNAi提高家蚕对BmNPV的抗性及家蚕精细胞发育相关基因Achi功能的研究[D].苏州:苏州大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10285-1013120082.htm |
| [14] | 王慧丹.卵巢早衰的相关因素分析及WT1、DMC1基因在卵巢早衰发病机制中的作用研究[D].济南:山东大学, 2015. |
| [15] | 綦松智, 吴登俊, 张中显, 等. mTOR对信号通路调控的研究进展[J]. 中国畜牧杂志, 2010,46(1):57–60. |
| [16] | 李伟, 张旭, 吴明江. HPLC法分析羊栖菜与铜藻多糖的单糖组成[J]. 高师理科学刊, 2015,35(7):49–51. |
| [17] | 谢何杰, 叶慧娴, 沈婷, 等. 羊栖菜化学成分和药理活性的研究进展[J]. 浙江农业科学, 2014(4):487–491. |
| [18] | 徐曼妮, 张欣文, 徐思红. 邻苯二甲酸二丁酯对雌性果蝇生育力的影响[J]. 同济大学学报, 2008,29(2):53–54. |
| [19] | Matzkin L M, Johnson S, Paight C, et al. Dietary protein and sugar differentially affect development and metabolic pools in ecologically diverse drosophila[J]. J Nutr, 2011, 141(6):1127–1133. doi:10.3945/jn.111.138438 |
| [20] | 季宇彬, 高世勇, 张秀娟, 等. SFPS抗肿瘤作用及其作用机制的研究[J]. 中国海洋药物, 2004,4:7–10. |
| [21] | 季宇彬, 高世勇, 孔琪, 等. SFPS对肿瘤细胞P53基因蛋白表达的影响[J]. 哈尔滨商业大学学报:自然科学版, 2001,17:1–3. |
| [22] | 岑颖洲, 马夏军, 王凌云, 等. SFPS的制备及其对HepG2细胞的抑制作用[J]. 中国海洋药物, 2005,24(1):20–22. |
| [23] | 王尊文, 华玉琴, 李国平, 等. SFPS对高血脂模型大鼠血脂和抗氧化功能的影响[J]. 中国海洋药物, 2008,27:13–15. |
| [24] | 倪小芬, 郑超, 田吉来, 等. SFPS对H2O2诱导胰岛β细胞凋亡的保护作用及PI3K抑制剂的影响[J]. 中华中医药学刊, 2009,27:1506–1508. |
 2016, Vol. 39
2016, Vol. 39


