药物临床试验是确证新药有效性和安全性必不可缺少的重要环节。试验药物的管理是临床试验运行管理的关键环节之一,试验药物的管理是否规范,会直接影响临床试验结果的质量,试验用药物的管理同样也是药物临床试验机构资格认定现场检查和临床试验项目检查的一项重要内容[1]。国家食品药品监督管理总局(CFDA)在2003年版《药物临床试验质量管理规范》(GCP)[2]中对试验用药品的管理作了相关规定;CFDA审核查验中心2014年制定的《药物临床试验机构资格认定检查细则》(试行)[3]中,进一步明确了对试验用药品的管理要求。现已有越来越多的临床试验机构正在探索建立试验药物中心化管理模式。在药物临床试验信息化领域,早在20世纪90年代,发达国家已经开始研发药物临床试验管理系统。而我国药物临床试验研究和管理部门的信息化建设正在起步阶段,据不完全统计有30余家医疗机构的临床试验机构办公室安装了药物临床试验机构管理系统,实现机构办公室与专业各科室、医技科室、药物临床试验药房和财务的联网[4]。上海中医药大学附属曙光医院临床试验机构于2006年成立之初就设置了独立的临床试验中心药房(GCP药房),并逐步推行信息化管理系统的建设,现已形成了较为成熟的临床试验机构专用药房集中管理模式,提升了临床试验的整体管理水平,从而保证了临床试验的质量。现将该院开展临床试验用药物管理的实践与体会与同行们分享,以期为建设试验用药物的规范化管理模式提供借鉴及参考依据。
1 建立试验用药物中心化管理模式 1.1 试验用药物的管理模式目前,国内的临床试验机构对试验用药物的管理模式主要有两种:一种是采用临床试验专业组内药品管理员管理药物的模式;另一种是成立临床试验专用药房,集中统一管理所有试验用药品[4]。二种管理模式均实行专人专管,但各有利弊。前一种方式药物的发放使用方便,操作便捷,不受节假日限制,但各专业组科室管理质量参差不齐,配备的人员、药房的保存条件差异较大,试验药物的监管难度大,已难以符合临床试验用药物的管理要求;而另一种由药物临床试验机构办公室管理下的GCP药房,药物的存储设备齐全,保存条件可控,并配备有经过培训后能够熟练掌握GCP各项规章制度和管理要求的专职药师,以确保各个操作环节规范可靠,虽然在节假日发放药物上存在着一定的限制,但只要做好合理的安排,以保证试验用药物的使用周期在可控范围内。这也是目前国内大多数临床试验机构采取的药物管理模式[5-7]。
1.2 GCP药房的硬件保障上海中医药大学附属曙光医院的GCP药房实行试验用药物的专人、专职、集中管理模式,隶属临床试验机构办公室统一管理,药房配备有2名专职药师负责管理试验用药物,从接收、保存、发放、回收、返还过程实现一体化管理。药房内配备有药物贮存架及药物冷藏柜,空调、除湿机、加湿器,24 h电子温湿度监控设施等,严格按照药物的储存条件储藏药物,设置了试验用药物存放区、回收区及暂存区,所有试验用药物严格按项目分区域独立存放,标注药物名称,做到标识清晰明了,以避免药物混淆情况发生。
2 推行试验用药物的信息化管理系统随着电子计算机和网络技术的飞速发展,信息化技术已渗透到医疗行业的各个领域。药物临床试验管理的电子化是临床试验发展到一定阶段后的必然趋势[8-9]。本着权限明确、信息共享原则,与南京海泰医疗信息系统有限公司协作开发了临床试验管理系统,设置了7大管理模块和7个系统工作站(图 1),每个模块及工作站内分别设置相对应的功能菜单。机构办公室确认临床试验项目后,项目管理员负责做好项目编号、项目名称、对应期类别、承担专业组、申办单位等一系列的项目登记工作,药品管理员则在药物管理工作站中负责做好试验用药物相应的信息登记工作(图 2)。试验用药物信息化管理系统能根据临床试验方案需求,对临床研究药物从配送、药物发放、回收及药物有效期的监管等进行一系列动态管理。
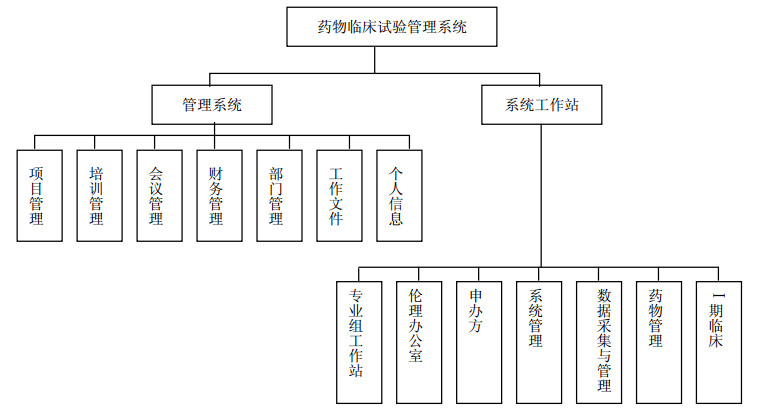
|
图 1 临床试验管理模块 Fig. 1 Clinical trial management module |
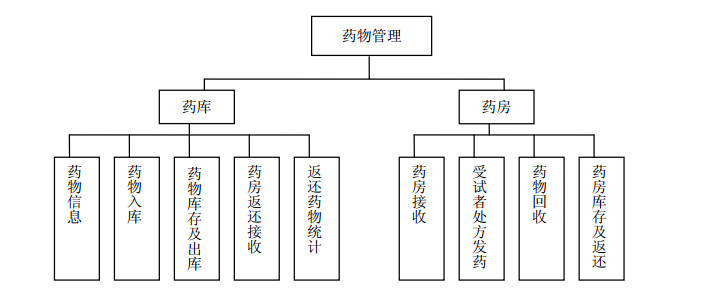
|
图 2 药物管理模块 Fig. 2 Drug management module |
3 规范试验用药物的管理流程
试验用药物流程管理的全过程均应严格遵循GCP原则,包括试验用药物的验收、入库、使用、返还、储存、保管等环节,均应制定相关管理制度和标准操作规程(SOP),以保证临床试验的质量。
3.1 试验用药物的验收与入库 3.1.1 验收申办方负责将试验用药物运送至医院GCP药房,药品管理员负责试验用药物的验收工作,只有把好试验用药物准入的第一道关口,整个试验才能有序的进行下去[10]。(1)检查药物的包装是否完好,标识是否清晰可辨;(2)内、外包装均需贴好标签,并注明“临床试验专用”;(3)核对药物的批号与申办方提供给机构备案的药检报告是否一致;(4)检查药物运输过程是否符合贮存要求,低温保存的药物还需查看冷链运输过程中的温度记录并存档保存。
3.1.2 入库登录药物管理系统,选择相应试验项目:(1)在“药库”系统中添加药物信息,包括药物名称(是否有编号)、药物类型(清洗期、试验用药、对症处理药物、试验结束后标准治疗药物、备用药、补救药物、基础药物)、药物剂型(注射剂、洗剂、丸剂、胶囊等其他剂型)、给药途径(口服、外用、肌肉注射、静脉注射、静脉滴注)、药物规格、研究中心编号、包装(完好、破损等)、运输方式(快递或随身携带)、储存条件、申办单位;(2)在药物入库信息栏中输入药物的批号、有效期、药物编码、单个编码入库数量(如有分包装,必须填写最小包装单位及数量)、制剂单位(片、袋、盒、mg、mL等),记录是否有药检报告、入库时间、接收人;(3)在药物出库信息栏中按照试验方案制定的进程将规定数量发往药房系统中;(4)在“药房”系统中选择该药物后点击接收确认。
3.2 试验用药物使用与返还 3.2.1 发放研究者在专业组工作站上选择相应的试验项目,系统将自动出现药物的相关信息,根据受试者入组先后情况开具药物处方,同时要求规范书写GCP专用纸质处方,签名盖章;药品管理员接到处方后,(1)核对纸质处方与电子处方上信息是否一致;(2)点击发药栏,确认受试者相关检查项目是否已完成,如该受试者未完成检查项目时,系统会出现“该受试者无化验结果,不可发药”的红色提示;(3)发药时,先核对填写药物编码、发放数量、领药人(及与受试者关系)。药品管理员应严格按照试验方案规定的用药时间窗发药,对于多个疗程的试验用药,每次发药时均应核对该受试者的相关发药信息。
3.2.2 回收由于试验用药物的特殊性,不论任何原因产生的剩余药物及其包装都应做统一回收,集中处理[11]。研究者(或受试者)将试验剩余药物(或空盒)退回GCP药房时,药品管理员应核对药物名称、编号、批号、数量,并在“药房”管理系统药物回收一栏中记录回收药物的数量、遗失量、回收时间等相关信息;试验结束后统一将药物返还至“药库”管理系统,为方便每月盘点统计药物的出入库数量,可在“返还药物统计”中下载药物信息为Excel表格。
3.3 试验用药物储存与保管临床试验用药物储存在GCP药房内,按各试验项目药物保存要求分柜按序摆放,标识明显;每天检查记录药房的温湿度情况,保证GCP药房环境的干燥通风;定期检查试验药物的发放情况及药物的有效期,发现异常情况及时与机构办公室项目管理员沟通汇报;每月清点核对GCP药房内所有药物的库存情况。临床试验中药房管理工作烦琐而细致,日常工作中除需实时记录药物的出入库情况外,药房的管理工作如温湿度记录、药物的清点记录等同样也需要大量的表单,耗费大量的时间与精力,为方便统计药物出入库的数量,信息管理系统中设置了下载药物信息为Excel表格的功能,方便了盘点统计;并能按设定要求自动统计,有效期临近药物会标红显示。因此电子信息化的应用极大改善了药品管理员工作强度,减轻了工作负担,并可对工作量进行精确量化统计,而最终实现办公信息的电子化、无纸化管理。
4 完善试验用药物管理的SOP和质量控制标准 4.1 试验用药物管理的SOP在临床试验用药物信息化管理实际运行中,对SOP需要不断的进行修订和完善,如药物的分发过程中需要研究者及时开具电子处方;药物的发放、使用、回收等登记应直接在电脑程序中完成并及时打印存档等。此外,因GCP药房内加装了电子温湿度监控和报警系统,24 h实时记录温湿度情况,出现超过预警标准时能及时短信通知管理员,故修订了相应的记录表单,新增了温湿度监控系统检定、使用SOP等。
4.2 试验用药物质量控制标准根据临床试验机构办公室的质控要求,在临床试验项目开展的同时,项目管理员应对试验药物的接收、保存、分发、使用、返还等各个环节的全过程进行定期的质量监查,发现问题及时与药品管理员沟通,以保证受试者用药的安全性及临床试验结果的可靠性。在实际工作中,发现比较突出的问题有试验进程中更新药物批号时药检报告归档不及时;剩余药物回收数量与实际回收量不匹配,且说明不清等。因此,不断完善SOP和质量控制标准,逐步形成规范化、标准化的操作流程,确保临床试验用药物的科学规范管理。
5 结语为保证药物临床试验质量,加强试验用药物规范化管理,建立临床试验用药库药房,专人、专职、集中管理模式等一套严格、规范、可操作性强的试验药物管理机制具有重要意义[12]。试验用药物的规范化管理在整个临床试验中起关键作用,而药物临床试验的信息化管理已成为临床试验的必然趋势。笔者所在的团队在临床试验药物信息化管理实际应用中发现并解决了一些存在的问题,进一步规范了试验用药品的管理方法及模式,并在GCP药房应用的基础上正逐步设计开发Ⅰ期临床试验专用药房的信息化管理模块。随着试验用药物的信息化管理系统的推行,不仅能规范整个药物临床试验的流程,也提高了临床试验的管理效率,从而提升临床试验整体管理水平,保证临床试验的质量,对构建规范化、科学化的临床试验用药物中心化管理具有重要的意义。
| [1] | 沈玉红, 张正付, 李正奇. 药物临床试验中试验药物管理存在的问题与对策[J]. 中国药房, 2011,22(22):2093–2094. |
| [2] | 药物临床试验质量管理规范[S]. 2003. |
| [3] | 国家食品药品监督管理局.药物临床试验机构资格认定检查细则(试行)[EB/OL]. (2014-09-05)[2016-04-17]. http://www.ccd.org.cn/ccdweb/kindeditor_file/1/file/1409908480.66.doc. |
| [4] | 丁倩, 曹彩. 我国药物临床试验信息化建设初探[J]. 中国新药杂志, 2012,21(7):722–727. |
| [5] | 刘韬, 王艺, 邓丽婷, 等. 我院临床试验用药品管理模式的构建[J]. 中国药房, 2015,26(34):4766–4769. |
| [6] | 程晓华, 杨茗钫, 刘丽忠, 等. 临床试验中试验用用药品的管理模式探讨[J]. 医药导报, 2013,32(5):692–693. |
| [7] | 孙成春, 李朝武, 董玉波, 等. 我院临床试验用药品的管理体会[J]. 中国药房, 2013,24(17):1573–1575. |
| [8] | 陈燕銮, 林忠晓, 蒋发烨, 等. 我院临床试验用药品信息化管理平台的构建与应用[J]. 中国药房, 2014,25(29):2699–2701. |
| [9] | 徐帆, 徐贵丽, 李浩瑜, 等. 药物临床试验电子化数据采集管理系统的设计与应用[J]. 中国药房, 2010,21(41):3860–3862. |
| [10] | 肖妤, 曾代文, 严晓梁, 等. 由我国临床试验用药物管理存在的问题引发的思考[J]. 实用医院临床杂志, 2012,9(1):167–169. |
| [11] | 倪天庆, 胡思源, 钟成梁. 加强临床试验用药品的管理[J]. 药物评价研究, 2013,36(6):482–484. |
| [12] | 王菊勇, 刘涛, 陈潮, 等. 药物信息化管理系统在临床试验中的应用[J]. 中国临床药理学与治疗学, 2015,20(9):1008–1010. |
 2016, Vol. 39
2016, Vol. 39


