2. 浙江泛亚生物医药股份有限公司, 浙江 平湖 314200
2. Zhejiang Bioasia Pharmaceutical Co., Ltd, Zhejiang 314200, China
蝉花(Cordyceps cicadae)又名蝉茸、蝉草等,是蝉拟青霉(Paecilomyces cicadae)等真菌寄生于一些蝉若虫后形成的菌虫复合体,其无性型为蝉棒束孢,是我国传统中药材[1-4]。蝉花药用功效始载于南北朝刘宋时代的《雷公炮炙论》,对蝉花加工云:“蝉花,凡使要白花全者,收得后于屋下东南角悬干,去甲土后,用浆水煮一日至夜,焙干碾细用之”。唐慎微所著《证类本草》言“蝉花味甘寒,无毒,主小儿天吊,惊痫,瘛,夜啼,心悸”。
随着人民对医疗保健的逐步重视,蝉花特殊药用功能逐步凸显且越来越引起医药工作者的关注,对蝉花的需求也大大提高。与此同时,关于蝉花的人工培育及其培养物的化学成分研究也成为医药学界研究的重点[5]。目前对于蝉花成分的研究主要集中在人工蝉花的营养成分及微量元素上[6-7],对其活性成分的综合分析以及培养基质对活性成分的影响未见报道。因此,本实验以人工蝉花培养物的4种核苷类代表性成分为指标,建立同时测定4种成分的分析方法,考察不同斜面及固体培养基对4种核苷类成分的影响,以期为人工蝉花培养工艺的优化及针对性的药物开发奠定基础。
1 材料 1.1 主要仪器Waters 1525二元泵、2998 PDA检测器、2707自动进样器(美国沃特世科技有限公司);Sartorius CPA225D电子分析天平(赛多利斯有限公司);KQ-500E型数控超声波清洗器(昆山市超声仪器有限公司);RT-01型粉碎机(浙江温岭市大海药材器械厂);Milli-Q超纯水系统(默克密理博科技有限公司)。
1.2 主要试剂人工蝉花培养物供试品(批号20140408,浙江泛亚生物医药股份有限公司);尿苷对照品(批号130613,质量分数≥98%)、鸟苷对照品(批号130807,质量分数≥98%)、腺苷对照品(批号130721,质量分数≥98%)、N6-(2-羟乙基)腺苷(批号20140312,质量分数≥98%),均购于四川维克奇生物科技有限公司;甲醇(色谱纯,美国Tedia公司)。
2 方法与结果 2.1 对照品溶液的制备分别精密称取尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷对照品适量,置25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得含102.0 μg/mL尿苷、101.6 μg/mL鸟苷、93.6 μg/mL腺苷、175.0 μg/mL N6-(2-羟乙基)腺苷的对照品溶液。
2.2 供试品溶液的制备取供试品粉末约0.2 g,精密称定,置具塞试管中,精密加入10%甲醇5 mL,称定质量,超声30 min,再次称定质量,10%甲醇补足减失的质量,震荡,摇匀,静置5 min取上清液,过0.22 μm的微孔滤膜,即得供试品溶液。
2.3 高效液相(HPLC)色谱条件及专属性考察Waters Symmetry hield TMRP C18(250 mm×4.6 mm,5 μm);流动相为:水(A)-甲醇(B);梯度洗脱程序为:0~12 min,2%B;12~25 min,2%~15%B;25~30 min,15%~20%B;30~35 min,20%~35%B;35~40 min,35%~35%B;40~42 min,35%~2%B;42~52 min,2%B;柱温30 ℃;体积流量1.0 mL/min;检测波长260 nm;进样量10 μL。按此色谱条件检测对照品溶液、供试品溶液与阴性对照溶液(除不加入供试品外,其余操作同“2.2”项),供试品中尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷与其他色谱峰均分离良好,峰形对称,结果见图 1。
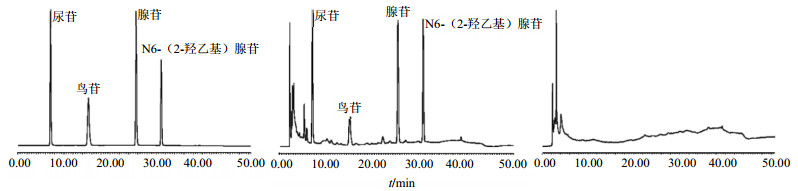
|
图 1 对照品溶液(A)、供试品溶液(B)、阴性对照溶液(C)HPLC色谱图 Fig. 1 HPLC chromatogram of references (A), test sample (B), and negative samples (C) |
2.4 耐用性试验
取蝉花培养物供试品约0.2 g,精密称定,按“2.2”项下方法制备供试品溶液,分别采用CAPCELL PAK C18MG II S5、YMC-Pack ODS-A、InertSustain C18 3种品牌的色谱柱(250 mm×4.6 mm,5 μm),按“2.3”项下色谱条件对尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷进行测定,结果无明显差别,表明系统耐用性良好。
2.5 线性关系考察精密称取4种对照品适量,加甲醇稀释,分别配制成质量浓度为12.4、24.8、37.2、49.6、62.0、74.4、86.8、99.2、111.6、124.0、136.4、148.8 μg/mL的尿苷对照品溶液;质量浓度为10.8、21.6、32.4、43.2、54.0、64.8、75.6、86.4、97.2、108.0、118.8、129.6 μg/mL的鸟苷对照品溶液;质量浓度为10.8、21.6、32.4、43.2、54.0、64.8、75.6、86.4、97.2、108.0、118.8、129.6 μg/mL的腺苷对照品溶液;质量浓度为6.8、13.6、20.4、27.2、34.0、40.8、47.6、54.4、61.2、68.0、74.8、81.6 μg/mL的N6-(2-羟乙基)腺苷对照品溶液,各精密进样10 μL,按“2.3”项下色谱条件测定峰面积。以峰面积为纵坐标,质量浓度为横坐标,计算得的线性回归方程如表 1所示。结果表明,在线性范围内线性关系良好。
| 表 1 4种核苷类成分的线性方程 Table 1 Linear equations of four kinds of nucleosides |
2.6 精密度试验
精密吸取尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷对照品溶液适量,按“2.3”项下色谱条件,重复进样6次,测定峰面积,计算RSD。尿苷、尿苷、腺苷、N6-(2-羟乙基)腺苷的RSD值分别为0.49%、0.52%、0.23%、0.24%(n=6),表明实验精密度良好。
2.7 稳定性试验取“2.2”项下供试品溶液,于0、2、4、8、12、24、36 h测定峰面积,尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷的RSD值分别为1.77%、0.71%、0.35%、0.42%(n=6),结果表明供试品溶液在36 h内稳定。
2.8 重复性试验取蝉花培养物供试品适量,精密称定,平行6份,按“2.2”项下方法制备成供试品溶液,测定峰面积,分别计算尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷的量,结果其RSD值分别为0.79%、0.75%、0.47%、0.22%(n=6),表明实验具有可重复性。
2.9 加样回收率试验取已知尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷质量浓度的蝉花培养物供试品约0.2 g,其中尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷的质量浓度分别为3.10、1.30、1.75、1.20 mg/g,平行6份,分别精密加入尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷对照品0.62、0.26、0.35、0.24 mg(按《中国药典》2015年版四部9101项下的数据要求操作[8],对照品加入量:供试品成分量=1:1),按“2.2”项下方法进行处理,按“2.3”项下色谱条件进样测定,测得量代入“2.5”项下线性方程中,计算回收率。显示结果在线性范围内,平均回收率在99%~101%之间,尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷的RSD值分别为0.78%、2.04%、1.45%、2.02%(n=6),符合检测要求。
2.10 样品测定蝉花培养物是蝉花斜面菌种利用固液发酵方式培养25 d得到的固体培养物。因此,本实验将斜面培养基——假单胞菌选择培养基(PSA)、沙氏葡萄糖琼脂培养基(SDAY,1 000 mL的SDAY-1、SDAY-2、SDAY-3培养基中含有的葡萄糖量分别为20、30、40 g)发酵得到的菌种,进行固液发酵培养,使用的固体培养基为江苏农垦(SCM),得到的蝉花培养物分别标记为PSA、SDAY-1、SDAY-2、SDAY-3;同时,斜面培养基设定为PSA,分别使用SCM、烟农24、烟农15和济麦22等品种的小麦作为固体培养基,得到的蝉花培养物分别标记为SCM、YN-24、YN-15、JM-22。精密称取不同培养基得到的蝉花培养物样品,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件测定,代入“2.5”项下线性方程计算各样品中尿苷、鸟苷、腺苷、N6-(2-羟乙基)腺苷的水平,结果见图 2、3。
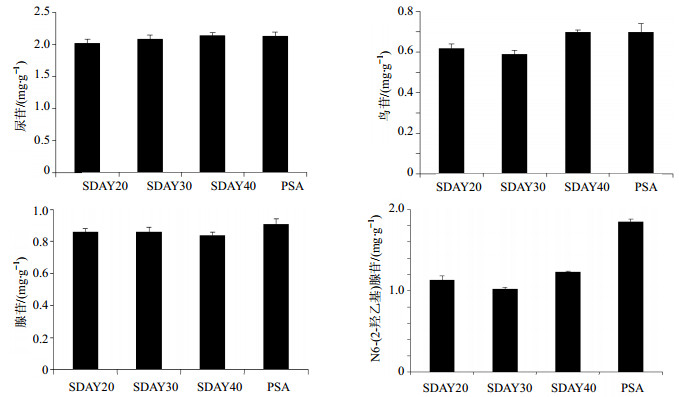
|
图 2 不同斜面培养基对4种核苷类成分的影响 Fig. 2 Effect of different slant medium on four kinds of nucleosides |
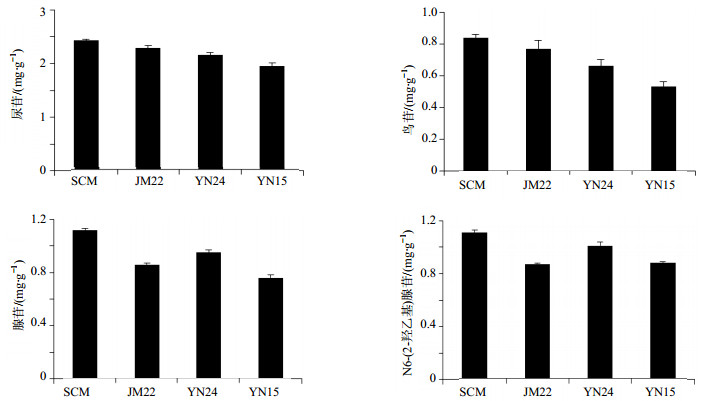
|
图 3 不同固体培养基对4种核苷类成分的影响 Fig. 3 Effect of different solid medium on four kinds of nucleosides |
3 数据分析 3.1 斜面培养基对核苷类成分的影响分析
对图 2所示的测定结果,通过SPSS 16.0软件进行多组别间两两比较统计分析及主体间效应检验,验证5种不同的斜面培养基对4种核苷类成分及总水平的影响。结果见表 2~11。
| 表 2 不同的斜面培养基对蝉花培养物中尿苷的影响-统计学分析表 Table 2 Statistical analysis on effect of different slant medium on uridine in C. cicadae culture |
| 表 3 不同斜面培养基尿苷水平组别间两两比较 Table 3 Pairwise comparison on uridine content among different slant medium groups |
| 表 4 不同的斜面培养基对蝉花培养物中鸟苷的影响-统计学分析表 Table 4 Statistical analysis on effect of different slant medium on guanosine in C. cicadae culture |
| 表 5 不同斜面培养基鸟苷水平组别间两两比较 Table 5 Pairwise comparison on guanosine content among different slant medium groups |
| 表 6 不同的斜面培养基对蝉花培养物中腺苷的影响-统计学分析表 Table 6 Statistical analysis on effect of different slant medium on adenosine in C. cicadae culture |
| 表 7 不同斜面培养基腺苷水平组别间两两比较 Table 7 Pairwise comparison on adenosine content among different slant medium groups |
| 表 8 不同斜面培养基对蝉花培养物中N6-(2-羟乙基)腺苷的影响-统计学分析表 Table 8 Statistical analysis on effect of different slant medium on N6-(2-hydroxyethyl) adenosine in C. cicadae culture |
| 表 9 不同斜面培养基N6-(2-羟乙基)腺苷水平组别间两两比较 Table 9 Pairwise comparison on N6-(2-hydroxyethyl) adenosine content among different slant medium groups |
| 表 10 不同的斜面培养基对蝉花培养物中4种核苷类总水平的影响-统计学分析表 Table 10 Statistical analysis on effect of different slant medium on four kinds of nucleoside levels in C. cicadae culture |
| 表 11 不同斜面培养基4种核苷类总水平组别间两两比较 Table 11 Pairwise comparison on four kinds of nucleoside levels among different slant medium groups |
结果表明,固体培养基相同而斜面培养基不同对4种核苷类成分的影响不同,对于尿苷而言,4种不同斜面培养基对其成分的变化基本无影响(P > 0.05);与其他培养基比较,PSA对腺苷和鸟苷的成分水平有明显的促进作用(P < 0.05);就成分N6-(2-羟乙基)腺苷而言,4种斜面培养基组别间差异显著(P < 0.05),PSA促进作用最显著。对4种核苷成分的总量分析表明,当氮源比例固定时(SDAY),碳源的比例(SDAY 20、30、40)的改变对其水平影响较大,而其中PSA较SDAY斜面培养基存在明显差异(P < 0.05),有明显的促进作用。
3.2 固体培养基对图 3所示的测定结果,通过SPSS 16.0软件进行多组别间两两比较统计分析及主体间效应检验,验证3种不同的固体培养基对4种核苷类成分及总水平的影响。结果见表 12~21。
| 表 12 不同固体培养基对蝉花培养物中尿苷的影响-统计学分析表 Table 12 Statistical analysis on effect of different solid medium on uridine in C. cicadae culture |
| 表 13 不同固体培养基尿苷水平组别间两两比较 Table 13 Pairwise comparison on uridine content among different solid medium groups |
| 表 14 不同固体培养基对蝉花培养物中鸟苷的影响-统计学分析表 Table 14 Statistical analysis on effect of different solid medium on guanosine in C. cicadae culture |
| 表 15 不同固体培养基鸟苷水平组别间两两比较 Table 15 Pairwise comparison on guanosine content among different solid medium groups |
| 表 16 不同固体培养基对蝉花培养物中腺苷的影响-统计学分析表 Table 16 Statistical analysis on effect of different solid medium on adenosine in C. cicadae culture |
| 表 17 不同固体培养基腺苷水平组别间两两比较 Table 17 Pairwise comparison on adenosine content among different solid medium groups |
| 表 18 不同固体培养基对蝉花培养物中N6-(2-羟乙基)腺苷的影响-统计学分析表 Table 18 Statistical analysis on effect of different solid medium on N6-(2-hydroxyethyl) adenosine in C. cicadae culture |
| 表 19 不同固体培养基N6-(2-羟乙基)腺苷水平组别间两两比较 Table 19 Pairwise comparison on N6-(2-hydroxyethyl) adenosine content among different solid medium groups |
| 表 20 不同固体培养基4种核苷类成分总水平主体间效应检验 Table 20 Statistical analysis on effect of different solid medium on four kinds of nucleoside levels in C. cicadae culture |
| 表 21 不同固体培养基4种核苷类成分总水平组别间两两比较 Table 21 Pairwise comparison on four kinds of nucleoside levels among different solid medium groups |
结果表明,斜面培养基相同固体培养基不同对4种核苷类成分的影响不同(P < 0.05),而其中SCM培养的蝉花培养物4种核酸类成分水平均为最高。
4 讨论核苷和核苷酸通过多种形式和途径调控机体各种生理过程[9-17]。其除具有调节机体免疫功能、参与代谢、抗菌和抗病毒等作用外,对肝脏、心血管及神经系统的疾病亦有治疗作用。而当内源性核苷不能满足机体发挥正常生理功能所需的最低量时,外源性核苷酸及核苷的及时补充尤为重要和必要。蝉花虫草中含有丰富的核苷类成分,是一种纯天然的核苷补充剂,在治疗疾病和改善人体的免疫系统和调节生理功能上发挥积极和重要的作用[18-25]。因此,本实验对蝉花人工培养物中的4种核苷类成分进行了分析比较,以期为蝉花人工培养物的进一步研究开发提供数据支撑。
本实验建立了同时检测蝉花虫草中4种核苷类成分的HPLC方法,该方法简便、快速、干扰少、方法精密度好、准确度高、各成分的线性关系明显、线性范围较宽。该方法不仅适用于蝉花中4种核苷类成分的同时测定和定量分析,也为蝉花虫草生产过程中的质量控制提供了必要的条件。
本实验结果表明,固体培养基相同而斜面培养基不同的条件下对4种核苷类成分的影响趋势不同,对于尿苷而言,4种不同的斜面培养基对其成分的变化基本无影响,说明蝉花虫草合成尿苷成分的过程中对斜面培养基中碳源及氮源的水平及比例要求不高。而其中PSA对腺苷和鸟苷的成分水平有明显的促进作用,说明腺苷和鸟苷成分的合成对斜面培养基而言具有明显的选择性;而就成分N6-(2-羟乙基)腺苷而言,4种斜面培养基对其水平影响较大,组别间差异显著。首先可以证实,葡萄糖的比例(碳源)是影响N6-(2-羟乙基)腺苷水平变化的一个主要因素,但统计结果也同样显示N6-(2-羟乙基)腺苷并没有随着葡萄糖比例的加大成分而逐渐升高,说明N6-(2-羟乙基)腺苷合成虽与葡萄糖比例有关但并没有比例依赖关系。而4种培养基中PSA培养基的最终培养物中N6-(2-羟乙基)腺苷水平最高,说明碳源和氮源的比例对该成分的形成影响较大,对于碳源与碳源的提供来源是否直接影响该成分的水平有待于进一步研究。
不同斜面培养基对腺苷和N6-(2-羟乙基)腺苷影响的统计结果不难看出,SDAY培养基对两种成分的影响趋势相反,推测腺苷可能是N6-(2-羟乙基)腺苷形成过程的前体成分,参与了N6-(2-羟乙基)腺苷的形成,而从成分结构上也不难证实,N6-(2-羟乙基)腺苷是以腺苷为母核结构配合羟乙基而形成。
对于4种核苷成分的总量分析,统计结果表明,当氮源比例固定时(SDAY),一定程度上碳源的比例(SDAY 20、30、40)对核苷类成分的水平影响较大,而其中PSA较SDAY斜面培养基存在明显差异,说明碳源与氮源两者的比例关系也是影响核苷成分合成的又一重要因素。
确定了斜面培养基(PSA)后,本实验又进行了4种不同的固体培养基的考察。实验结果表明,不同固体培养基对4种核苷类成分的影响趋势不尽相同,其中SCM培养的蝉花培养物4种核酸类成分水平最高。推测虽然一定程度上固体培养基的组成对蝉花虫草的生长和次生代谢产物的形成起着至关重要的作用,但当固体培养基中组成固定时,成分的结构比例对成分的形成影响较大。本实验所用的固体培养基均为小麦,其成分主体结构相同,因产地及品种的差异导致其营养成分的组成比例(碳源、氮源)存在差异,而这种差异又最终从微观成分的角度上有所体现,各成分之间在形成过程中是否存在着直接相关或交互作用,本课题组会在进一步实验中加以证明。
本实验主要针对斜面培养基及固体培养基对核苷类4种成分的影响进行了较为系统的研究。活性成分作为蝉花发挥药理效应的基础与药效学直接相关。前期的实验已经明确证实,除含有核苷类成分以外,蝉花虫草还外富含多糖、虫草酸、麦角甾醇等多种活性物质及微量元素。是否不同培养基在其他类别成分的实验中也有着不同的体现?各成分在形成过程中的相关性及机制又有何种表现形式?本课题组会在进一步的研究中逐一揭示,本实验研究不仅对于蝉花虫草的培养工艺改进,而且对于针对性的药物开发也具有十分重要的意义。
| [1] | 张红霞, 高新华, 陈伟, 等. 人工培育蝉花与天然蝉花中化学成分的比较[J]. 食用菌学报, 2012,19(3):59–62. |
| [2] | 彭凡, 李春如, 耿德贵. 传统中药蝉花退化菌种虫体复壮的初步研究[J]. 安徽农业大学学报, 2014,41(2):1–5. |
| [3] | 王琪, 刘作易. 药用真菌蝉花的研究进展[J]. 中草药, 2004,34(4):469–471. |
| [4] | 王琼, 王春雷, 何福根, 等. 地方药材金蝉花的研究进展[J]. 肿瘤学杂志, 2013,19(3):227–230. |
| [5] | 陈安徽, 陈宏伟, 徐洋, 等. 蝉花虫草中核苷类成分的分离纯化和鉴定[J]. 食品科学, 2013,34(1):131–134. |
| [6] | 于士军, 柴新义, 樊美珍. 蝉花菌质主要营养成分和活性成分分析[J]. 食品与机械, 2015,31(1):155–158. |
| [7] | 卫亚丽, 杨茂发, 刘爱英. 蝉花中脂肪酸成分和含量的分析[J]. 食品工业科技, 2014,35(5):303–305. |
| [8] | 中国药典[S].四部. 2015. |
| [9] | Clare M H. Functional Foods:their role in disease prevention and health promotion[J]. Food Technol, 1998, 52(11):63–70. |
| [10] | Shahidi F. Functional foods:their role in health promotion and disease prevention[J]. J Food Sci, 2004, 69(5):146–149. |
| [11] | Yamamoto S, Wang M F, Adjei A A, et al. Role of nucleosides and nucleotides in the immune system, gut reparation after injury, and brain function[J]. Nutrition, 1997, 13(4):372–374. doi:10.1016/S0899-9007(97)83066-3 |
| [12] | Carver J D, Walker W A. The role of nucleotides in human nutrition[J]. Nutr Biochem, 1995, 6(2):58–72. doi:10.1016/0955-2863(94)00019-I |
| [13] | Ralevic V, Burnstock G. Receptor for purines and pyrimidines[J]. Pharmacol Rev, 1998, 50(3):413–492. |
| [14] | Jacobson K A, Jarvis M F, Williams M. Purine and pyrimidine (P2) receptors as drug targets[J]. Med Chem, 2002, 45(19):4057–4093. doi:10.1021/jm020046y |
| [15] | Yamasa S K K. Agents for improvement of emotional disturbance due to anxiety or depression, contain nucleotide (s)[P]. Japan:JP334487B2, 2002-11-11. |
| [16] | LEE S J, KIM K J, LEE C K, et al. Composition containing cordycepin as active component for treatment and prevention of diabetes[P]. Korea:KR2005063164-A, 2005-06-28//Korea:KR583194-B, 2006-05-24. |
| [17] | 温鲁, 唐玉玲, 张平. 蝉花与有关虫草活性成份检测比较[J]. 江苏中医药, 2006,27(1):45–46. |
| [18] | 刘森琴, 温鲁, 夏敏. 人工培育蝉花的活性成分含量测定[J]. 安徽农业科学, 2008,36(2):465–467. |
| [19] | 宋玉良, 宋捷民, 严建伟. 高效液相色谱法测定蝉花中腺苷的含量[J]. 中药新药与临床药理, 2000,11(6):367. |
| [20] | 李瑞雪, 汪泰初, 胡飞, 等. 蝉拟青霉中虫草素提取工艺研究[J]. 食品科技, 2013,38(2):218–220. |
| [21] | 李瑞雪, 胡飞, 陈安徽, 等. 蝉拟青霉高产虫草素菌株液体培养工艺的研究[J]. 徐州工程学院学报, 2007,22(10):23–29. |
| [22] | 蔡有华, 刘学铭. 虫草素的研究与开发进展[J]. 中草药, 2007,38(8):1269–1272. |
| [23] | 柴一秋, 韦忠民, 陈祝安, 等.从蝉拟青霉培养物中提取N6-(2-羟乙基)腺苷的方法[P].中国:1827633A, 2006-09-06. |
| [24] | Tsmomu F, Masao H, M Matsuzawa, et al. N6-(2-hydroxyethyl)-adenosine, abiologically active compound from cultured mycelia of Cordyceps and Isada Species[J]. Phytochem, 1983, 22(11):2509–2512. doi:10.1016/0031-9422(83)80150-2 |
| [25] | 陈安徽, 陈宏伟, 徐洋, 等. 蝉花虫草中核苷类成分的分离纯化和鉴定[J]. 食品科学, 2013,34(1):131–133. |
 2016, Vol. 39
2016, Vol. 39



