2. 辽宁新中现代医药有限公司, 辽宁 沈阳 110041;
3. 沈阳药科大学, 辽宁 沈阳 110016;
4. 基于靶点药物设计与研究教育部药物重点实验室, 辽宁 沈阳 110016
2. Liao ning Xin zhong Modern Pharmaceutical Company, Shenyang 110041, China ;
3. School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China ;
4. Key Laboratory of Structure-based Drug Design and Discovery, Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China
人参Panax ginseng C. A. Mey在亚洲拥有数千年的用药历史,具有大补元气、补脾益肺、生津止渴、安神增智等功效。现代药理学研究表明,人参中的主要成分为人参皂苷,人参皂苷具有降血糖、抗肿瘤、抗炎、抗氧化和抑制细胞凋亡等药理活性[1-2]。人参根中主要含有的皂苷为三醇型人参皂苷,如人参皂苷Re、Rg1、Rh1等。临床资料显示,与其他具有降糖功能的中药相比,人参是被研究得最多的一种中药材[3]。Xie[4]用ob/ob小鼠为模型,连续腹腔给药12 d,结果证实人参皂苷Re可以明显降低小鼠的血糖水平,提高葡萄糖耐受能力。有研究表明[5],人参皂苷Rb1能够促进C2C12骨骼肌细胞和3T3-L1脂肪细胞对葡萄糖的利用;人参总皂苷及人参皂苷Rb1、Rg1、Rg3、Re、Rh1对α-葡萄糖苷酶均有显著的抑制作用,且强于阳性对照阿卡波糖3~10倍[6]。Han[7]发现人参皂苷代谢物之一20S-原人参三醇(PPT)能够增加PPARγ转录活性,表明PPT可被用作PPARγ激动剂,能够改善糖尿病相关的胰岛素抵抗。叶银[8]将3T3-L1脂肪细胞在胰岛素和人参皂苷Rg1共培养的情况下,胰岛素呈剂量相关性降低3T3-L1脂肪细胞脂联素mRNA表达,从而表明人参皂苷Rg1能够促进脂肪组织的生成,进而促进脂肪对周围环境中葡萄糖的摄入和消耗,从而达到降糖作用。
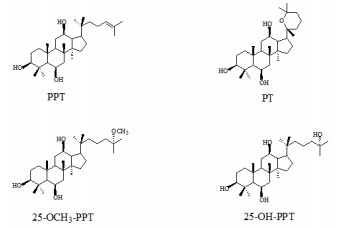
本课题组前期有关人参皂苷类成分抗肿瘤活性的构效关系研究结果表明,人参皂苷元的活性大于皂苷。25-OH-PPT和25-OCH3-PPT是本课题组首次从人参茎叶和人参果中发现的三醇型人参皂苷元(图 1)[9-10],它们的降血糖活性及与PPT、PT(图 1)、人参皂苷Rg1活性比较和构效关系分析未见研究。同样对25-OH-PPT、25-OCH3-PPT、PPT、PT的HPLC/ELSD同步检测也未见报道。
|
图 1 4种人参皂苷元的结构 Fig. 1 Chemical structures of four ginseng sapogenins |
1 HPLC/ELSD法同时测定25-OH-PPT、25-OCH3-PPT、PPT、PT 1.1 材料
人参根总皂苷(辽宁抚顺鑫田人参保健品有限公司,批号GL130412)。水解制备参考文献方法[11]。
1.2 器材和试剂K-501液相色谱仪(德国诺尔公司);UM-3000蒸发光检测器(上海通威公司);XWK-34空气压缩机(天津华生分析仪器有限公司);JS-3050色谱工作站(大连江申)。人参皂苷元25-OH-PPT[9]、25-OCH3-PPT[10]、PPT[12]和PT[13]实验室自制,纯度分别为99.23%、99.36%、99.16%和99.03%。甲醇(HPLC级试剂);实验用水为二次蒸馏水;其他试剂均为分析纯。
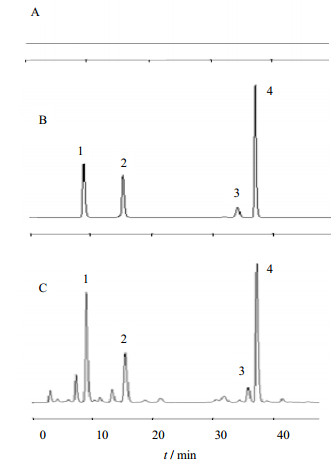
1.3 方法和结果 1.3.1 色谱条件色谱柱Kromasil C18(150 mm×4.5 mm,5μm),进样体积20 μL,柱温25 ℃,体积流量1.0 mL/min;流动相为甲醇(A)-H2O(B),梯度洗脱程序:0~30 min,70% A;30~63 min,80%;ELSD气化室温度50 ℃,载气体积流量3 L/min,空白溶剂、所得混标色谱图与人参根酸水解产物色谱图见图 2。
|
1-25-OH-PPT; 2-25-OCH3-PPT; 3-PPT; 4-PT 图 2 空白溶剂(A)、混合对照品(B)及样品(C)HPLC/ELSD色谱图 Fig. 2 HPLC/ELSD of blank solvent (A), mixed references (B), and samples (C) |
1.3.2 标准品溶液的配置
精确称取4种对照品25-OH-PPT、25-OCH3-PPT、PPT、PT各1.0 mg,将其置于1 mL量瓶中用甲醇定容,得到质量浓度分别为1.0、1.0、1.0、1.0 mg/mL混和对照品储备液。
1.3.3 供试品溶液的制备精确称取人参根皂苷酸水解产物10 mg,将其置于1 mL量瓶中用甲醇定容,得到质量浓度为10 mg/mL供试品储备液,过0.45 μm滤膜备用。
1.3.4 标准曲线分别取上述配好的混和对照品储备液稀释得到一系列不同浓度混和对照品操作溶液。进样量20 μL,以样品质量浓度(C)为横坐标,以峰面积(A)为纵坐标作线性回归,4种人参皂苷在所配标准溶液的质量浓度在0.05~1.0 mg/mL与峰面积线性关系良好,线性回归方程见表 1。
| 表 1 4种皂苷元的标准曲线 Table 1 Calibration curves of sapogenins |
1.3.5 精密度实验
精密吸取含4种对照品25-OH-PPT、25-OCH3-PPT、PPT、PT储备液20 μL,1 d内连续进样6次,其日内精密度RSD分别为1.62%、1.92%、1.86%和1.57%。
1.3.6 稳定性实验精确吸取人参根供试品溶液20 μL,分别在0、2、4、6、8 h用高效液相色谱进行测定,计算各峰的峰面积,各皂苷的RSD分别为1.69%、2.85%、2.39%、0.36%。
1.3.7 重复性实验精密称取人参根酸水解产物6份,按“1.3.3”项下方法制备供试品溶液,分别测定6份样品中4个皂苷的量,其RSD分别为1.57%、2.48%、2.19%和0.36%。
1.3.8 回收率实验25-OH-PPT、25-OCH3-PPT、PPT、PT实验所得回收率分别为95.0%、98.4%、103.3%、96.0%,RSD在1.05%~2.15%。
1.3.9 样品分析取样品按照“1.3.3”项下方法平行制备3份供试品溶液,采用外标法计算,测定的样品中25-OH-PPT、25-OCH3-PPT、PPT、PT的量分别为(8.07±0.02)%、(4.55±0.06)%、(1.46±0.22)%、(4.53±0.62)%。
2 酶活性实验 2.1 材料人参皂苷元25-OH-PPT[9]、25-CH3-PPT[10]、PPT[12]和PT[13]实验室自制,质量分数分别为99.23%、99.36%、99.16%和99.03%。阿卡波糖(德国拜耳公司,批号H19990205)。
2.2 方法精密称取25-OH-PPT、25-OCH3-PPT、PPT、PT和Rg1等5种稀有人参皂苷和阿卡波糖,用50% DMSO溶解后配成质量浓度为10 mg/mL的标准液。用50% DMSO逐级稀释成质量分数为5.00、2.50、1.25、0.62、0.31 mg/mL的样品溶液,待用。
活性实验方法主要参考文献方法[14-15]并进行适当修改,以对硝基苯-β-D-吡喃葡萄糖苷(PNPG)为反应底物,其原理为通过检测PNPG与α-葡萄糖苷酶反应生成的黄绿色对硝基苯酚(PNP)溶液的吸光度(A)来判断样品抑制活性。取PNPG(50 mmol/L)150 μL加入800 μL磷酸二氢钾缓冲液(pH 7.0),再加入20 μL样品溶液,空白对照用50% DMSO代替。37 ℃孵化5 min后,加入α-葡萄糖苷酶(2.0 U/mL)30 μL,再次孵化30 min,加2 mL碳酸钠缓冲液(pH 6.9)结束反应。将各样品分别取150 μL转入96孔板,405 nm下测定A值,计算抑制率。
抑制率=(空白组A值-测试样品A值)/空白组A值
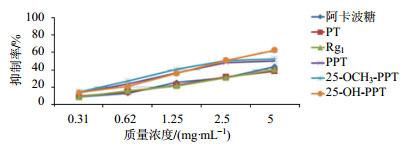
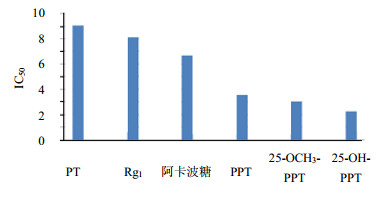
2.3 结果不同质量浓度样品对α-葡萄糖苷酶抑制活性见图 3、4,25-OCH3-PPT、25-OH-PPT和PPT对α-葡萄糖苷酶的抑制活性明显强于阿卡波糖,而人参皂苷Rg1和PT对α-葡萄糖苷酶均表现出一定的抑制活性,且它们抑制活性均呈质量浓度相关关系,当质量浓度大于2.50 mg/mL时,其抑制活性的增长趋势趋于平缓。通过比较线下面积和半抑制质量浓度可知,5种稀有皂苷和阿卡波糖对α-葡萄糖苷酶的抑制能力为:25-OH-PPT > 25-OCH3-PPT > PPT > 阿卡波糖 > Rg1 > PT。
|
图 3 5种人参皂苷对α-葡萄糖苷酶的抑制活性 Fig. 3 Inhibitiory activities of five kinds of rare ginsenosides on α-glucosidase |
|
图 4 5种稀有人参皂苷与阿卡波糖对α-葡萄糖苷酶的IC50 Fig. 4 IC50 values of five kinds of rare ginsenosides and acarbose on α-glucosidase |
3 讨论
人参皂苷的活性成分作为一种潜在的降血糖药物一直受到人们的关注,人参皂苷25-OH-PPT、25-OCH3-PPT、PPT、PT都是来自于人参根酸水解产物的降血糖活性成分。现代药理学研究发现,对α-葡萄糖苷酶的抑制可以有效缓解2型糖尿病患者餐后的高血糖症状。西方医学通过化学合成法寻找α-葡萄糖苷酶抑制剂取得了一定进展[16-17],而寻找安全、有效的天然α-葡萄糖苷酶抑制剂更是备受关注[18-21]。本研究通过测定以上4种人参皂苷元α-葡萄糖苷酶的抑制活性,发现作用强于阿卡波糖的25-OH-PPT和其类似物。利用HPLC-ELSD测定没有紫外吸收的人参皂苷元显示出快速、准确、简便等特点。上述结果表明为人参降血糖创新药物和保健食品的研发提供了科学依据。
| [1] | 何道同, 王兵, 陈珺明. 人参皂苷药理作用研究进展[J]. 辽宁中医药大学学报, 2012,07:118–121. |
| [2] | 赵琛, 苏光悦, 赵余庆. 人参皂苷及其衍生物抗结肠癌作用及机制的研究进展[J]. 中草药, 2015,46(16):2477–2483. |
| [3] | Vuksana V, Sievenpipera J L. Herbal remedies in the management of diabetes:Lessons learned from the study of ginseng[J]. Nutr MeTable Cardiovasc Dis, 2005, 15:149–1601. doi:10.1016/j.numecd.2005.05.001 |
| [4] | Xie J T, Mehendale S R, Li X M, et al. Anti-diabeticeffect of ginsenoside Re in ob/ob mice[J]. Biochimica et Biophysica Acta, 2005, 1740:319–325. doi:10.1016/j.bbadis.2004.10.010 |
| [5] | Shang W. Ginsenoside Rb1 stimulates glucose uptake through insulin-like signaling pathway in 3T3-L1 adipocytes[J]. J Endocrinol, 2008, 198(3):561–569. doi:10.1677/JOE-08-0104 |
| [6] | 宋纯清.人参皂苷类成分在制备抑制α-葡萄糖苷酶活性药物上的应用[P].中国:CN200910194673, 2011-09-5. |
| [7] | Han K L, Jung M H. Ginsenoside 20S-protopanaxatriol (PPT) actvates peroxisome proliferator-activated receptorgamma (PPARgamma) in 3T3-L1 adipocytes[J]. Biol Pharm Bull, 2006, 29(1):110. doi:10.1248/bpb.29.110 |
| [8] | 叶银.体外胰岛素和人参皂甙Rg1对3T3-L1脂肪细胞脂联素mRNA表达的影响[D].杭州:浙江大学, 2005. |
| [9] | 赵余庆, 袁昌鲁, 傅玉琴, 等. 人参茎叶中微量三萜化合物的化学研究[J]. 药学学报, 1990,25(4):299–301. |
| [10] | Zhao J M, Li N, Zhang H, et al. Novel dammaranetype sapogenins from Panax ginseng berry and their biological activities[J]. Bioorg Med Chem Lett, 2011, 21:1027–1031. doi:10.1016/j.bmcl.2010.12.035 |
| [11] | 陈业高, 吕瑜平, 桂世鸿. 三七叶甙制备原人参二醇及其差向异构体[J]. 精细化工, 2003,20(7):425–426. |
| [12] | 于明, 赵余庆. 人参果中三萜类成分的化学研究[J]. 中草药, 2004,11(35):1221–1223. |
| [13] | 王丹, 柴瑞华, 赵余庆. 人参果总皂苷水解产物中稀有活性皂苷元化学研究[J]. 中国现代中药, 2008,10(1):12–14. |
| [14] | Wang H, Du Y J, Son H C, et al. α-Glucosidase and a-amylase inhibitory activities of guava leaves[J]. Food Chem, 2010, 123(1):6–13. doi:10.1016/j.foodchem.2010.03.088 |
| [15] | 康文艺, 张丽, 宋艳. 茜草抑制α-葡萄糖苷酶活性成分研究[J]. 中国中药杂志, 2009,34(9):1104–1107. |
| [16] | 张秋兰. 二甲双胍与阿卡波糖治疗2型糖尿病疗效比较[J]. 现代医院, 2009,4(6):20–23. |
| [17] | 王吉影, 顾耀, 徐乃馨, 等. 阿卡波糖和伏格列波糖治疗2型糖尿病的比较[J]. 同济大学学报, 2001,22(2):32–35. |
| [18] | John Y C, Liza I, Memg H T, et al. Effects of thiazolidinediones on the triad of type 2 diabetes mellitus, insulin resistance and cardiovascular disease[J]. Diab Res Clin Pract, 2007, 78(3):3–13. doi:10.1016/j.diabres.2007.09.010 |
| [19] | Han K L, Jung M H, Sohn J H, et al. Ginsenoside20S-protopanaxatriol (PPT) activates peroxisome proliferator-activated receptor gamma (PPAR gamma) in 3T3-L1 adipocytes[J]. Biol Pharm Bull, 2006(29):110–113. |
| [20] | Attele A S, Wu J A, Yuan C S, et al. Ginseng pharmacology:multiple constituents and multiple actions[J]. Biochem Pharmacol, 1999, 58(11):1685–1693. doi:10.1016/S0006-2952(99)00212-9 |
| [21] | Yokozawa T, Kobayashi T, Oura H, et al. Studies on the mechanism of the hypoglycemic activity of ginsenoside-Rb2 in streptozotocin-diabetic rats[J]. Chem Pharm Bull, 1985(33):869–872. |
 2016, Vol. 39
2016, Vol. 39


