2. 天津百若克医药生物技术有限责任公司, 天津 300308
2. Bioroc Pharmaceutical & Biotech Co. Ltd., Tianjin 300308, China
风疹是由披膜病毒科的风疹病毒引起的,是一类可通过空气传播的急性传染性疾病,好发于5岁以下儿童,传染力较强。妊娠期间的妇女早期初次感染后可通过胎盘垂直传染给胎儿,常可造成流产还可导致胎儿发生先天风疹综合征,引起胎儿畸形,因而应用安全有效的风疹疫苗对高危人群进行免疫越来越受到人们的重视。由此,本课题组对天津百若克医药生物技术有限责任公司生产的风疹病毒减毒活疫苗进行猴体神经毒力试验,对猴丘脑进行定位及疫苗接种,观察其是否有潜在的神经毒力,为产品安全性提供依据[1]。
1 材料 1.1 药品及主要试剂风疹病毒减毒活疫苗,由天津百若克医药生物技术有限责任公司提供,批号20130415,滴度4.91 Ig CCID50/mL,2~8 ℃保存;戊巴比妥钠(德国Merck公司,批号120505);0.9% NaCl注射液(石家庄四药有限公司,批号121201164);绵羊红细胞(北京万丰动物饲养场);兔抗风疹病毒血清、血凝素、氯化钙、氯化锰(国药集团化学试剂有限公司);氯化镁(德国Merck公司);牛血清白蛋白(上海江莱生物技术有限公司);明胶、4-羟乙基哌嗪乙磺酸(HEPES,美国Sigma公司);肝素钠注射液(天津生物化学制药有限公司)。
1.2 实验动物普通级恒河猴,约1岁,体质量2.20~2.90 kg,由苏州西山中科实验动物有限公司提供,单位许可证号SCXK(苏)2012-0009。实验动物在购入前进行了猕猴疱疹病毒(BV)、猴免疫缺陷病毒(SIV)、猴T细胞趋向性病毒I型(STLV-1)、猴逆转D型病毒(SRV)及志贺菌、沙门氏菌、结核分枝杆菌等检测,均呈阴性。动物使用方案经天津药物研究院新药评价有限公司试验动物管理和使用委员会(IACUC)审查并批准,试验方案遵从国家食品药品监督管理局(CFDA)药物非临床研究质量管理规范(GLP)。
1.3 主要仪器猴脑定位仪(深圳市瑞沃德生命科技有限公司);MT1622电子体温计(瑞士Microlife公司);显微镜(日本奥林巴斯光学株式会社);脱水机、染色机(日本樱花检验仪器株式会社);切片机(日本大和光机工业株式会社);包埋机(德国Leica公司);VS-1300U型洁净工作台(苏州智净净化设备有限公司);2.5、100、200、1 000 μL移液器(德国BRAND公司);TDL-40高速离心机(上海安亭科学仪器厂);SWB3D水浴箱(英国Bibby Scientific公司);SC-316立式透明门冷藏柜(海尔集团)。
2 方法 2.1 动物筛选和分组[2]根据百若克医药生物技术有限责任公司提供的动物风疹病毒抗体检测结果,购入风疹病毒抗体阴性的动物,同时进行体质量、体温检测,选取体温正常的猴用于神经毒力试验。将动物分为2组,风疹病毒减毒活疫苗组10只,对照组2只,均为雌雄各半。
2.2 疫苗接种 2.2.1 丘脑定位[3-4]静脉推注20~30 mg/kg戊巴比妥钠将动物麻醉,待动物麻醉状态稳定后剃除头部毛发,将其头部以双耳道及口腔上腭为支撑点固定于猴脑定位仪中。用记号笔通过外耳孔中点与眼眶下缘作听眶线,垂直于听眶线于外耳道前方4~6 mm处作一条垂线,沿此垂线选取该线与正中矢状面交点左右各4~5 mm处标出钻孔点。
2.2.2 接种疫苗猴头部备皮处用碘伏消毒,在钻孔点于矢状面平行方向切开皮肤约0.3~0.5 cm,剥离肌肉暴露颅骨,然后钻孔至硬膜,将注射器平行于垂线与正中矢状面缓慢刺入脑组织,根据猴脑部定位图谱与猴颅骨大小比例,控制进针深度为22~25 mm,风疹病毒减毒活疫苗组左右两侧丘脑各注射0.5 mL减毒活疫苗,对照组给予同体积生理盐水,对手术部位进行缝合消毒。
2.3 抗体效价检测疫苗接种后20 d,风疹病毒减毒活疫苗组动物上肢静脉采集血样,对照组动物于接种后20、31 d采集血样。血样3 000 r/min离心10 min分离出血清,将血清在56 ℃水浴中灭活,加入氯化锰、50%绵羊红细胞悬液混匀,在2~8 ℃冰箱中放置过夜,以去除血清中非特异性血凝物质,2 000 r/min离心15 min后将上清液转移至新管中备用。
取处理好的上清液置于血凝板的孔内,依次2倍稀释至1:512,最后一孔加上清液和稀释液(生理盐水、氯化镁、氯化钙、牛血清白蛋白、明胶和HEPES的混合液)作为血清对照孔,其他各孔加入血凝素,将血凝板置于2~8 ℃冰箱中1 h。然后每孔加入0.25%绵羊红细胞悬液,振荡混匀后在2~8 ℃冰箱中放置1 h,将反应板倾斜成45°,观察红细胞的凝集状态。同时以兔风疹病毒血清、稀释液作为阳性对照孔和阴性对照孔,设计血凝素效价校正孔,与血清样品平行操作,增加0.25%绵羊红细胞对照孔和血凝素对照孔。能使红细胞完全凝集的血清的最高稀释倍数,为该样品抗体效价。抗体效价低于1:8为阴性,大于等于1:8为阳性。
2.4 神经毒力症状的观察观察疫苗接种后动物是否产生情绪激怒、呕吐、颈强直、共济失调、上下肢及眼球震颤、抽搐、癫痫惊厥、偏瘫等神经毒力症状,以及疫苗对动物行为活动、上下肢协调能力、外观表征、精神状态、对外界刺激的反应以及饮食情况的影响,风疹病毒减毒活疫苗组、对照组动物分别观察20、31 d。
2.5 体温检查所有动物在疫苗接种后1~7 d,每天检测一次体温,以后每隔一天检测一次体温至接种后20 d结束。
2.6 大体解剖检查疫苗接种20 d后,风疹病毒减毒活疫苗组所有动物静脉推注浓度为3%的戊巴比妥钠,待动物麻醉状态稳定后放血安乐死,然后进行大体解剖,表观或肉眼观察颅腔组织及脊髓的变化,记录解剖情况,文字描述脏器、组织的变化。接种后31 d对照组动物也用同样的方法安乐死,并进行大体解剖。
2.7 组织病理学检查[5-6]风疹病毒减毒活疫苗组和对照组动物均取脑(端脑、间脑、小脑、脑干)、脊髓(颈、胸、腰段)等组织,标本经过组织固定、包埋、切片、染色后在显微镜下进行组织形态学检查,文字描述各脏器、组织的变化。
3 结果 3.1 抗体检测疫苗接种后20 d,风疹病毒减毒活疫苗组风疹病毒抗体检测结果全为阳性,抗体效价高于1:128,可见动物免疫应答活跃,风疹病毒减毒活疫苗的免疫原性良好;对照组动物疫苗接种后20、31 d,抗体检测结果均为阴性,结果见表 1。
| 表 1 血清抗体效价的测定结果 Table 1 Determination of serum antibody titer |
3.2 临床表现
观察期间,风疹病毒减毒活疫苗组和对照组所有动物均未出现情绪激怒、呕吐、颈强直、共济失调、上下肢及眼球震颤、癫痫惊厥、偏瘫等神经毒力反应。动物行为活动情况、上下肢协调能力、外观体征、精神状态、对外界刺激的反应以及食欲、食量等各方面均未见明显异常。
3.3 对体温的影响给予疫苗后至观察20 d,风疹病毒减毒活疫苗组及对照组动物体温均在正常范围内波动,未见疫苗对动物体温的明显影响,结果见图 1。
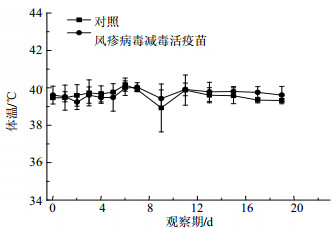
|
图 1 丘脑注射风疹病毒减毒活疫苗对动物肛温的影响 Fig. 1 Effects of attenuated live rubella vaccine on temperature after injected into thalamus. |
3.4 大体解剖检查
两侧给药打孔部位皮肤疤痕存在,颅骨打孔处未愈合,脑膜及前脑可见穿刺针孔及穿刺痕迹,未见扩展性病变。前脑、间脑、脑干、小脑、脑室、垂体、脊髓解剖结构完整,无水肿炎性反应等肉眼可见病变。可见丘脑定位及穿刺针进针位置准确,对脑部组织影响较小,但打孔部位组织的恢复较慢。
3.5 组织病理学检查风疹病毒减毒活疫苗组及对照组动物端脑(额叶、颞叶、中央前后回、枕叶、海马和纹状体)、间脑(丘脑)、脑干(中脑、脑桥和延髓)、小脑和脊髓(颈、胸、腰段)组织结构完整,各种类型的神经细胞和神经纤维形态清晰,结构正常,均未见明显病理改变。可见,风疹病毒减毒活疫苗对恒河猴脑(端脑、间脑、脑干和小脑)和脊髓(颈段、胸段和腰段)没有明显的神经毒性。结果见图 2。
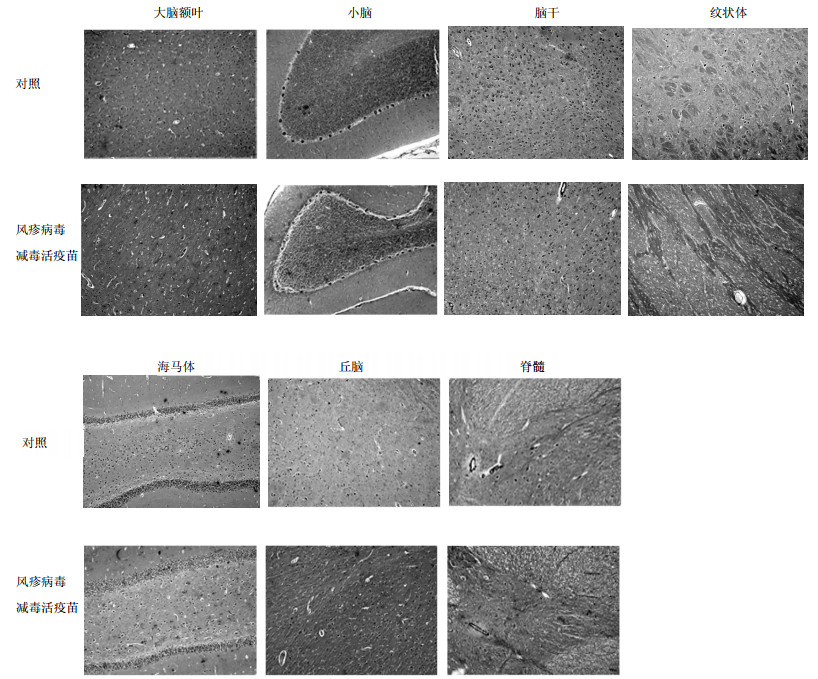
|
图 2 镜下观察动物脑部及脊髓组织形态学的变化 Fig. 2 Microscope observation of morphologic changes in brain and spinal cord tissues |
4 讨论
猴体丘脑内接种风疹病毒减毒活疫苗后,外周血中风疹病毒抗体效价高于1:128,免疫反应良好,未观察到神经毒力症状,动物行为活动、外观体征、对外界刺激的反应以及饮食情况等各方面均未见明显异常,体温在正常范围内波动,大体解剖可见脑膜及前脑的穿刺针孔及穿刺痕迹,未见扩展性病变,无水肿炎性反应等肉眼可见病变,组织病理学发现脑和脊髓组织结构完整,各种类型的神经细胞和神经纤维形态清晰,结构正常,均未见明显病理改变。可见,该风疹病毒减毒活疫苗具有较好的免疫原性和安全性,未发现潜在的神经毒力。
风疹减毒活疫苗已有十多年的应用经验,证明其安全有效,极个别受试者接种后有短期发热、皮疹、淋巴结肿大、关节肿痛等不良反应。患者感染风疹后,会引起皮肤、淋巴结的炎症及脑炎等症状。恒河猴与人类有近属关系,有发达的大脑,脑部结构及接种疫苗后的反应都与人极为相似,最易解决人类相似疾病及其发病机理,是目前评价疫苗神经毒力的较好的实验动物,猴体神经毒力试验能为疫苗的安全性评价提供参考。
在该神经毒力试验中准确定位丘脑接种点是试验的关键步骤,本课题组通过对相关文献[8-10]及脑图谱的查询,总结出通过外耳孔中点与眼眶下缘作听眶线,垂直于听眶线于外耳道前方4~6 mm处作一垂线,沿此垂线选取该线与正中矢状面交点左右各4~5 mm处标出钻孔点这一定位方式,又选用精度高、稳定性好的猴脑定位仪进行保定和颅骨打孔,提高了定位准确性,根据猴脑部定位图谱与猴颅骨大小比例,控制进针深度为22~25 mm,通过后期的颅腔解剖来看,针迹穿过脑膜及前脑准确到达丘脑内接种部位,通过对离体脑组织沿真迹的模拟穿刺也印证了接种部位的准确性。虽然颅骨打孔对大脑造成的物理损伤3周内并不能恢复但动物也未表现出明显临床症状,其原因可能是猴对较轻微颅内组织损伤并不敏感,也说明了疫苗接种定位越准确创伤越小对试验的干扰也将会随之降低。
在本课题的研究中,未发现风疹病毒减毒活疫苗的潜在神经毒力,可以为药品的安全性提供科学依据。但作为完善的制品,仍需考虑风疹病毒减毒活疫苗免疫接种的潜在障碍、疾病负荷和免疫的持久性,成熟、完善的实验动物模型仍需深入研究,相信会在来断完善动物模型的基础上,为解决诸如此类问题提供可行的手段。
| [1] | 张若明. 疫苗的临床前安全性评价[J]. 中国新药杂志, 2008,17(13):1176–1179. |
| [2] | 中国药典[S].三部. 2010:144-146. |
| [3] | 杨文光. 中缅树鼯、广西猕猴脑立体定位图谱[M]. 南宁: 广西科学技术出版社, 1990 : 94 -102. |
| [4] | 夏睿, 郜发宝, 颜富强. 7T MR辅助猴丘脑定位注射的研究[J]. 实用放射学杂志, 2011,27(10):1578–1580. |
| [5] | Jortner B S. Neuropathological assessment in acute neurotoxic states. The "DARK" neuron[J]. J Med CBR Def, 2005, 3:1–5. |
| [6] | Paprdo I D, Garman R H. Weber K, et al. Technical guide for nervous system sampling of the cynomolgus monkey for general toxicity studies[J]. Toxicol Pathal, 2012, 40(4):624–636. doi:10.1177/0192623311436180 |
| [7] | 郎书惠, 方捍华, 岳广智. 麻疹乙脑二联活疫苗猴体神经毒力试验[J]. 中国生物制品学杂志, 2001,14(3):165–167. |
| [8] | 黄果勇, 孙衍庆, 胡彩珍. 水痘病毒活疫苗病毒种子批猴体神经毒力试验[J]. 广西预防医学, 2002,8(3):151–152. |
| [9] | Galazka A M, Robertson S E, Kraigher A. Mumps and mumpsvaccine:globalreview[J]. Bull World Health Organ, 1999, 77(1):3–12. |
| [10] | FDA. Workshop on non-clinical safety evaluation of preventive vaccines:recent advances and regulatory considerations[S]. 2002. |
 2016, Vol. 39
2016, Vol. 39


