2. 粤北人民医院, 广东 韶关 512026;
3. 天津中医药大学第一附属医院, 天津 300193;
4. 广州中医药大学第一附属医院, 广东 广州 510504;
5. 天津中医药大学中医药研究院, 天津 300193
2. Yuebei People's Hospital, Shaoguan 512026, China ;
3. First Teaching Hospital of Tianjin University of TCM, Tianjin 300193, China ;
4. First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510405, China ;
5. Research Institute of TCM, Tianjin University of TCM, Tianjin 300193, China
子宫肌瘤(uterine leiomyoma,UL)又称子宫平滑肌瘤,是女性生殖系统中最常见的良性肿瘤,由平滑肌及少量的纤维结缔组织组成。其症状因肿瘤生长的部位及大小不同而有所不同,主要表现为不规则的阴道出血、月经量多、经期延长、周期缩短、继发性贫血、腹部包块、疼痛以及子宫增大所致的压迫症状等。近年来UL呈逐年上升趋势,且发病年龄趋于年轻化[1]。中医药治疗UL疗效确切,具有毒副作用小、简便廉价的优势,逐渐受到患者的青睐。宋卓敏教授在总结名老中医哈荔田、哈孝贤教授临床经验基础上,通过长期实践总结,应用益气消癥法方药治疗子宫肌瘤30余年,疗效显著[2]。
UL是性激素依赖性肿瘤,它的生长依赖于足够的局部血管生成,以维持肿瘤的充分血液供应。本课题组前期研究表明[3-4],益气消癥法方药均可抑制人脐静脉细胞融合细胞(EA.hy926)增殖及血管新生。本实验应用雌二醇诱导EA.hy926细胞增殖,制备子宫肌瘤血管模型,研究益气消癥法方含药血清对丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路中细胞外信号调节激酶1/2(extracellular-signal regulated kinase 1/2,ERK1/2)的影响,以此探讨该法方药抑制血管内皮细胞增殖、控制血管新生、减少瘤体血液供应,从而达到缩消子宫肌瘤的作用机制。
1 材料 1.1 动物清洁级成年雌性SD大鼠,60只,体质量(200±20)g,由天津实验动物中心提供,合格证号SCXK(津)2010-0002。
1.2 细胞人脐静脉细胞融合细胞(EA.hy926),购自中国科学院上海细胞库。
1.3 药物及主要试剂益气消癥法方药组成包括:党参30 g、川续断15 g、莪术15 g、郁金10 g、白芥子15 g、鳖甲30 g等,应用喷雾干燥法获得中药干粉,由天津中医药大学中医药研究院制剂室提供。制备工艺如下:依据单味药药效物质基础将益气消癥法方药分为水提药材及醇提药材两部分分别提取,最终水提取液与醇提取液合并,继续浓缩至总药材量2倍量,制成生药浓度约为0.5 g/mL的药液,喷雾干燥。最终中药干粉与生药比例为1:4.5,常温干燥条件下贮存备用。
17β-雌二醇(17β-estradiol,简称E2,生产批号1D/127636)、氟维司群(fulvestrant,ICI182780,简称ICI,生产批号20A/134126),英国Tocris公司;DMEM培养基、优质小牛血清,杭州四季青生物工程材料有限公司;RNA抽提试剂Trizol Invitrogen、反转录试剂盒MBI Revert Aid First Strand cDNA Synthesis Kit、实时荧光定量PCR(qRT-PCR)试剂盒cDNA Synthesis and SYBR® Green Master Mix Kits,大连宝生物工程有限公司;MEK2、ERK1/2、actin抗体,北京基诺莱普生物技术有限公司。
1.4 主要仪器超净台(苏州安泰公司);电泳仪(北京百晶生物技术有限公司);凝胶玻璃板、固定夹、垂直电泳槽、转移电泳槽、凝胶成像分析系统、PCR扩增(美国BIO-Rad公司);紫外分光光度计(美国Beckman公司)。
2 方法 2.1 含药血清的制备60只SD大鼠按体质量随机分为:对照组,益气消癥法方高、中、低剂量(24、12、6 g/kg)组。大鼠ig益气消癥法方药液之前禁食、禁水3 h,药物剂量根据成人日用药量,按大鼠体质量比率换算成等效剂量,益气消癥法方中剂量2.7 g干粉/kg(相当于12 g/kg生药)为等效剂量,高、低剂量分别为中剂量的2、0.5倍,给药体积为1 mL/100 g,每天给药1次,连续给药5 d,对照组大鼠ig等体积生理盐水。第5天给药后1 h,乙醚麻醉后处死,腹主动脉取血7 mL左右,3 000 r/min离心10 min,取血清约2 mL,56 ℃水浴锅中灭活30 min,0.22 μm微孔膜过滤除菌,密封,置于−20 ℃冰箱冻存备用。
2.2 细胞培养将EA.hy926细胞接种于6孔板中,DMEM培养液培养,培养液中加入10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素,细胞培养箱保持37 ℃、5% CO2、饱和湿度,待EA.hy926细胞铺满板底后开始实验。
2.3 细胞分组及干预将EA.hy926细胞随机分为6组:对照组(对照组大鼠血清)、模型(加入E2)组,益气消癥法方高、中、低剂量组(益气消癥法方24、12、6 g/kg血清)及ICI(阳性药)组。用DMEM培养液配成终浓度为15%的含药血清或对照血清,培养液中E2终浓度为1×10−8 mol/L,ICI终浓度为1×10−7 mol/L。
2.4 qRT-PCR技术检测MEK2和ERK1/2 mRNA表达将EA.hy926细胞以5×105/mL、每孔2 mL浓度接种到6孔板,每组6个复孔,按“2.3”项方法给药后,继续孵育48 h,收集细胞,按照Invitrogen公司的Trizol kit说明书提取细胞总RNA,于−80 ℃冰箱保存备用。测定RNA浓度,取2 μg总RNA进行逆转录反应,具体操作严格按照反转录试剂盒MBI RevertAid First Strand cDNA Synthesis Kit说明书进行。qRT-PCR技术检测MEK2、ERK1/2 mRNA表达,具体操作严格按照试剂盒说明书进行。
采用Beacon 7.0软件设计引物,由北京基诺莱普生物技术有限公司合成。引物序列见表 1。
| 表 1 引物统计信息 Table 1 Primers statistics |
2.5 Western blotting法检测MEK2、ERK1/2蛋白表达
EA.hy926细胞以5×105/mL、每孔2 mL浓度接种到6孔培养板,每组6个复孔,按“2.3”项方法加入不同浓度的含药血清或试剂,继续孵育48 h;置于冰上,PBS洗涤3次,加入RIPA裂解液,收集各孔总蛋白,BSA法测定蛋白浓度,各组取等量总蛋白上样,进行SDS-PAGE凝胶电泳;电转法转移到硝酸纤维膜上,转膜结束后浸泡在封闭液中,置于摇床上摇动1 h;封闭后的膜放入稀释1 000倍的一抗工作液中,室温震荡,4 ℃放置过夜;TBST洗膜3次,放入稀释3 000倍的二抗工作液中,室温震荡孵育1 h;TBST洗膜3次后,ECL显影,应用软件Image J分析条带灰度值。
2.6 统计学处理数据以x±s表示,采用SPSS 17.0统计软件,应用单因素方差分析(One-Way ANOVA)进行比较,单因素方差分析后,采用Games-Howell法进行两两比较。
3 结果 3.1 对EA.hy926细胞MEK2和ERK1/2 mRNA表达的影响与对照血清组比较,模型组MEK2和ERK1/2 mRNA表达明显增加(P < 0.01);与模型组比较,益气消癥法方高剂量血清组及ICI组MEK2和ERK1/2 mRNA表达明显降低(P < 0.01),结果见图 1。
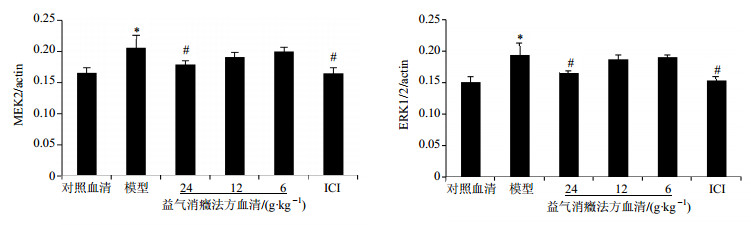
|
与对照组比较:P < 0.01;与模型组比较:#P < 0.01,下同 P < 0.01vs control group; #P < 0.01 vs model group, same as below 图 1 各组EA.hy926细胞MEK2、ERK1/2 mRNA表达的比较(x±s, n=6) Fig. 1 Comparison on MEK2 and ERK1/2 mRNA expression in EA.hy926 cells of each group (x±s, n=6) |
3.2 对EA.hy926细胞MEK2和ERK1/2蛋白表达的影响
与对照血清组比较,模型组MEK2和ERK1/2蛋白表达明显增加(P < 0.01);与模型组比较,益气消癥法方高剂量血清组及ICI组的MEK2和ERK1/2蛋白表达明显降低(P < 0.01),结果见图 2。
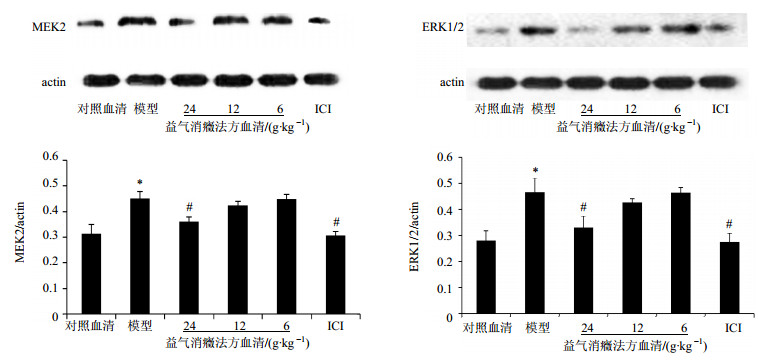
|
图 2 各组EA. hy926细胞MEK2、ERK1/2蛋白表达的比较(x±s, n=6) Fig. 2 Comparison on MEK2 and ERK1/2 protein expression in EA.hy926 cells of each group (x±s, n=6) |
4 讨论
子宫肌瘤在祖国医学中属“癥瘕”范畴,辨证归于脏腑虚弱、六淫侵袭、七情内伤,致气血逆乱、气滞血瘀、痰湿内生,最终导致痰瘀互结而成癥瘕。吾导师宋卓敏教授在总结名老中医哈荔田、哈孝贤教授治疗子宫肌瘤的经验基础上,结合自己经过长期临床实践,确立益气化瘀、祛湿涤痰、软坚消癥法治疗子宫肌瘤,疗效显著。
西医学认为子宫肌瘤的生长、转移与瘤体血管新生密不可分。因此以肿瘤血管为靶点的治疗策略日益受到重视。血管新生是指产生新的血管或从已存在的血管中芽生出新血管的过程[5],涉及血管内皮细胞的活化迁移,基底膜降解,管腔的形成和重塑等生物学过程。其中血管内皮细胞增殖是血管新生的重要环节。
MAPK信号转导通路是生物信号传递网络中的最重要的传导途径之一,参与细胞的生长、发育、分化、凋亡等一系列细胞生理活动[6-7]。其主要信号通路有4条:ERK转导通路、P38 MAPK转导通路、C-Jun氨基末端激酶转导通路等[8-9]。在细胞中ERK1/2有无活性非磷酸化状态和有活性磷酸化状态两种存在形式,ERK1/2一旦被激活将通过转位进入胞核,激活转录因子和激酶等,进而调控转录相关基因的表达活性[10]。MAPK的激活途径很保守,为3级酶促级联反应,通过激活其下游的转录因子参与细胞的各项功能调节,并与多种疾病的发生、发展密切相关,其中MAPK是该信号通路的枢纽[11]。
研究表明,雌激素在血管新生中发挥重要作用,MAPK信号通道的磷酸化靶物包括雌激素受体(ER)。雌激素能通过MAPK信号通道的非基因组激活诱导ERα的Ser118等磷酸化,增强ER二聚体形成、核移位和受体转录活性。ICI是一种对雌激素受体有拮抗作用的非甾体类雌激素受体抑制剂,是ER的特异性拮抗剂,可通过与ER结合阻断ER活性,产生抗雌激素样作用。MAPK/ERK信号通路参与血管新生,MEK2是ERK通路级联反应的重要一环。ERK通路可通过增加血管内皮生长因子(Vascular endothelial growth factor,VEGF)及碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)促进血管新生[10-11]。
本研究结果显示,在E2的作用下,模型组及益气消癥法方高、中、低剂量血清组EA.hy926细胞MEK2和ERK1/2的表达水平明显高于对照血清组;而与模型组比较,ICI组和益气消癥法方高剂量血清组MEK2和ERK1/2表达水平显著降低。
因此,本研究表明益气消癥法方药含药血清能够通过降调MEK2和ERK1/2表达,阻断ER介导的MAPK/ERK1/2信号转导通路,影响雌激素效应的发挥,抑制雌激素诱导的EA.hy926细胞增殖,进而控制血管新生,减少瘤体血液供应,最终达到缩消子宫肌瘤、改善临床症状的目的。
| [1] | 陈庆云, 张小燕. 子宫肌瘤发病机制研究进展[J]. 中国实用妇科与产科, 2012,28(12):950–952. |
| [2] | 哈孝贤, 董素芹, 刘永志, 等. 肌瘤丸治疗子宫肌瘤的临床研究(附384例病例报告)[J]. 天津中医, 1996,13(2):1–3. |
| [3] | 刘丽丽, 李爽, 李海东, 等. 益气消癥法中药含药血清干预ER mRNA及VEGFR mRNA表达抑制EA.hy926增殖的研究[J]. 天津中医药, 2014,31(1):36–41. |
| [4] | 李爽, 刘丽丽, 李海东, 等. 益气消癥法方药含药血清对鸡胚绒毛尿囊膜血管新生的影响[J]. 四川中医, 2013,31(6):50–52. |
| [5] | Syed I S, Sanborn T A, Rosengart T K. Therapeutic angiogenesis:A biologic bypass[J]. Cardiology, 2004, 101(1/3):131. |
| [6] | Zhang Y, Nallaparaju K C, Liu X, et al. MAPK Phosphatase 7 Regulates T Cell Differentiation via Inhibiting ERK-Mediated IL-2 Expression[J]. J Immunol, 2015, 194(7):3088–3095. doi:10.4049/jimmunol.1402638 |
| [7] | Zhang Y, Wei L, Yu J, et al. Targeting of the beta6 gene to suppress degradation of ECM via inactivation of the MAPK pathway in breast adenocarcinoma cells[J]. Oncol Rep, 2014, 32(5):1787–1795. |
| [8] | Urosevic J, Nebreda A R, Gomis R R. MAPK signaling control of colon cancer metastasis[J]. Cell Cycle, 2014, 13(17):2641–2642. doi:10.4161/15384101.2014.946374 |
| [9] | de Souza A P, Vale V L, Silva Mda C, et al. MAPK involvement in cytokine production in response to corynebacterium pseudotuberculosis infection[J]. BMC Microbiol, 2014, 14(1):230. doi:10.1186/s12866-014-0230-6 |
| [10] | Osuka K, Watanabe Y, Usuda N, et al. Activation of Ras/MEK/ERK signaling in chronic subdural hematoma outer membranes[J]. Brain Res, 2012, 1489(18):98–103. |
| [11] | 张美荣, 刘举, 王洋. 丝裂原激活蛋白激酶相关疾病及其药物的研究进展[J]. 中国药物化学杂志, 2014,24(3):231–240. |
 2016, Vol. 39
2016, Vol. 39


