2. 中国医学科学院药用植物研究所, 北京 100193
2. Chinese Academy of Medical Sciences and Peking Union Medical College The Institute of Medicinal Plant Development, Beijing 100193, China
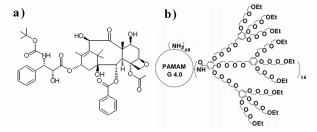
多烯紫杉醇(docetaxel,DTX)是紫杉烷类的新一代半合成抗癌药,结构见图 1(a)。在临床试验中,多烯紫杉醇已经被成功应用,主要是用于治疗卵巢癌、乳腺癌后期,肺癌和头/颈癌[1-4]。但是多烯紫杉醇亲脂性高,不溶于水,口服吸收效果不佳,且不稳定,生物利用度低。纳米粒具有易制备、载体材料多样性、载药量高、生物利用度高、缓控释、可靶向给药等特点,受到越来越多的关注[5-6]。因此,可以将多烯紫杉醇制备成纳米粒,以期提高其溶解度和生物利用度。载体材料的选择是制备纳米粒的关键,其通常由天然高分子材料和合成高分子材料两大类组成,合成高分子载体材料更能接近应用要求,越来越受人们的青睐。研究发现,以四代的聚酰胺-胺(polyamidoamine,PAMAM)树形分子为内核,以25%的偶联效率接枝的二代三乙二醇树枝化基元寡聚乙二醇(OEG)为外壳[图 1(b)]的新型两亲性树状大分子(PAMAM-co-0.25OEG,PGD)具有稳定性高、载药空腔大的优点,对于多种难溶性药物均有较好的装载能力[7-8]。此新型树状大分子不仅可以用于制备载药胶束,还可作为稳定剂制备纳米粒。由此,选用这一新型载体材料作为稳定剂制备多烯紫杉醇纳米粒,以期提高多烯紫杉醇溶解度和生物利用度,并对其进行体外特征及细胞毒作用的研究。
|
图 1 多烯紫杉醇(a)及PGD(b)分子结构 Fig. 1 Molecular structure of DTX (a) and PGD (b) |
1 仪器与试药 1.1 仪器
KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司);DGG-9030AD型电热恒温鼓风干燥箱(上海森信实验仪器有限公司);Meppler Toledo AL204电子天平(梅特勒-托利多仪器(上海)有限公司);Purelab Classic综合纯水仪(英国ELGA公司);Zetasizer Nano ZS 90(马尔文仪器有限公司);Ultimate 3000 Series高效液相色谱仪(Dionex);Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm,美国Waters公司);S-4800场发射扫描电子显微镜(scanning electron microscope,SEM)(日本日立公司);Mettler TGA/DSC 1 SF/1382热重分析仪(梅特勒-托利多仪器有限公司);DX-2700型X-射线衍射仪(日本理学电机株式会社);JN-3000 PLUS高压均质机(广州聚能生物科技有限公司);SHA-B水浴恒温振荡器(金坛国旺实验仪器厂);MCA-15AC细胞培养箱(日本Sanyo公司);UQuant酶标仪(美国Biotek仪器公司)。
1.2 试药多烯紫杉醇(docetaxel,DTX),相对分子质量807.88,购自北京偶合科技有限公司;PGD聚合物,相对分子质量4.6×104,由实验室合成;乙腈(批号A3889,Fisher,色谱纯);其他试剂均为分析纯。
2 方法 2.1 多烯紫杉醇含量测定方法学建立 2.1.1 HPLC色谱条件[9]Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm);流动相为0.1%的冰醋酸-乙腈(35׃65);体积流量0.8 mL/min;检测波长230 nm;温度25℃;进样量20 μL。
2.1.2 标准曲线的制备配制DTX的甲醇溶液,质量浓度分别为100、50、25、10、5、1、0.5 μg/mL,在2.1.1色谱条件下测定峰面积。以峰面积对质量浓度(μg/mL)进行线性回归,得DTX标准曲线。
2.2 DTX-PGD纳米粒的制备及表征 2.2.1 DTX-PGD纳米粒的制备纳米粒的制备采用溶剂沉淀法联合高压均质法。室温下,称取聚合物PGD(2 mg)与DTX(16 mg)共同溶解于N, N-二甲基甲酰胺(DMF)(1 mL)中,25 ℃、250 W超声条件下注入去离子水(10 mL)中,继续超声10 min,室温条件下用去离子水透析4 h(1 L/h),1.8×105 kPa高压均质20次,得到DTX-PGD纳米粒。
2.2.2 DTX-PGD纳米粒的粒径、电位及载药量测定动态光散射测定载药纳米粒粒径及电位,以平均粒径及Zeta电位记录测定结果,并以HPLC测定其载药量(drug loading capacity,DL%)。
测定方法:取纳米粒5 mL,冷冻干燥后称质量,质量记为W1。用甲醇溶解并定容到25 mL,按照2.1.1的色谱条件测定DTX浓度,计算纳米粒中DTX总量,记为W2。根据载药量公式计算DL%。
DL%=W2/W1
2.2.3 DTX-PGD纳米粒的粒径稳定性考察DTX-PGD纳米粒分别与等体积0.9%生理盐水、5%葡萄糖、PBS及血浆混合,37 ℃孵育,于0、2、4、6 h测其粒径大小,观察有无沉淀或浑浊,并以不同时间点的粒径大小对时间作图,评价DTX-PGD纳米粒在0.9%生理盐水、5%葡萄糖、PBS及血浆中的粒径稳定性。
2.2.4 DTX-PGD纳米粒的扫描电镜观察制备纳米粒后,冻干,涂覆金6 min后,通过扫描电镜观察并拍照,加速电压为30 mV。
2.2.5 DTX-PGD纳米粒的晶型分析使用DX-2700型X射线衍射仪,在管压40 kV,管流40 MA,Cu靶,扫描速度为10 ℃/min,扫描范围为3~40 ℃,步宽0.02。分别检测DTX、DTX与PGD物理混合物、DTX-PGD纳米粒冻干粉的晶型。
2.3 DTX-PGD纳米粒的体外释放精密吸取1 mL将制备好的DTX-PGD纳米粒(1 mg/mL满足漏槽条件),装入经蒸馏水浸泡处理过的透析袋(相对分子质量14 000)内,将袋口扎紧,以50 mL的PBS+0.5%十二烷基硫酸钠(SDS)组成的释放介质,在37 ℃水浴恒温搅拌(100 r/min)。在预设时间点(0.5、1、2、4、6、8、10、12、24、48、72、96、120、144、168 h)取样5 mL,按照2.1.1的色谱条件,HPLC法测其中的药物含量,同时补加同体积的释放外液,每24 h换液1次。将所取样品10 000 r/min离心10 min后,取上清液相测定释放介质中DTX的含量,计算累计释放率(实验平行3份),绘制体外释放曲线。
2.4 DTX-PGD纳米粒溶血性考察分别取不同质量浓度(1、0.5、0.25、0.125、0.0625 mg/mL)DTX-PGD纳米粒的葡萄糖等渗液500 μL与500 μL红细胞悬浮液(红细胞浓度为4%)混合后37 ℃孵育4 h,5 000 r/min离心5 min,取上清150 μL于96孔板中,用酶标仪在540 nm测紫外吸光度(A)值,每个浓度平行3份,以葡萄糖为阴性对照,以蒸馏水为阳性对照。计算溶血率。
溶血率=(实验组的A值-阴性对照组A值)/(阳性对照组A值-阴性对照组的A值)
2.5 DTX-PGD纳米粒的MTT实验培养4T1细胞至对数期,按8.0×103/孔,37 ℃、5%CO2培养24 h,质量浓度为1.6 mg/mL的DTX-PGD纳米粒,用不含胎牛血清的1640培养基将纳米粒稀释成0.1、1、5、10、50 μg/mL,每个质量浓度平行给药6组,孵育48 h,后加入MTT 20 μL/孔,孵育4 h,吸出各孔液体,每孔加入DMSO 200 μL,震荡15 min,使蓝紫色结晶物充分溶解。在酶联免疫荧光仪上检测570 nm下的A值,计算细胞存活率。
细胞存活率=(药物组每孔A均值−空白组A值)/(对照组A均值−空白组A值)
3 结果和讨论 3.1 DTX含量测定方法的建立2.1.1的色谱条件下,DTX保留时间在5.84 min左右。其含量测定的最低检测限为0.1 μg/mL,最低定量限为0.5 μg/mL。以峰面积为纵坐标,以质量浓度为横坐标,得到标准曲线方程:A=0.410 4 C+0.019 6(R2=0.999 9)。结果表明,DTX在0.5~100 μg/mL内峰面积与质量浓度的线性关系良好。
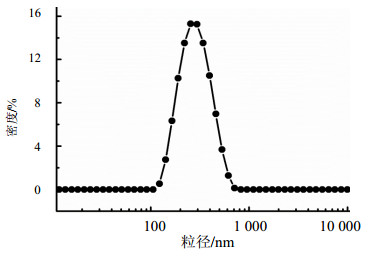
3.2 DTX-PGD纳米粒的制备及表征 3.2.1 DTX-PGD纳米粒的粒径、电位及载药量测定采用溶剂沉淀法联合高压均质制备得到的DTX-PGD纳米粒为乳白色溶液,DLS测得粒径为(270.7±3.0)nm(PDI值为0.112±0.070),电位(28.6±2.8)mV。由图 2的粒径分布图可以看出,DTX-PGD纳米粒粒径分布为单峰,说明纳米粒粒径分布较为集中,分散较为均匀。DTX-PGD纳米粒载药量高达(65.7±1.9)%,DTX药物溶解度增加至1.6 mg/mL,即将DTX制备成纳米粒,有助于提高DTX在水中的溶解度。
|
图 2 DTX-PGD纳米粒的粒径 Fig. 2 Particle size distribution of DTX-PGD nanoparticles |
3.2.2 DTX-PGD纳米粒在生理盐水、葡萄糖、PBS及血浆中的径稳定性考察
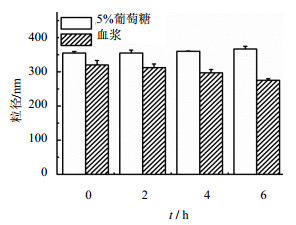
DTX-PGD纳米粒在0.9%生理盐水及PBS中不稳定,在5%葡萄糖及血浆中稳定。考察结果见图 3,6 h之内,DTX-PGD纳米粒在葡萄糖和血浆中的粒径无明显变化。肉眼观察,DTX-PGD纳米粒溶液在葡萄糖和血浆中也无明显沉淀或浑浊现象。证明纳米粒在葡萄糖中能稳定存在。纳米粒必须以等渗状态入血才可选择静脉注射给药方式,因此,DTX-PGD纳米粒在葡萄糖等渗溶液中的稳定性为其静脉注射给药提供了可能。
|
图 3 DTX-PGD纳米粒在葡萄糖及血浆中的粒径稳定性考察(n=3) Fig. 3 Particle size stability of DTX-PGD nanoparticles in glucose and plasma (n=3) |
3.2.3 DTX-PGD纳米粒的扫描电镜观察
DTX原粉和DTX-PGD纳米粒冻干粉喷金后在扫描电子显微镜下观察形态见图 4(a为DTX原粉,b为DTX-PGD纳米粒)。由电镜照片可见,DTX原粉为微米级片状,粒径约1 μm;DTX-PGD纳米粒呈规则的片状,分布较为均匀,粒径在200 nm左右。由于SEM中测得为干粒子的粒径,而马尔文粒度仪测得的是粒子的水化半径,故SEM中显示的粒径较马尔文测得值偏小,此差异是由于测定方法不同造成的[10]。

|
图 4 SEM观察DTX(a)和DTX-PGD纳米粒(b)的照片 Fig. 4 SEM images of DTX bulk powders (a) and DTX-PGD nanoparticles (b). |
3.2.4 DTX-PGD纳米粒的晶型分析
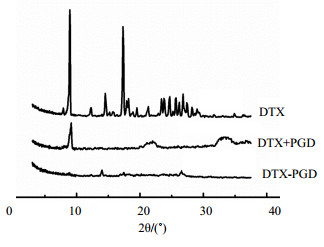
图 5为DTX原药、DTX与PGD物理混合物和DTX-PGD纳米粒的X射线衍射结果,DTX与PGD物理混合物和DTX-PGD纳米粒的X射线衍射曲线中均出现了DTX原药的8°、14°及26.5°位置的衍射峰。说明DTX药物是以晶型形式存在于DTX-PGD纳米粒中的。与无定形状态相比,纳米粒中多烯紫杉醇以晶型形式存在,可能更有助于药物的缓慢释放。
|
图 5 DTX原药、DTX与PGD物理混合物和DTX-PGD纳米粒的X射线衍射分析结果 Fig. 5 X-ray analysis of DTX bulk powders, mixture of DTX and PGD, and DTX-PGD nanoparticles |
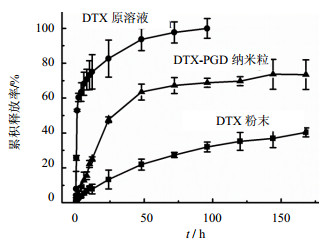
3.3 DTX-PGD纳米粒的体外释放
DTX-PGD纳米粒在PBS缓冲液(0.01 mol/L,pH 7.4,含0.5%SDS)中能够缓慢释放。从图 6释放结果说明,DTX-PGD纳米粒释放分为两个阶段,24 h之内,纳米粒的释放几乎呈现零级释放状态,累积释放率45%左右。24 h以后,释放开始变慢,168 h释放70%。DTX的DMSO溶液24 h内释放较快,累积释放率达82%,24 h之后,释放变得较为缓慢,96 h释放完全。DTX原药的水溶液释放极为缓慢,168 h释放不到50%。
|
图 6 DTX-PGD纳米粒在PBS缓冲液中的释放率 Fig. 6 Release of DTX-PGD nanoparticles in PBS buffer |
相对于DTX原溶液和粉末来说,DTX-PGD纳米粒体外缓释效果明显,这可能和DTX药物在纳米粒中以晶型形式存在有关。相对于无定形状态,药物以晶型态存在可能更有利于药物的缓慢释放。
3.4 DTX-PGD纳米粒溶血性考察表 1所示的溶血实验结果表明,1 mg/mL药物质量浓度下,溶血率为负值,小于5%[11]。表明DTX-PGD纳米粒不溶血,适合静脉注射给药。
| 表 1 DTX-PGD纳米粒的溶血性考察(n=3) Table 1 Hemolysis of DTX-PGD nanoparticles (n=3) |
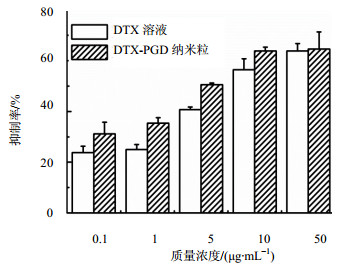
3.5 DTX-PGD纳米粒MTT实验
通过MTT法评价DTX-PGD纳米粒对4T1细胞的毒性,从IC50值来看,纳米粒组对细胞杀伤作用较大,DTX溶液组IC50值(9.498 μg/mL)是DTX纳米粒(3.862 μg/mL)的2.5倍。图 7可以看到,相比游离DTX,DTX-PGD纳米粒将会有更好的抗肿瘤效果,为进一步进行体内抗肿瘤药效实验奠定了基础。
|
图 7 DTX-PGD纳米粒及DTX溶液对4T1细胞48 h的杀伤作用 Fig. 7 Cytotoxicity of DTX-PGD nanoparticles and DTX solution against 4T1 cells for 48 h incubation |
4 结论
本研究以一种新型的树状大分子为载体制备了高载药量的DTX-PGD纳米粒,有效的提高了DTX在水中的溶解度,有助于其生物利用度的提高。DTX-PGD纳米粒呈片状,粒子为纳米大小,分布均匀,在5%葡萄糖、血浆中稳定性较好。DTX药物以晶型形式存在于纳米粒中,缓释效果明显。此纳米粒无溶血现象,适于静脉注射给药。DTX-PGD纳米粒对4T1细胞有较强的杀伤作用,其抑瘤效果更佳。但药物在动物体内的分布与代谢是一个非常复杂的过程,体外释放行为并不能完全代表其体内药动学行为,因此DTX-PGD纳米粒的体内代谢过程有待于进一步研究。
| [1] | Clarkes J, Rivory L P. Clinical pharmacokinetics of docetaxel[J]. Clin Pharmacokinet, 1999, 36(2):99–114. doi:10.2165/00003088-199936020-00002 |
| [2] | Tham Y L, Gomez L F, Mohsin S, et al. Clinical response to neoadjuvant docetaxel predicts improved outcome in patients with large locally advanced breast cancers[J]. Nature, 2005, 94(3):279–84. |
| [3] | Takigawa N, Segawa Y, Kishino D, et al. Clinical and pharmacokinetic study of docetaxel in elderly non-small-cell lung cancer patients[J]. Cancer Chemoth Pharmacol, 2004, 54(3):230–236. |
| [4] | Nuijen B, Bouma M, Schellensjh M, et al. Progress in the development of alternative pharmaceutical formulations of taxanes[J]. Inv New Drugs, 2001, 19(2):143–153. doi:10.1023/A:1010682916808 |
| [5] | Ling G, Zhang P, Zhang W, et al. Development of novel self-assembled DS-PLGA hybrid nanoparticles for improving oral bioavailability of vincristine sulfate by P-gp inhibition[J]. J Control Release, 2010, 148(2):241–248. doi:10.1016/j.jconrel.2010.08.010 |
| [6] | 王秋实. 纳米粒药物载体在抗癌领域的研究进展[J]. 生物技术世界, 2014(9):123–124. |
| [7] | Guo Y, Zhao Y, Han M, et al. Codendrimer from polyamidoamine (PAMAM) and oligoethylene dendron as a thermosensitive drug carrier[J]. Bioconjugate Chem, 2014, 25(1):24–31. doi:10.1021/bc300560p |
| [8] | Guo Y, Zhao Y, Han M, et al. A codendrimer of PAMAM decorated with oligoethylene glycol dendrons:synthesis, self-assembly, and application as a drug carrier[J]. Soft Matter, 2013, 9(43):10306–10313. doi:10.1039/c3sm51401c |
| [9] | Wang Y B, Wang J C, Meng M, et al. Preparation and evaluation of docetaxel-loaded albumin nanoparticles for intravenous administration[J]. J Chin Pharm Sci, 2010, 19(3):214–222. |
| [10] | Sharma G, Wilson K, Van Der Walle C F, et al. Microemulsions for oral delivery of insulin:Design, development and evaluation in streptozotocin induced diabetic rats[J]. Eur J Pharm Biopharm, 2010, 76(2):159–169. doi:10.1016/j.ejpb.2010.07.002 |
| [11] | 蔡伟惠, 姚成丽, 居敏俐, 等. 丙泊酚纳米注射液中溶血磷脂的含量测定及溶血性评价[J]. 中国药学杂志, 2013,48(3):212–215. |
 2016, Vol. 39
2016, Vol. 39


