2. 清华大学生物力学与医学工程研究所, 北京 100084;
3. 中国科学院西北高原生物研究所, 青海 西宁 810000
2. Institute of Biomechanics and Medical Engineering, Tsinghua University, Beijing 100084, China ;
3. Northwest Institute of Plateau Biology, Chinese Academy of Science, Qinghai Xining 810008, China
藏药陈川西獐牙菜Swertia mussotii Franch.为龙胆科獐牙菜属植物,在藏药经典书籍《晶珠本草》中有所记载,为藏茵陈主要植物来源,具有保肝、抑菌与抗肿瘤等功效[1-2],民间多用于治疗各种热病[3]。近年来研究表明,藏茵陈类药用植物对淋巴瘤细胞、皮肤癌细胞与肝癌细胞等均有抑制作用[4-6],但尚无对胃癌细胞的抑制作用研究。基于此,本研究以川西獐牙菜为研究对象,采用甲醇进行回流提取,利用石油醚、醋酸乙酯、正丁醇对提取物进行萃取,获得不同的萃取部位;将川西獐牙菜各萃取部位作用于人胃低分化黏液腺癌细胞MGC-803,检测对胃癌细胞的抑制作用;随后通过流式细胞术研究正丁醇部位对MGC-803细胞周期分布的影响,并基于高效液相色谱-串联质谱技术(HPLC-MS/MS)对正丁醇部位有效化学成分进行研究,从而为该类药物作为潜在的抗瘤药物进行更深层次的研究奠定实验基础。
1 材料 1.1 药品与试剂川西獐牙菜,购自青海省西宁市药材市场,由中国科学院西北高原生物研究所梅丽娟研究员鉴定为川西獐牙菜Swertia mussotii Franch.的干燥全草;碘化丙啶(PI)、胰蛋白酶,均购自美国Sigma公司;RPMI 1640培养基、胎牛血清(FBS),均购自美国Hyclone公司;二甲基亚砜(DMSO)、四甲基偶氮噻唑蓝(MTT),均购自美国Ameresco公司;五氟尿嘧啶(5-Fu,上海旭东海普药业有限公司);其他化学药品均为分析纯。
1.2 细胞株人胃癌细胞MGC-803细胞株,购自中国科学院上海细胞生物研究所。
1.3 仪器与设备超净工作台(苏州净化设备公司);二氧化碳培养箱(德国Heraeus公司);倒置显微镜(日本Olympus公司);酶标仪(美国BIO-RAD公司);流式细胞仪(美国Beckman Coulter公司);Agilent 1200系列HPLC,G6410B三重四级杆LC/MS(美国Agilent公司)。
2 方法 2.1 样品的制备称取川西獐牙菜干燥药材200 g,粉碎并过筛;用10倍量甲醇加热回流提取3次,每次3 h,合并甲醇提取液,自然冷却,2 000 r/min离心10 min,上清液回收甲醇,浓缩至浸膏;浸膏加热水分散,用石油醚、醋酸乙酯、正丁醇依次萃取,减压浓缩,分别得到石油醚部位、醋酸乙酯部位、正丁醇部位、水部位以及甲醇总提取物部位,将上述各部位样品冻干,得石油醚部位4.66 g、醋酸乙酯部位4.10 g、正丁醇部位8.41 g、水部位5.23 g以及甲醇总提取物部位6.18 g,得率分别是2.3%、2.1%、4.2%、2.6%、3.0%,备用。
分别称取石油醚部位、醋酸乙酯部位、正丁醇部位、水部位和甲醇总提取物部位,用DMSO助溶,配制成2 mg/mL的母液,0.22 μm膜滤过除菌,于4 ℃储存,临用前用培养液稀释至所需浓度;实验DMSO浓度均未超过1%,而在此浓度下对细胞生长状况无影响,阴性对照组加入同浓度的DMSO培养液。
2.2 川西獐牙菜各部位对MGC-803细胞增殖的抑制作用(MTT法)取对数生长期MGC-803细胞,用RPMI 1640培养基调整细胞浓度至5×103个/mL的细胞悬液,接种于96孔培养板中,每孔200 μL,置于37 ℃、5% CO2饱和湿度培养箱中;培养12 h后加药,加入石油醚部位、醋酸乙酯部位、正丁醇部位、水部位和甲醇总提取物部位,每个浓度设6个复孔,分别设7个浓度梯度,终浓度分别为1 400、1 200、1 000、800、600、400、200 μg/mL,空白对照组加入等体积的RPMI 1640培养液,阴性对照组加入含同浓度DMSO的培养液,阳性对照组加含有25 μg/mL 5-Fu的培养液[7]。继续培养48 h后,于实验终止前4 h每孔加入20 μL MTT(5 mg/mL),继续孵育,待实验终止时,吸弃培养基,加入200 μL DMSO,震荡5 min,用酶标仪在570 nm处检测吸光度(A)值,实验重复3次。计算各部分对MGC-803的存活率。
存活率=给药组A值/空白对照组A值
2.3 川西獐牙菜正丁醇部位对MGC-803细胞形态的影响细胞接种情况同“2.2”项,培养12 h后加药,加入200、400、800 μg/mL正丁醇部位样品,对照组加入相同浓度的DMSO溶液,作用48 h后,普通光学显微镜观察细胞形态的变化。
2.4 流式细胞术检测正丁醇部位对MGC-803细胞周期变化的影响取对数生长期细胞,以1×105个/mL浓度接种于12孔培养板内,每孔2 mL,培养24 h。设对照组与正丁醇部位组,正丁醇部位组分别加入终浓度为600、400、200 μg/mL的正丁醇部位样品,对照组加入相同浓度的DMSO溶液,处理24 h。1 000 r/min离心5 min收集空细胞,冷PBS洗2次,调整细胞浓度为1×106个/mL;70%乙醇固定过夜;离心去除乙醇,PBS洗涤2次,10 μg/mL PI(PBS溶液,含0.2%Triton X-100、0.1 mmol/L EDTA和100 μg/mL RNase A)于室温暗处染色30 min,转入流式管,流式细胞仪检测,分析细胞周期分布。
2.5 HPLC-MS/MS分析正丁醇部位样品溶于乙腈溶液,流动相为:水(A)-乙腈(B);洗脱程序为:0~30 min,5%~85%(B);30~40 min,85%~95%(B);体积流量1 mL/min;柱温30 ℃;检测波长254 nm;电喷雾离子化(ESI)源;正离子检测;脱溶剂气(N2)体积流量9.0 L/min;扫描范围100~1 500m/z。
2.6 统计学方法采用SPSS 20.0统计软件对实验数据进行处理,计量资料以x±s表示,采用t检进行组间比较。
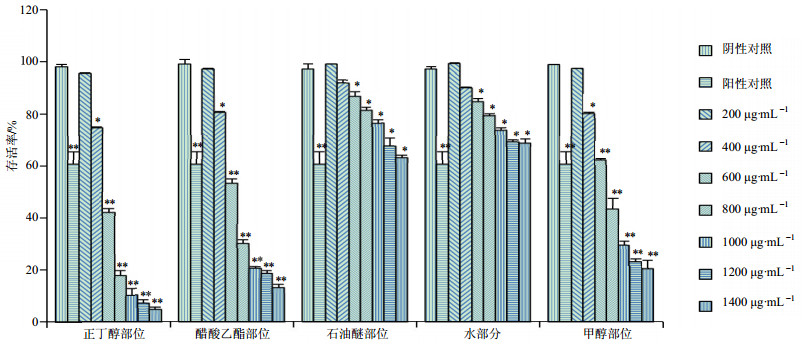
3 结果 3.1 人胃癌细胞MGC-803的增殖抑制实验川西獐牙菜水部位、石油醚部位、正丁醇部位、醋酸乙酯部位以及甲醇总提取物对MGC-803细胞均具有明显的抑制,且成良好的剂量相关性,与对照组比较差异显著(P<0.05、0.01)。正丁醇部位、醋酸乙酯部位、甲醇提取部位对MGC-803癌细胞株的增殖抑制效果好于石油醚部位和水部位;正丁醇部位的增殖抑制率与醋酸乙酯部位、甲醇提取部位比较,差异显著(P<0.05),且各部位浓度为600 μg/mL时,存活率分别为(42.4±1.30)%、(53.5±1.63)%、(62.4±0.55)%、(85.0±1.0)%、(86.9±1.70)%,结果表明正丁醇部位对人胃癌细胞MGC-803的增殖抑制效果最好。结果见图 1。
|
与阴性对照组比较:P<0.05 **P < 0.01 *P < 0.05 **P < 0.01 vs negative control group 图 1 川西獐牙菜各部位对人胃癌细胞MGC-803生存能力的影响(x±s, n=3) Fig. 1 Survival effect of S.mussotii extracts on MGC-803 cells (x±s, n=3) |
3.2 正丁醇部位对MGC-803细胞形态的影响
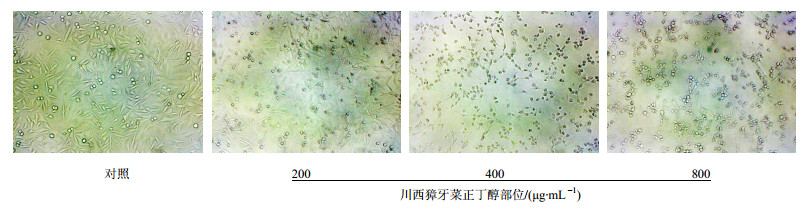
由图 2可知,对照组细胞贴壁生长,轮廓清晰;正丁醇浓度为200μg/mL时,细胞出现皱缩变圆和胞质空泡状改变,并随着浓度增加细胞变化显著,直至出现死亡;当浓度达800 μg/mL时MGC-803细胞几乎全部漂浮死亡。
|
图 2 川西獐牙菜正丁醇部位对人胃癌细胞MGC-803形态的影响 Fig. 2 Effect of BESM on morphological changes of MGC-803 cells |
3.3 正丁醇部位对MGC-803细胞周期分布的影响
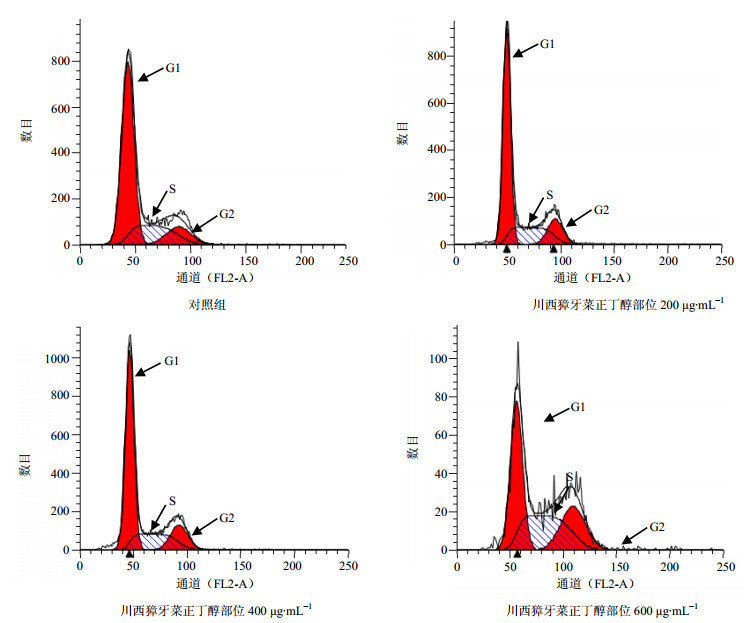
川西獐牙菜正丁醇部位在较高浓度下能够诱导人胃癌细胞MGC-803细胞周期阻滞,且成剂量相关性,流式细胞术检测结果见图 3。与对照组比较,600 μg/mL正丁醇部位作用后,S期比例显著增加(P<0.05);400、600 μg/mL正丁醇部位作用后,G1期比例显著降低(P<0.05、0.01),结果见表 1。
|
图 3 川西獐牙菜正丁醇部位对人胃癌细胞MGC-803周期分布的影响(x±s, n=3) Fig. 3 Effect of BESM on cell cycle changes of MGC-803 cells (x±s, n=3) |
| 表 1 川西獐牙菜正丁醇部位对人胃癌细胞MGC-803周期分布的影响(x±s, n=3) Table 1 Effect of BESM on cell cycle changes of MGC-803 cells (x±s, n=3) |
3.4 HPLC-MS/MS分析
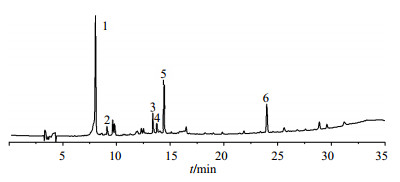
基于HPLC-MS/MS对正丁醇部位主要物质的化学成分进行了分析,HPLC色谱图如图 4所示,其中峰1~6的紫外和质谱数据详见表 2。
|
图 4 正丁醇部位HPLC色谱图 Fig. 4 Butanol extract HPLC chromatograms |
| 表 2 峰1~6的紫外和质谱数据 Table 2 UV and MS data of peaks 1—6 |
4 讨论
本研究首先采用MTT法进行川西獐牙菜不同萃取部位以及甲醇粗提物对人胃癌细胞MGC-803的细胞增殖抑制实验,结果表明正丁醇部位、乙酸乙酯部位以及甲醇提取物对MGC-803细胞均具有明显的抑制,且成良好的浓度依赖性,其中正丁醇部位抑制效果最佳。显微观察对不同浓度正丁醇部位样品对细胞形态的影响,同时通过流式细胞仪测定了样品处理后细胞周期的变化,结果发现,不同浓度的正丁醇部位样品作用于细胞48 h后,可影响细胞周期的正常进行,G1期细胞百分比例下降,S期细胞百分比例上升,说明药物处理后细胞周期阻滞在S期,且随着药物浓度增加而增加。
通过HPLC-MS/MS对样品化学成分的分析结果表明,正丁醇部位样品含有1, 7, 8-三羟基-3-甲氧基呫吨酮、1, 8-二羟基-3, 5-二甲氧基呫吨酮、1, 3, 6, 7-四羟基呫吨酮-2-β-D-葡萄糖、2'-间羟基苯甲酰獐牙菜苷、獐牙菜苷-6'-O-葡萄糖和1-羟基-2, 3, 5-三甲氧基呫吨酮-1-O-[β-D-吡喃木糖(1-6)-β-D-吡喃葡萄糖],与文献中报道的川西獐牙菜或獐牙菜属植物化学成分基本一致。已有文献报道,藏茵陈类印度獐牙菜苦苷粗提物和獐牙菜苦苷均能有效减轻二甲基苯蒽诱导小鼠皮肤乳头瘤的发生率[11];川东獐牙菜正丁醇部位对肝癌细胞HepG2具有抑制作用,其物质成分中含有獐牙菜苦苷以及其他苦苷类成分[13];藏茵陈类湿生扁蕾中的4种酮类化合物对人肝癌细胞株HepG2抑制作用呈明显的剂量和时间依赖型[14]。本研究结果表明,川西獐牙菜正丁醇部位的主要成分为呫吨酮类,其可能构成了川西獐牙菜抗肿瘤药效物质基础。
本课题组将继续对川西獐牙菜正丁醇部位的化学成分及其抗肿瘤活性进行研究,明确川西獐牙菜抗肿瘤的物质基础,并对其作用机制等进行深入研究。
| [1] | 蒂玛尔·丹增彭措, 等. 晶珠本草[M]. 上海: 上海科学技术出版社, 1988 . |
| [2] | 孟宪华, 陈德道, 张樱山, 等. 川西獐牙菜的化学成分、药理作用和临床应用研究进展[J]. 现代药物与临床, 2012,27(2):176–179. |
| [3] | 唐丽, 金振南, 门美佳, 等. 藏药藏茵陈的研究进展及开发利用[J]. 中央民族大学学报:自然科学版, 2007,16(2):176–178. |
| [4] | 丁丁.芒果苷对淋巴瘤Rsiji细胞增殖、侵袭及相关因子Tiaml表达的影响[D].南宁:广西医科大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10598-1011088408.htm |
| [5] | Saha P. Evaluation of the anticarcinogenic activity of Swertia chirata Buch. Ham, an Indian medicinal plant, on DMBA-induced mouse skin carcinogenesis mode[J]. Phytother Res, 2004, 18(5):573–378. |
| [6] | 黄华艺, 农朝赞, 郭凌霄. 芒果甙对肝癌细胞增殖的抑制和凋亡的诱导[J]. 中华消化杂志, 2002,6(22):341–343. |
| [7] | 韦尉元, 吴琨, 王晓通, 等. 5-Fu联合人参黄芪复方对人胃癌MGC-803细胞生物学行为的影响[J]. 中国中西医结合杂志, 2012,32(12):1647–1651. |
| [8] | 尚军, 张国燕, 杨淳彬, 等. 川西獐牙菜的化学成分研究[J]. 青海师范大学学报:自然科学版, 2008,4(4):66–67. |
| [9] | 孔德云, 蒋毅, 姚英, 等. 伸梗獐牙菜的苷类成分[J]. 中草药, 1995,26(1):7–10. |
| [10] | 李干鹏, 曾思为, 黄飞燕, 等. 西南獐牙菜的化学成分研究[J]. 云南民族大学学报:自然科学版, 2011,20(5):350–352. |
| [11] | 王世盛, 徐青, 肖红斌, 等. 抱茎獐牙菜中的苷类成分[J]. 中草药, 2004,38(8):847–850. |
| [12] | Saha P, Mandal S, Das A, et al. Amarogentin can reduce hyperproliferation by downregulation of Cox-Ⅱ and upregulation of apoptosis in mouse skin carcinogenesis model[J]. Cancer Lett, 2006, 244(2):252–259. doi:10.1016/j.canlet.2005.12.036 |
| [13] | 赵李剑, 左泽乘, 邹洪波, 等. 川东獐牙菜苦甙类成分的提取及其体外抗肿瘤作用研究[J]. 中医药导报, 2006,12(5):62–64. |
| [14] | Lan D, Liu B, Zhang S D, et al. Cytotoxicity, apoptosis-inducing effects and structure-activity relationships of four natural xanthones from Gentianopsis paludosa Ma in HepG2 and HL-60 cells[J]. Nat Prod Res, 2011, 25(7):669–683. doi:10.1080/14786410802497398 |
 2016, Vol. 39
2016, Vol. 39


 ,
,