2. 天津药物研究院有限公司, 天津 300193
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性系统性自身免疫疾病[1],好发于对称分布的腕、踝等小关节,具有病程长、致残率高、预后差的特点,严重时可出现程度不等的关节畸形、骨骼肌萎缩甚至终身残疾。
基因表达谱芯片主要是利用分子生物学中的核酸分子碱基之间互补配对的原理,与传统的核酸杂交相比更加高效、准确。目前已广泛应用于临床疾病的筛查、诊断、疾病相关基因的发现,药物的作用机制及药物筛选等等领域[2-4]。
Ⅱ型胶原免疫大鼠诱发的关节炎模型(CIA)是接近人类RA较理想的关节炎模型之一[5],目前研究热点在于CIA模型动物滑膜细胞基因的表达研究。RA的发生发展是一个多基因表达失常的复杂过程,现代医学对于RA具体发病机制尚不明确。但有研究显示,在人类和动物发生感染或出现炎症反应时,众多的肝源性蛋白参与了炎症反应的病理生理过程。研究RA发病过程中肝源性蛋白表达的变化可能有助于研究RA的发病机制及寻找治疗靶点。通过基因芯片技术对CIA大鼠模型组与对照组的肝细胞基因差异性进行筛选和研究分析比较,从众多基因中聚类分析,寻找关于CIA的致病靶基因。
1 实验材料 1.1 实验动物健康雄性Wistar大鼠,SPF级。动物合格证号:SCXK(津)2009-0001。由天津市山川红实验动物科技有限公司繁殖提供。体质量120~140 g。
1.2 主要试剂鸡源性Ⅱ型胶原(Sigma,批号020M4059);弗氏完全佐剂(Sigma,批号050M8702);GeneChip 3’IVT Express Kit(Affymetrix,批号0909015);Rneasy Mini Kit(QIAGEN,批号136232630);Nuclease-free Water(Ambion,批号0908151);Water, Molecular Biology Grade(Cambrex,批号0000077674);Bovine Serum Albumin (BSA) solution (50 mg/mL),Invitrogen Life Technologies(批号665042);Herring Sperm DNA(Promega Corporation,批号27354408);5 mol/L NaCl(Ambion,批号10040100);MES hydrate SigmaUltra(Sigma-Aldrich,批号065K54051);MES Sodium Salt(Sigma-Aldrich,批号097K54241);EDTA Disodium Salt, 0.5 mol/L solution(Sigma-Aldrich,批号0808006);DMSO(Sigma-Aldrich,批号108K0185);10%Surfact-Amps 20(Tween-20)(Pierce Chemical,批号KD132406);R-Phycoerythrin Streptavidin [Molecular Probes,批号673582(S866)];20X SSPE [Cambrex,批号0000151031(51214)];Goat IgG, Reagent Grade [Sigma-Aldrich,批号047K7435(I5256)];Anti-streptavidin antibody(goat),biotinylated,Vector Laboratories [V0430(BA-0500)];MOPS, Free Acid, MB Grade,Calbiochem,D00070894(475922);Bleach(5.25% Sodium Hypochlorite)500 mL,Sigma-Aldrich,050K0237(239205);Agarose,BBI,GS1024B1008C;GelRed,BIOTIUM,10G0318。
1.3 主要仪器实验平台:本实验所采用的是Affymetrix GeneChip 3000 TG System,具体包括:Scanner 3000 7G 4C with Autoloader,Scanner 3000 Workstation,Fluidics Station 450,Hybridization Oven 640;DK型电热恒温水浴锅(上海精宏实验设备有限公司);QZX-C空气浴振荡器(哈尔滨市东明医疗仪器厂);Heatblock(CHB-202 & HB-202)(杭州博日);Gel Electrophoresis Unit(北京六一仪器厂);GeneAmp PCR System 9700金版(Applied Biosystems);Centrifuge(5415D)(Eppendorf);磁力架(Invitrogen);Sterile, RNase-free, microcentrifuge vials, 1.5 mL,Axygen;Sterile, RNase-free, microcentrifuge vials, 0.2 mL,Axygen;Micropipettors(P-2.5, P-10, P-20, P-100, P-200, P-1000)(Eppendorf);Sterile-barrier, RNase-free pipette tips,Axygen;powder-free gloves,Sfsci;Centrifuge Tube(15 mL, 50 mL),Corning;0.2 μm filter,Millipore;Tough-Spots,USA Scientific;芯片类型:Affymetrix Rat-2.0 microarray;分析软件:dChip(Dec.2009 version)。
2 实验方法随机选取体质量120~140 g的雄性Wistar大鼠20只,对照组及模型组每组各10只。按文献方法[6]建立胶原关节炎模型大鼠,将鸡Ⅱ胶原(CII)溶于0.1 mol/L冰醋酸中,质量浓度为2 mg/mL,在2~8℃下搅拌使之充分溶解,置于2~8℃冰箱中过夜。在冰浴条件下在CII中加入等体积的CFA,并使二者充分乳化。模型组每只大鼠背部及尾部皮内多点注射0.5 mL CII佐剂混合乳液(1 mg/mL),对照组大鼠皮内注射等量0.05 mol/L冰醋酸。7 d后同法再次免疫。
3 测定指标 3.1 关节肿胀度从加强免疫后第4天起,测每只大鼠左后足踝周长,2次/周,连续测量6次,以左后足踝周长作为肿胀度观察指标。
3.2 全身表现评分、关节肿胀数、关节炎指数于造模后第25天参考文献[7]对全身的继发性病变全身表现进行评分(表 1),每只动物的评分相加得全身表现评分,最大评分8分。计算关节肿胀数及关节炎指数。
| 表 1 胶原关节炎模型继发性病变全身表现评分标准 Table 1 Scoring criteria of systemic manifestations of secondary lesions in collagen arthritis model |
胶原关节炎模型关节肿胀数评分标准:每只足趾计一个踝关节和5个指(趾)关节,每只鼠最多24个关节肿胀。
胶原关节炎模型关节炎指数评分标准:0分为正常;1分为踝关节出现红斑和轻微肿胀;2分为踝关节到趾、掌关节出现红斑和轻微肿胀;3分为踝关节到趾、掌关节出现红斑和中度肿胀;4分为踝关节到趾关节出现红斑和重度肿胀。最大评分为16分。
3.3 关节病理观察于末次给药后1 h,麻醉大鼠,腹主动脉取血后取所有动物的左后足踝关节,12%甲醛溶液固定,脱钙,酒精逐级脱水,二甲苯透明,石蜡包理,切片,HE常规染色。光镜下观察滑膜、软骨、骨的病理改变。
3.4 肝组织基因芯片表达于再次免疫后25 d,麻醉后打开腹腔,取肝组织保存于液氮中。各样品提取并纯化总RNA,利用T7-(dT)24做为引物,在反转录酶的作用下,由RNA反转录成单链cDNA,同时掺入poly-A control,42℃反应2 h,以所合成的单链cDNA为模板,RNA片段为引物,在DNA Polymerase作用下合成双链DNA,并两端补平,16℃反应1 h,65℃反应10 min。合成并纯化aRNA后,将aRNA片段化、配制杂交液,进行芯片杂交、洗脱、扫描,采用dChip(Dec.2009 version)分析软件lower bound fold change方法分析表达差异1.5倍以上基因,差异表达基因包括:(1)对照组肝细胞和模型组肝细胞中均存在;(2)对照组肝细胞中未表达,仅在模型组肝细胞表达的;(3)在对照组中表达较高,但模型组不表达的。芯片类型:GeneChip Rat Genome 230, 基因库为Affymetrix Gene,参考GenBank基因库,功能通路参考KEGG数据库。
4 统计方法采用SPSS 11.5 One-Way ANOVA(单因素方差分析,LSD)对计量数据进行统计分析;采用dChip(Dec.2009 version)分析软件lower bound fold change方法分析表达差异1.5倍以上基因;采用Excel对差异表达基因按功能分类、差异表达基因按通路分类等作图。
5 结果 5.1 关节肿胀度由表 2可见,与对照组比较,模型组大鼠注射足对侧在加强免疫后第4天即出现明显的肿胀,在第14天达到肿胀高峰,出现了严重的踝关节及趾关节肿胀变形,踝关节周长显著增加,证明CIA大鼠造模成功。
| 表 2 两组大鼠左后足踝关节周长的比较(x±s,n=10) Table 2 Comparison on left ankle circumference between two groups (x±s, n=10) |
5.2 全身表现评分、关节肿胀数、关节炎指数
全身表现评分、关节肿胀数、关节炎指数结果显示(表 3),与对照组比较,模型组大鼠耳、鼻、尾、前爪及后爪有显著的继发性病变,耳廓有显著的结节、发红,鼻端结缔组织肿胀明显,尾部有结节,前爪发红,部分前爪趾关节肿胀,后爪肿胀明显。
| 表 3 CIA大鼠继发全身性病变评分(x±s,n=10) Table 3 Secondary systemic lesion scores of CIA rats (x±s, n=10) |
5.3 关节病理观察
对照组大鼠踝关节结构正常,滑膜组织无充血水肿,滑膜细胞无增生现象,无血管翳形成,关节软骨表面光滑平整,无剥脱现象,关节软骨下骨小梁大小、排列正常。模型组大鼠踝关节可见明显的滑膜细胞增生,排列紊乱,滑膜组织充血水肿,毛细血管增生,并可见炎细胞浸润;增生的滑膜组织形成绒毛状,伸向关节腔,或向软骨面爬行形成血管翳。关节软骨剥脱,可见关节腔内有剥脱的关节软骨及滑膜组织。见图 1。
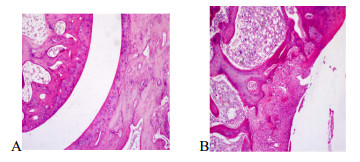
|
图 1 ig给药3周对照组(A)和模型组(B)大鼠的踝关节图 Fig. 1 Ankle joint of control group (A) and model group (B) after ig administration for 3 weeks |
5.4 肝组织基因芯片检测结果
结果显示,共筛选出模型组与对照组肝组织表达显著差异的基因1 009个,其中480种基因表达水平上调,529种基因表达下调;(1)对照组和模型组都表达的基因有708个,其中上调基因332个,下调基因376个;(2)对照组未表达,仅模型组表达的基因有148个;(3)在对照组中表达较高,但模型组不表达的基因有153个。结果说明RA的发病是多因素多基因共同作用的结果。模型组与正常组肝组织差异表达的1 009种基因可能参与了RA的发生和发展,对以上基因进行研究有助于阐明RA的发病机制和找到新的疾病相关靶点。
差异表达基因按功能分类统计见图 2,代谢及信号通路统计见图 3。由图 2、3可知,与对照组比较,模型组差异表达基因主要涉及生物过程调控、刺激反应、细胞通信、细胞周期的负调控、免疫反应、应激反应、血管生成、内皮细胞分化等功能。涉及的代谢及信号通路主要包括细胞凋亡通路、钙调节通路、TGF-β通路、凝血功能通路、炎症反应通路等。其中涉及炎性反应、免疫应答、增殖侵袭、细胞周期调控等多种病理过程。
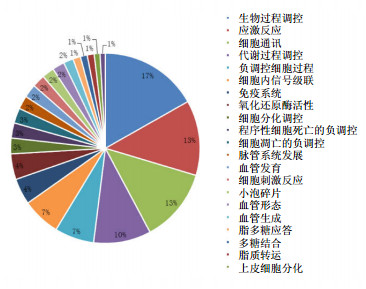
|
图 2 差异表达基因按功能分类 Fig. 2 Differentially expressed genes by functional classification |
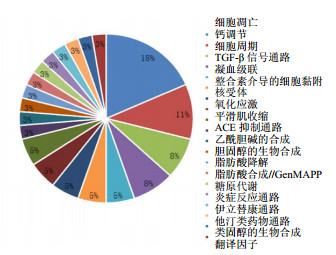
|
图 3 差异表达基因按代谢及信号通路分类 Fig. 3 Differentially expressed genes by pathway |
上调基因包括:Aldh1a7、Bad、Gdf10、Ccar2、Slc1a3、Il1b(IL-1β)、Il7(IL-7)、Vegfb、IgG-2a、RGD1564865、A2m等,其中Aldh1a7上调最显著。上调的基因中有许多如Aldh1a7、Ccar2、Vegfb都与RA的类肿瘤性质相关,如细胞增殖、黏附、细胞周期调控及侵袭。Chou等[8]对人膝关节胫骨平台进行RNA表达检测,结果显示Gdf10基因与关节软骨退变及软骨下骨病理学结构改变有关,Slc1a3、免疫相关的RGD1564865、Il1b参与炎症反应通路;凝血功能通路的蛋白酶抑制剂A2m,亦可调节控制炎症反应[9]。
下调基因包括:Ugt2b、Mx2、Usp18、Comt、Zfp354a、Oas1a、G1p2、Irf7、1Akr1c1、Ppp1r3c、Dusp1等,其中Ugt2b下调最显著。具有免疫调节功能的干扰素Mx2、干扰素调节因子Irf7能对干扰素所有反应进行调节,被认为是依赖于I型干扰素的免疫反应的重要调节者,泛素特异性蛋白酶Usp18、儿茶酚-O-甲基转移酶Comt、2’-5’寡腺苷酸合成酶Oasla、Ⅱ型成对免疫球蛋白样受体、参与炎症反应通路的醛-酮还原酶1c家族1Akr1c1、蛋白磷酸酶I、Ppp1r3c、Dusp1在细胞内主要催化已活化的MAPK家族成员(p38、JNK、ERK)特异性基序TxY中磷酸基团的水解,抑制其活性,从而减轻炎症反应[10]。
由结果可知(表 4、5),模型组在关节炎发生过程中,应激反应相关蛋白启动,并进一步引起免疫反应、血管生成、细胞凋亡、物质代谢等相关蛋白基因表达变化。
| 表 4 模型组部分表达上调基因 Table 4 Partial expression up regulated gene of model group |
| 表 5 模型组部分表达下调基因 Table 5 Partial expression down regulated gene of model group |
6 讨论
以胶原诱导性关节炎为研究对象,利用基因表达谱芯片技术寻找在RA发展过程中表达发生变化的基因,试从结果中寻找与RA发病机制相关的关键分子。
6.1 对Aldh1a7的影响值得注意的是Aldh1a7上调最显著,Aldh1a7是存在于细胞内具有解毒作用的醛脱氢酶,是新发现的肿瘤干细胞标记分子,具有自我更新能力和侵袭能力。该基因过表达可能与肿瘤患者预后差、转移率高有关,推测Aldh1a7增殖与侵袭转移方面的特性可能与RA的异常增殖的类肿瘤性质以及对软骨的侵袭破坏有关。因此设想,该分子可能成为今后RA治疗中的又一新的待选靶点。
6.2 对Ugt2b的影响二相代谢酶Ugt2b(UDP糖基转移酶2家族,多肽B)下调最显著。同一个功能蛋白会有好几个基因位点表达,可能为同工酶。文献报道[11],佐剂诱导的关节炎模型中,大鼠注射佐剂后3 d,肝组织Ugt2b的mRNA水平显著下降,Ugt2b可能参与RA发病。研究表明,Ugt2b主要参与戊糖、葡萄糖醛酸转换、抗坏血酸代谢、甾体(雌激素、雄激素)激素代谢、维生素A的代谢、细胞色素P450的异物代谢等。Aldh1a7参与维生素A代谢,代谢产物是视黄酸盐(Retinoate),而Ugt2b则将视黄酸盐进一步代谢为Retinoyl-β-glucuronide。Aldh1a7上调,Ugt2b下调会导致视黄酸盐增加。维生素A、视黄酸盐、Aldh1a7、Ugt2b在RA的发病中参与的作用及机制尚不明确,还有待于进一步研究。通过对TGF-β激活激酶1(TAK1)-TAK1结合蛋白1(TAB 1)复合物的去泛素化调节,UsP18可调控T细胞的活化和T辅助细胞179(Th17)的分化[12],故UsP18可能成为治疗自身免疫性疾病的重要靶点。
6.3 对IL-7的影响模型组基因IL-7上调,RA的发病机制与多种细胞因子有着密切的关系,其中IL-7是促炎症性细胞因子,同时也是一种强有力的趋化因子[13-19],可加重炎症反应,通过激活IL-7R发挥生理学效应,IL-7和IL-7R与多种自身免疫性疾病如多发性硬化症、RA等关系密切。IL-7负责维持T细胞的动态平衡,它通过上调Bcl,抑制T细胞凋亡,从而增加TH-1和TH-17细胞,此外,IL-7还可以促进T细胞增殖、产生细胞因子。在RA患者的单核细胞可以检出高水平的IL-7、IL-7R及肿瘤坏死因子-α(TNF-α)。过度增殖的滑膜细胞与炎性细胞及小血管形成血管翳。TNF-α是一种能促进IL-7表达的免
疫调节和炎症刺激因子。最新研究表明TNF-α启动子区-308过高表达可影响RA的发生发展和预后[20-21]。在RA疾病中找到TNF-α高表达的基因位点及其基因型对于RA治疗有重要意义。IL-7作用于滑膜的巨噬细胞分泌细胞因子,还可以促进单核细胞归巢,破骨细胞分化和血管化,参与RA病人滑膜的病变过程,推测IL-7、IL-7R是治疗RA的潜在靶点。
6.4 对A2M的影响作为血浆主要蛋白成分之一,A2M主要在肝脏中合成,是一种广谱的蛋白酶抑制剂,它与凝血通路有着密切的关系,在调节凝血和纤溶平衡中发挥重要作用[22]。A2M是天然的抗凝物质,在发生急性炎症时在血清中含量会发生变化。A2M在调节和控制炎症反应中也起着重要的作用,在Payutichi等[23-24]的研究中发现,它可调节众多细胞因子的分布和活性,包括转化生长因子-β(TGF-β)、TNF-α、血小板衍生生长因子(PDGF)、白细胞介素-6(IL-6)、神经生长因子(NGF)、成纤维细胞生长因子(BFGF)和白细胞介素-1β(IL-lβ)。
6.5 对其他免疫反应相关基因的影响数据显示,凋亡蛋白Bad(Bcl拮抗剂)表达显著上调,Bad可以抑制Bcl,具有促凋亡作用,但目前Bad在RA发病中的参与机制尚不清楚。结果表明,模型组大鼠肝组织IL-1β、Cxcl1、Irf1、IgG-2a、Igh-6、Lbp基因表达上调,其中IL-1β、Lbp为免疫炎症相关蛋白,可导致关节滑膜和软骨的炎性病变。IgG-2a上调提示机体倾向细胞免疫反应。Igh-6的过表达机体可出现免疫抑制。Cxcl1、Irf1过表达提示RA具有类肿瘤的特性即过度侵袭和增殖能力。
类风湿性关节炎(RA)是一个涉及到炎症、异常的自身免疫反应、类肿瘤样细胞改变等多个环节和过程,其中涉及庞大复杂的信号转导网络的调控。目前对于众多基因的表达情况及其对滑膜增生抑制或促进作用,未有详尽的文献报道。细胞因子的生物学研究将有助于对RA发病机制的认识。应用于RA的治疗提供有力的理论依据,开发其临床应用的新领域,以减少RA骨破坏,改善预后。
| [1] | Komatsu N, Takayanagi H. Autoimmune arthritis:the interface between the immune system and joints[J]. Adv Immunol, 2012, 115:45–71. doi:10.1016/B978-0-12-394299-9.00002-3 |
| [2] | Arango B A, Rivera C L, Glück S. Gene expression profiling in breast cancer[J]. Am J Transl Res, 2013, 5(2):132–138. |
| [3] | Villase or-Park J, Ortega-Loayza A G. Microarray technique, analysis, and applications in dermatology[J]. J Invest Dermatol, 2013, 133(4):e7. |
| [4] | Campo E. Whole genome profiling and other high throughput technologies in lymphoid neoplasms——current contributions and future hopes[J]. Mod Pathol, 2013, 26(Suppl 1):S97–S110. |
| [5] | 王淑月. 抗类风湿性关节炎的药物研究[J]. 中国临床康, 2004,27:5956–5957. |
| [6] | 刘静, 王晶晶, 邸志权, 等. 胶原诱导性关节炎大鼠淋巴细胞基因表达的变化[J]. 药物生物技术, 2013(2):115–123. |
| [7] | 徐叔云, 卞如濂, 陈修. 药理实验方法学[M].第三版. 北京: 人民卫生出版社, . |
| [8] | Chou C H, Lee C H, Lu L S, et al. Direct assessment ofarticular cartilage and underlying subchondral bone reveals a progressive gene expression change in human osteoarthritic knees[J]. Ost Cart, 2013, 21(3):450–461. doi:10.1016/j.joca.2012.11.016 |
| [9] | 冯仁丰. 急性相和C反应蛋白[J]. 上海医学检验杂志, 1999,14(5):258–260. |
| [10] | Lei Y Y, Wang W J, Mei J H, et al. Mitogen-activated protein kinase signal transduction in solid tumors[J]. Asian Pac J Cancer Prev, 2014, 15(20):8539–8548. doi:10.7314/APJCP.2014.15.20.8539 |
| [11] | Kawase A, Wada S, Iwaki M. Changes in mRNA expression and activity of xenobiotic metabolizing enzymes in livers from adjuvant-induced arthritis rats[J]. Pharmacol Pharm, 2013, 4:478–483. doi:10.4236/pp.2013.46069 |
| [12] | Liu X, Li H, Zhong B, et al. USP18 in hibs NF-κB and NFAT activation during TH17 differentiation by deubiq-uitinating the TAK1-TAB1 complex[J]. Exp Med, 2013, 210(8):1575–1590. doi:10.1084/jem.20122327 |
| [13] | Chen Z L, Kim S J, Nathan D. The novel role of IL-7 ligation to IL-7 receptor in myeloid cells of rheumatoid arthritis and collagen-induced arthritis[J]. J Immunol, 2013. doi:10.4049/jimmunol.1201675 |
| [14] | Haas J M, Korporal A, Schwarz B, et al. The interleukin-7 receptor a chain contributes to altered homeostasis of regulatory T cells in multiple sclerosis[J]. Eur J Immunol, 2011, 41(3):845–853. doi:10.1002/eji.201041139 |
| [15] | Churchman S M, Ponchel F. Interleukin-7 in rheumatoid arthritis[J]. Rheumatology, 2008, 47:753–759. doi:10.1093/rheumatology/ken053 |
| [16] | Liu X, Leung S, Wang C, et al. Crucial role of interleukin-7 in T helper type 17 survival and expansion in autoimmune disease[J]. Nat Med, 2010, 16:191–197. |
| [17] | van Roon J A, Hartgring S A, Wenting-van Wijk M, et al. Persistence of interleukin 7 activity and levels on tumour necrosis factor alpha blockade in patients with rheumatoid arthritis[J]. Ann Rheum Dis, 2007, 66:664–669. doi:10.1136/ard.2006.062547 |
| [18] | Standiford T J, Strieter R M, Allen R M, et al. IL-7 up-regulates the expression of IL-8 from resting and stimulated human blood monocytes[J]. J Immunol, 1992, 149:2035–2039. |
| [19] | Alderson M R, Tough T W, Ziegler S F, et al. Interleukin7 induces cytokine secretion and tumoricidal activity by human peripheral blood monocytes[J]. J Exp Med, 1991, 173:923–930. doi:10.1084/jem.173.4.923 |
| [20] | Kang J H, Park D J, Lee J W, et al. Drug survival rates of tumor necrosis factor inhibitors in patients with rheumatoid arthritis and ankylosing spondylitis[J]. J Korean Med Sci, 2014, 29:1205–1211. doi:10.3346/jkms.2014.29.9.1205 |
| [21] | De Vries-Bouwstra J K, Dijkmans B A, Breedveld F C. Biologics in early rheumatoid arthritis[J]. Rheum Dis Clin North Am, 2005, 31:745–762. doi:10.1016/j.rdc.2005.07.003 |
| [22] | Harpel P C, Mosesson M W. Degradation of human fibrinogen by plasma a2-macroglobuIin-enzyme complexes[J]. J Clin Inv, 1973, 52(9):2175. doi:10.1172/JCI107402 |
| [23] | Panyutich A, Ganz T. Activated alpha 2-macroglobulin is a principaldefensin-binding protein[J]. Am J Resp Cell Mol Biol, 1991, 5(2):101–106. doi:10.1165/ajrcmb/5.2.101 |
| [24] | LaMarre J, Wollenberg G, Gonias S, et al. Cytokine binding and clearanceproperties of proteinase-activated alpha 2-macroglobulins[J]. Lab Inv, 1991, 65(1):3–14. |
 2016, Vol. 39
2016, Vol. 39


