美国食品药品管理局(FDA)于2015年10月发布了“多剂量、单剂量和单一患者用容器包装的人用注射药品的合适包装类型术语的选择和标识建议行业指导原则(草案)”[1]。该指导原则特别介绍了FDA修订的“单剂量”和“多剂量”容器的定义,并引入了一个新的包装类型术语“单一患者用”容器的定义。该指导原则涉及注射药品的下列上市申请:新药申请(NDA)、简化新药申请(ANDA)、生物制品许可证申请(BLA)、上市前批准申请(PMA)和上市前通知(Premarket Notification)。而我国目前尚无这类指导原则。本文介绍该指导原则的主要内容,以期对我国制药企业严谨且合理地使用注射药品的包装类型术语、药品监管部门加强这方面的管理并制定相关指导文件有所帮助。
1 背景不安全的注射方法(包括对一个以上的患者不正确使用针头、注射器和用药瓶)可威胁患者安全并可导致多种血源性细菌和病毒感染暴发。如果使用单剂量容器不当,内容物被污染,然后将这些内容物给多个患者使用,细菌感染则可传播给更多的患者。不遵守常规预防措施和无菌操作也与多剂量药瓶相关的数次感染暴发有关。单剂量和多剂量药瓶的这类事件的案例包括:1998-2008年,不安全注射方法所致的血源性病原体由患者传播给患者,导致美国非医院卫生保健机构33次病毒性肝炎暴发[2];美国疾病控制和预防中心报道,5年间涉及门诊不当使用药物至少发生26起事件,导致95 000多患者暴露于感染性疾病[3];2002年Oklahoma疼痛诊所因不安全地使用针头/注射器,引起71例丙型肝炎病毒(HCV)和31例乙型肝炎病毒(HBV)感染[4];2008年美国内华达州的HCV暴发调查显示,多个患者重复使用注射器和多个患者使用一次性药瓶是HCV感染传播的可能原因[5]。
从上述案例不难看出,以往由于用于单个患者的单剂量容器被用于多个患者,造成了许多细菌和病毒感染的暴发。此外,还有一种担心,即现有的包装类型术语没有充分表达某些提供多剂量的容器(如,胰岛素笔)仅可用于单一患者[6]。
2 包装类型术语的定义作为药品审评工作的一部分,FDA批准包装类型术语和丢弃说明作为注射药品说明书的一部分。FDA认为人用注射药品统一使用正确的包装类型术语和丢弃说明将促进其正确使用,并为减少血源性病原体传播的教育工作提供基础。下面说明人用多剂量、单剂量和单一患者用的注射药品和生物制品以及作为医疗器械管理的某些注射用组合产品合适的包装类型术语。
“单剂量”容器和“多剂量”容器的包装类型术语已使用很长时间。为明确这些术语使用的目的,其定义修订如下:
2.1 单剂量容器单剂量容器(Single-Dose Container)是肠胃外给药(注射或滴注)的无菌药物容器,不需要符合抑菌效力检查的要求。单剂量容器是为单一患者单次注射/滴注使用而设计的。如果空白允许,单剂量容器本身应做这些标识并且在标签上应该包含恰当的丢弃说明。单剂量容器实例为小瓶、安瓿和预充式注射器。
2.2 多剂量容器多剂量容器(Multiple-Dose Container)是肠胃外给药(注射或滴注)的无菌药物容器,应符合抑菌效力检查的要求,或按照FDA规定排除了这种检查要求。
多剂量容器包含有多次使用剂量的药品。如果空白允许,多剂量容器本身应做这些标识。多剂量容器一般含有30 mL或更少的药物。对于1个打开的或进入的(如针穿刺)多剂量容器,失效期(The beyond-use date,BUD)为28天,除非生产商在标签上另有规定。多剂量容器实例为小瓶。
2.3 单一患者用容器在绝大多数情况下,包装类型的术语“单剂量”和“多剂量”能正确使用。然而,在某些罕见的情况下,包装内含有用于单一患者的多个剂量的药品。这种包装类型药品中不含防腐剂,如果检测,可通过抑菌效力检查,但是这种包装类型却包含多个剂量。如,包装在患者自控镇痛盒内的鞘内注射用药品。因为这种包装类型是为多个剂量给药而设计的,所以这种包装类型用“单剂量”术语不恰当。然而,这种包装类型用“多剂量”术语也不合适,因为包装内容物不能达到抑菌效力检查的要求。
在其他一些情况下,这种包装类型的药品含有防腐剂(如果检测,预计可通过抑菌效力检查),可是这种包装类型是限制用于单一患者。在这种情况下,将这种包装类型称为“多剂量”不能充分表达限制用于单一患者的目的。这种产品的实例是供单一患者使用的多个剂量胰岛素的胰岛素笔。
在过去,FDA用“单用”容器来描述含有多个剂量却只用于单一患者的包装类型。很遗憾,“单用”术语被不恰当地使用,好像可以与“单剂量”术语互换,而这并不是FDA的本意。为了扭转这种术语的混乱,FDA撤销“单用”术语,并创造了一个新的包装类型术语“单一患者用”容器,以满足描述含有多个剂量却仅用于单一患者的注射药品包装的需要。
单一患者用容器(Single-Patient-Use Container)是肠胃外给药(注射或滴注)的无菌药物的容器,目的是供单一患者多次使用。如果空白允许,单一患者用容器本身要做这些标识,并且应在标签上包含恰当的丢弃说明。单一患者用容器的实例是患者自控镇痛盒和一些注射笔。
对于多剂量和单一患者使用容器,抑菌效力检查试验结果(如果进行检测),将用于支持标识失效期或丢弃说明。
图 1说明该如何确定注射药品恰当的包装类型术语。需要注意的是,使用术语“单剂量”容器并不意味着容器的全部内容物为单次剂量。在某些情况下,单剂量容器可能含有超过单次剂量所需的药物。如,根据体质量给药或因需要过量充装小瓶和安瓿的药品,容器内可超过一次的剂量,多余的量应丢弃。可参阅FDA的“注射药品和生物制品允许容积过量和标识填充量行业指导原则”[7]。此外,虽然滴注容器(容积或大或小)是在一段较长时间内给药,但仍被认为是单剂量容器,因为其设计是用于单一患者一次滴注的。
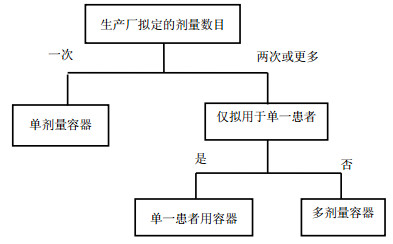
|
图 1 确定注射药品合适包装类型术语示意图 Fig. 1 The schematic diagram of determination appropriate package type term for an injectable medical product |
3 包装类型术语的标识要求和建议
申请人应确定恰当的人用注射药品包装类型术语(“单剂量”、“多剂量”或“单一患者用”)并且标识从始至终均只使用该正确的包装类型术语。FDA建议,合适的包装类型术语要出现在人用注射药品标识的所有部分,这样可令使用者很容易识别包装类型,包括容器标签和纸盒上,以及当可行时处方说明书(prescribing information)中。处方说明书中可出现包装类型术语的部分包括但不限于:用法用量、剂型和规格、性状以及如何供应/贮藏和处理。
如果空白允许,包装类型术语“单剂量”应出现在具有美国药典(USP)专论的单剂量注射用药品的容器标签上。如果容器标签没有充足的空白来包含这种信息,它必须出现在纸盒或其他外包装容器或包装纸上(如果空白允许),或者包含在处方说明书中。根据FDA的经验,在纸盒标签上总是有足够的空白来包含这种信息。
如果空白允许,包装类型术语应出现在多剂量、单一患者用以及美国药典(USP)专论中没有的单剂量注射用药品的容器标签上。如果容器标签没有充足的空白来包含这种信息,包装类型术语应出现在纸盒上,使它能够显而易见。
如果合适,单一患者用和单剂量注射药品的处方说明书应包含丢弃说明。如果空白允许,丢弃说明也应包含在容器和纸盒上。如,单剂量容器说明书通常应包括“丢弃未使用部分”的说明。
多剂量容器通常没有丢弃说明,因为失效期设定为打开或进入(如针穿刺)多剂量容器后的28天(除非另有说明)。如果多剂量容器中产品的失效期不是28天,适当的丢弃说明(由适当数据支持)则应包含在容器标签和纸盒标签上以及处方说明书中。可能出现在多剂量容器上的这种丢弃说明的例子包括:打开或配制后XX小时内丢弃,或者第一次使用后冷藏或保存在不超过XX温度XX天。
FDA建议申请人在本指导原则最终版本公布两年内,按照其建议做出必要的标识变更。所有报送资料(年度报告和附件)都应清楚标明所做变更。另外,按照本指导原则建议而报送的附件应标明“按照包装类型术语指导原则做出的标识变更”。就已批准的申请来讲,根据本指导原则建议所做的如下所述4种说明书变更应提交给FDA。
3.1 包装类型术语由“单用”变更为“单剂量”如果药品被设计并且另外标识为单一患者单次注射/滴注,为准确反映包装类型,应在年度报告中提交变更,将包装类型术语由“单用”变更为“单剂量”。
3.2 所有其他包装类型术语的变更所有其他包装类型术语的变更,包括包装类型术语由“单用”变更为“单一患者用”,以及由“多剂量”变更为“单一患者用”,应仅作为NDA和BLA的“批准前附件”(Prior Approval Supplement,PAS)报送。
FDA批准了一个NDA的PAS之后,依赖于该NDA作为参考上市药品(reference listed drug,RLD)的任何ANDA的持有者,将要求提交相应的标识修订。FDA特别要求这些相应的标识修订,应在“受影响的变更”(Changes Being Effected,CBE-O)附件中提交。如果RLD的NDA批准被撤销,该特定药品的相应ANDA持有者应与FDA联系。
3.3 将包装类型术语加至容器/纸盒标签上的变更当容器/纸盒标签上无或未列出包装类型,将包装类型术语加至容器/纸盒标签上的变更,这种变更可分为两种情况。
如果处方说明书已包含合适的包装类型,但由于非缺乏空白的某些原因,容器/纸盒标签没有这种设计,则只要加至容器/纸箱标签上的包装类型术语与包含在已批准的处方说明书中的正确术语相同,NDA、BLA和ANDA持有者可在年度报告中提交将包装类型术语加至容器/纸盒标签的资料。如果容器/纸箱标签包含合适的包装类型而处方说明书中没有这种设计,适用于同样程序。
如果包装类型术语既没有在容器/纸盒上也没有在处方说明书中列出,NDA和BLA持有者应提交一个将合适的术语加至容器/纸盒上和处方说明书中的PAS。NDA RLD的PAS获得FDA批准后,将要求相应的ANDA持有者提交相应的标识修订。FDA特别要求这些相应的标识修订在CBE-0附录中提交。如果RLD的NDA批准被撤销,相应的ANDA持有者应与FDA联系。
3.4 任何其他建议的变更对于任何其他关于包装类型术语变更的申请,与FDA联系办理。
4 结语通过流行病学调查,美国FDA发现不正确使用注射药品的单剂量容器或多剂量容器,可致细菌或病毒血源性传播,造成感染的暴发。这也与注射药品包装类型术语应用不当有关。为此FDA发布了“多剂量、单剂量和单一患者用容器包装的人用注射药品的合适包装类型术语的选择和标识建议行业指导原则(草案)”指导原则,修订了“单剂量”容器和“多剂量”容器的定义,并引入新的“单一患者用”容器的定义替代原来使用的“单用”容器定义,以强调这种容器仅供单一患者多次使用,而不是供多个患者使用。在本指导原则中,FDA还详细说明了在容器、纸盒标签上和处方说明书中如何正确标识包装类型术语以及根据本指导原则如何申报包装类型术语的变更。
不正确使用注射药品的单剂量容器或多剂量容器在我国也导致某些感染性疾病的传播或暴发[8-9],而这些是可以通过规范药品说明书和包装标签的明确标识加以避免的。目前我国相关法规或技术要求对包装类型术语的描述没有具体规定。本指导原则是FDA在流行病学调查基础上针对发现的问题总结出来的管理办法,也是值得我国借鉴的做法。当前党和国家号召“大众创业,万众创新”,我们也应通过实际调查发现药品监管工作的薄弱环节,不断总结经验,创建我国特有的科学的药品监管法规和体系。借鉴FDA本指导原则,建议我国制药企业准确使用包装类型术语,避免滥用和错误使用;同时也建议我国药品监管部门制定符合我国国情的有关包装类型术语的法规和实施细则。
| [1] | FDA. Selection of the appropriate package type terms and recommendations for labeling jnjectable medical products packaged in multiple-dose, single-dose, and single-patient-use containers1 for human use guidance for industry[EB/OL]. (2015-10-21)[2016-06-03]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM468228.pdf. |
| [2] | Thompson N D, Perz J F, Moornan A C, et al. Nonhospital health care-associated hepatitis B and C virus transmission:United States, 1998-2008[J]. Ann Intern Med, 2009, 150:33–39. doi:10.7326/0003-4819-150-1-200901060-00007 |
| [3] | CDC. CDC's position-protect patients against preventable harm from improper use of single-dose/single-use vials[EB/OL]. (2012-05-12)[2016-06-03]. http://www.cdc.gov/injectionsafety/cdcposition-singleusevial.html. http://www.cdc.gov/injectionsafety/CDCposition-SingleUseVial.html |
| [4] | Comstock R D, Mallonee S, Fox J L, et al. A large nosocomial outbreak of hepatitis C and hepatitis B among patients receiving pain remediation treatments[J]. Infect Control Hosp Epidemiol, 2004, 25:576–583. doi:10.1086/iche.2004.25.issue-7 |
| [5] | CDC. Acute hepatitis C virus infections attributed to unsafe injection practices at an endoscopy clinic-Nevada, 2007[EB/OB]. (2008-05-16)[2016-06-03]. http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5719a2.htm. |
| [6] | FDA. Insulin pens:risk of transmission of blood-borne pathogens from shared use[EB/OL]. (2009-03-19)[2016-06-03].http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm127783.htm. |
| [7] | FDA. Allowable excess volume and labeled vial fill size in injectable drug and biological products guidance for industry[EB/OL]. (2015-06-24)[2016-06-03]. http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM389069.pdf. |
| [8] | 张红, 张丽敏, 张炳华, 等. 2009-2013年医院感染丙型肝炎暴发流行调查分析[J]. 中华医院感染学杂志, 2014,24(10):2503–2507. |
| [9] | 李映兰, 郑悦平, 周阳. 医护人员安全注射研究进展[J]. 中华医院感染学杂志, 2009,19(22):3148–3150. |
 2016, Vol. 39
2016, Vol. 39


