2. 浙江泛亚生物医药股份有限公司, 浙江 平湖 314200
2. Zhejiang Bioasia Pharmaceutical Co., Ltd, Zhejiang 314200, China
蝉花又名蝉茸、蝉草等,是蝉拟青霉Paecilomyces cicadae等真菌寄生于一些蝉若虫后形成的菌虫复合体,其无性型为蝉棒束孢,是我国传统中药材[1-4]。蝉花的药用功效始载于南北朝刘宋时代的《雷公炮炙论》,对蝉花加工云:“蝉花,凡使要白花全者,收得后于屋下东南角悬干,去甲土后,用浆水煮一日至夜,焙干碾细用之”。唐慎微所著《证类本草》言“蝉花味甘寒,无毒,主小儿天吊,惊痫,瘛,夜啼,心悸”。
麦角甾醇(ergosterol)作为蝉花虫草中甾醇化合物中的一种,为真菌类的特征甾醇,参与微生物细胞膜的组成,在确保细胞膜的完整性、膜结合酶的活性、膜的流动性、细胞活力以及细胞物质运输等方面都起着重要作用,且是一种重要的维生素D2原。麦角甾醇缺乏以及非平面甾醇前体累积会导致真菌膜的破裂[5]。
麦角甾醇在虫生真菌生长过程发挥特殊的作用,更是真菌生物量的重要标志之一。而科研工作者对于虫生真菌中麦角甾醇的研究更多的集中在终端产品,忽视了整个培育期间包括的多个阶段及多个影响因素[6-8]。因此,为了更为系统全面的了解蝉花人工培育过程中麦角甾醇的变化规律,本实验在建立更为简便、快速、稳定的麦角甾醇高效液相色谱(HPLC)检测方法的基础上,对蝉花虫草培育过程影响麦角甾醇水平的多个阶段及直接因素进行了系统分析。以期为人工蝉花培养工艺的优化及针对性的药物开发奠定基础。
1 材料 1.1 仪器Agilent 1260高效液相色谱仪、Agilent DAD检测器,美国安捷伦科技有限公司;waters 1525二元泵、waters 2998 PDA检测器、waters 2707自动进样器,美国沃特世科技有限公司;H2100R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;DHG-9053A电热恒温鼓风干燥箱、XMTD-8222电热恒温水浴锅,上海精宏实验设备有限公司;PD-1D-50冷冻干燥机,北京博医康实验仪器有限公司;KQ-500E型超声波清洗器,昆山市超声仪器有限公司;sartorius CPA225D电子分析天平,赛多利斯科学仪器有限公司。
1.2 药物及主要试剂蝉花培养物供试品(批号20140306);液体发酵菌丝、不同时间固体培养蝉花培养物(批号20140910);不同的斜面培养基培养得到的蝉花培养物(批号20150114)、不同的固体培养基培养得到的蝉花培养物(批号20150309);蝉花培养物成品(批号20140408、20140512、20140609、20140707、20140804、20140927、20141020、20141117),浙江泛亚生物医药股份有限公司。
麦角甾醇对照品(批号130703,质量分数≥98%),中国食品药品检定研究院;氯仿、醋酸乙酯、乙醇、甲醇、石油醚(60~90 ℃,分析纯)、乙腈(色谱纯),国药集团化学试剂公司;甲醇(色谱纯),中国赛默飞世尔科技有限公司;液体、固体、斜面培养基、原种种子液,由浙江泛亚生命科学研究院提供。
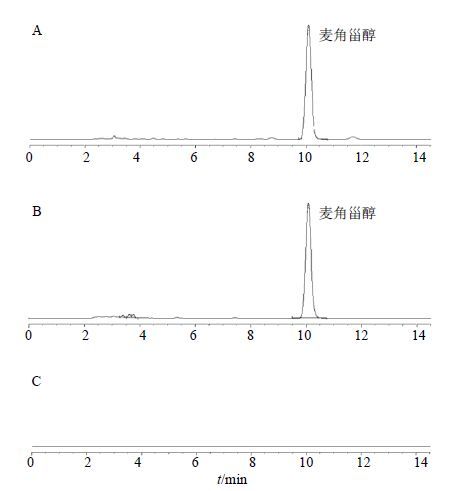
2 方法与结果 2.1 麦角甾醇HPLC检测方法的建立 2.1.1 色谱条件采用Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相选用甲醇;洗脱方式为等度洗脱;体积流量1.0 mL/min;柱温35 ℃;进样量10 μL;检测波长281 nm。按此色谱条件检测供试品溶液、麦角甾醇对照品使用液以及阴性对照溶液(除不加入供试品外,其余操作同“2.1.3”项),结果供试品中麦角甾醇与其他色谱峰均分离良好,峰形对称,见图 1。
|
图 1 供试品溶液(A)、麦角甾醇对照品使用液(B)和阴性对照溶液(C)HPLC色谱图 Fig. 1 HPLC of references (A),test sample (B),and negative samples (C) |
2.1.2 对照品溶液的制备
麦角甾醇对照品储备液:精密称取麦角甾醇对照品适量,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得0.5 mg/mL的麦角甾醇对照品储备溶液。
麦角甾醇对照品使用液:精密移取麦角甾醇对照品储备液2 mL,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,即得终浓度为0.1 mg/mL的麦角甾醇对照品使用溶液。
2.1.3 供试品溶液的制备称取蝉花培养物供试品约0.2 g,精密称定。置于25 mL具塞锥形瓶中,精密移取石油醚6 mL,超声30 min,取出,4 000 r/min离心10 min,取适量上清液3 mL于55 ℃恒温水浴锅上挥干,挥干后残渣用甲醇充分溶解,并定容至10 mL量瓶中。取上清液,过0.22 μm的微孔滤膜,即得供试品溶液。
2.1.4 线性关系考察将麦角甾醇对照品储备液分别用甲醇稀释2、4、8、16、32、64倍,即得质量浓度为7.812 5、15.625、31.250、62.500、125.00、250.00 μg/mL的麦角甾醇对照品溶液,各精密进样10 μL,按“2.1.1”项下色谱条件测定峰面积。以峰面积为纵坐标,质量浓度为横坐标,计算得线性回归方程为y=14 328 x+8.362(r=1),线性范围为7.812 5~250.00 μg/mL,线性关系良好。
2.1.5 精密度试验精密吸取麦角甾醇对照品使用液适量,按“2.1”项色谱条件,重复进样6次,测定峰面积,计算RSD,得麦角甾醇峰面积RSD值为0.3%(n=6)。表明精密度良好。
2.1.6 稳定性试验取按“2.1.3”项下条件制成的供试品溶液,分别于0、2、4、8、12、16、24、36、48 h进样,测得的峰面积,计算RSD值,得麦角甾醇峰面积的RSD值为0.07%(n=6),表明麦角甾醇未发生明显的改变,在48 h内稳定性良好。
2.1.7 重复性试验称取蝉花培养物供试品适量,精密称定,平行6份,制备成供试品溶液,测定峰面积,计算其质量分数RSD值为1.37%(n=6),表明重复性良好。
2.1.8 检测限的考察将麦角甾醇对照品的储备液进行稀释,HPLC进行检测,信噪比S/N=3,当质量浓度为1.95 μg/mL时,无积分峰面积。
2.1.9 加样回收率的考察将加入麦角甾醇对照品的量设为3个浓度,分别为0.2 g蝉花培养物供试品中麦角甾醇水平的0.8、1.0、1.2倍,即将1.6、2.0、2.4 mL麦角甾醇对照品储备液加入到10 mL供试品溶液中。进样测定峰面积,计算得出平均回收率为104.3%,计算得RSD为2.0%,符合标准。
2.1.10 系统耐用性的考察分别以柱长、体积流量、柱温为变量,取蝉花培养物供试品3份,在相同条件下进行处理后HPLC分析检测。结果显示,测定条件的微小变化,不会影响对蝉花培养物供试品中麦角甾醇水平的测定,表明实验方法的耐用性良好。结果见表 1。
| 表 1 系统耐用性的考察 Table 1 Durability of system |
2.1.11 重现性的考察
采用Waters高效液相色谱仪与Agilent高效液相色谱仪在相同色谱条件下对“1.2”项中的蝉花培养物供试品进行分析检测,麦角甾醇的水平分别为5.07、5.03 mg/g,无明显差异,故重现性良好。
2.2 不同液体发酵时间菌丝中的麦角甾醇水平的测定将原种种子液转移至运输瓶中,对发酵罐培养基进行接种培养,观察发酵罐参数的变化,于发酵时间的24、32、40、48、56、64、72 h进行放罐处理,连续进行3次上述放罐试验。收集3批不同发酵时间的液体栽培种,5 000 r/min低温离心10 min处理,收集沉淀物,冷冻干燥48 h,取出,粉碎。按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件测定,用外标法计算各样品中麦角甾醇水平,结果见图 2。

|
图 2 不同液体发酵时间菌丝中的麦角甾醇水平(x ±s,n = 3) Fig. 2 Contents of ergosterol in diferent liquid fermentation mycelium by different fermentation time (x ±s,n = 3) |
2.3 固体培养时间对麦角甾醇水平的影响
将发酵罐培养得到液体栽培种栽培至固体培养基上进行固体培养,观察发酵过程的菌丝生长状态,于发酵时间的第10至32天每天固定时间平行取样3份,收集3批不同发酵时间的固体培养物,冷冻干燥48 h,取出,粉碎。按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件测定,用外标法计算各样品中麦角甾醇水平,结果见图 3。

|
图 3 不同固体发酵时间菌丝中的麦角甾醇水平(x ±s,n = 3) Fig. 3 Contents of ergosterol in mycelium by different solid fermentation time (x ±s,n = 3) |
2.4 不同斜面培养基对蝉花培养物中麦角甾醇水平的影响
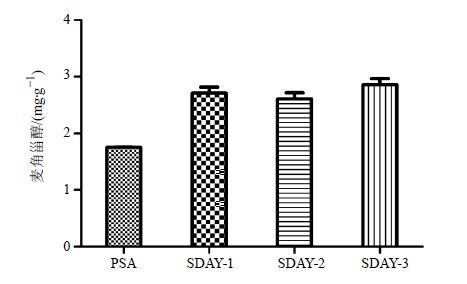
将斜面培养基假单胞菌选择培养基(PSA)、沙氏葡萄糖琼脂培养基(SDAY,1 000 mL培养基中含有的葡萄糖量分别为20、30、40 g,分别标记为SDAY-1、SDAY-2、SDAY-3)进行比较,得到不同斜面培养基培养的不同培养物,培养时间均为25 d,冷冻干燥。精密称取不同斜面培养基培养得到的蝉花培养物,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件测定,用外标法计算各样品中麦角甾醇水平,结果见图 4。
|
图 4 不同的斜面培养基对蝉花培养物中麦角甾醇的影响 (x ±s,n = 3) Fig. 4 Effect of different slant medium on ergosterol in C. cicadae culture (x ±s,n = 3) |
对图 4所示的测定结果,通过SPSS 16.0软件进行多组别间两两比较统计分析及主体间效应检验,验证4种不同的斜面培养基对麦角甾醇水平的影响,并比较各组别之间引起麦角甾醇水平的差异。结果见表 2、3。
| 表 2 不同的斜面培养基对蝉花培养物中麦角甾醇的影响-统计学分析表 Table 2 Statistical analysis on effect of different slant medium on ergosterol in C. cicadae culture |
| 表 3 麦角甾醇水平组别间比较 Table 3 Comparison on ergosterol content among groups |
由表 2、3可知,斜面培养基SDAY-1、SDAY-2、SDAY-3与PSA进行比较,差异显著(P<0.05);斜面培养基SDAY-1与SDAY-2进行比较,麦角甾醇的水平有所增加,但差异不显著;斜面培养基SDAY-3与其他3组进行比较,均差异显著(P<0.05),并随着培养基中葡萄糖量的增加,麦角甾醇的水平也随之增加。
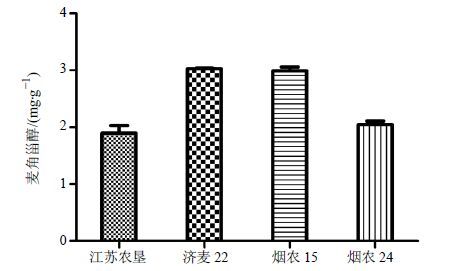
2.5 不同固体培养基对蝉花培养物中麦角甾醇的影响固体发酵工艺中培养基组成可能对固体发酵过程的培养物成分产生影响,因此实验选择不同的固体培养基(品名分别为江苏农垦、烟农24、烟农15和济麦22)对蝉花进行培养,培养时间均为25 d,得到的蝉花培养物进行冷冻干燥。按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件测定,用外标法计算各样品中麦角甾醇的水平,结果见图 5。
|
图 5 不同的固体培养基对蝉花培养物中麦角甾醇的影响(x ±s,n = 3) Fig. 5 Effect of different solid medium on ergosterol in C. cicadae culture (x ±s,n = 3) |
对图 5所示的测定结果,通过SPSS 16.0软件进行多组别间两两比较统计分析及主体间效应检验,验证4种不同的固体培养基对麦角甾醇水平的影响并比较各组别之间引起麦角甾醇水平差异。结果见表 4、5。
| 表 4 不同的固体培养基对蝉花培养物中麦角甾醇的影响-统计学分析表 Table 4 Statistical analysis on effect of different solid medium on ergosterol in C. cicadae culture |
| 表 5 麦角甾醇水平组别间比较 Table 5 Comparison on ergosterol content among groups |
由表 4、5可知,固体培养基品种不同,对麦角甾醇的水平有一定的影响。其中,固体培养基为济麦22的麦角甾醇的水平高于烟农15,与其他两组进行比较,均差异显著(P<0.05),而两组本身并没有显著性的差异;烟农24的麦角甾醇的水平高于江苏农垦,但差异不显著。
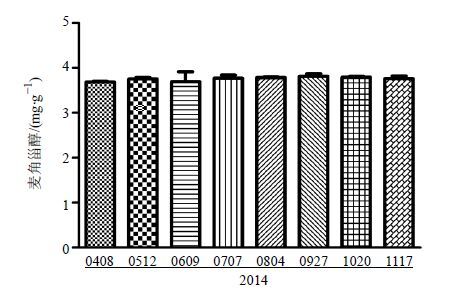
2.6 蝉花培养物成品中麦角甾醇水平的测定取“1.2”项下的8批蝉花培养物成品进行麦角甾醇的水平测定,结果见图 6。
|
图 6 8批成品中麦角甾醇水平(x ±s,n = 3) Fig. 6 Ergosterol levels in eight batches of finished products (x ±s,n = 3) |
3 讨论
麦角甾醇是细胞膜内积累的物质,对维持细胞膜正常的渗透性起着重要的作用。当麦角甾醇缺失时,细胞内的渗透压改变,引起细胞大量泄漏死亡。在整个微生物发酵过程中,麦角甾醇的形成是随着菌体的生长不断地进行,更是评判发酵工艺过程的重要指标。因此,对整个蝉花培育过程各个因素对麦角甾醇水平的影响进行系统分析,对蝉花生产工艺的确定提供了依据,也为蝉花培育过程全程指控系统的建立提供了保证。
本实验针对麦角甾醇的提取水平筛选了不同提取溶剂,数据进行多组别统计分析后,根据统计结果及重复性实验,确定石油醚的提取率优于其他试剂。大多文献也报道以甲醇作为麦角甾醇提取溶剂[9-16],但验证实验中,甲醇3次提取所得水平相差很大且平行样品间偏差明显,溶剂回收过程中甲醇时间较石油醚长,故选择石油醚为提取溶剂。实验对溶媒量及提取时间进行了筛选,以麦角甾醇的水平为评判指标,实验结果通过多组别统计分析,根据实验结果并综合考虑到溶剂节约及蝉花虫草中麦角甾醇的充分提取,确定溶媒量为供试品的重量的30倍、提取时间为30 min效果最佳。本实验建立的检测蝉花虫草中麦角甾醇的方法,通过方法学的验证,该方法简便、快速、干扰少、方法精密度好、准确度高、成分的线性关系明显、线性范围较宽。该方法不仅适用于蝉花中麦角甾醇成分的定量分析,也为蝉花虫草生产过程中的质量控制提供了必要的条件。
本实验结果表明,2种不同类别的斜面培养基(PSA\SDAY)对麦角甾醇成分的变化影响明显(P<0.05),说明蝉花虫草合成该成分的过程中对斜面培养基具有明显的选择性,而碳源及氮源的比例和水平是引起变化的直接原因。而其中培养基(SDAY)对麦角甾醇的成分水平有明显的促进作用(P<0.05),说明麦角甾醇成分的合成就斜面培养基而言具有明显的选择性。
就SDAY培养基而言,3种培养基对最终培养物中麦角甾醇的水平影响较大,组别间差异显著。可以证实,葡萄糖的比例(碳源)是影响麦角甾醇水平变化的一个主要因素,但统计结果也同样显示麦角甾醇水平随着葡萄糖比例的加大成分有一定的升高趋势,说明碳源在培养基中的比例与麦角甾醇的合成有着依赖关系。而对于碳源与碳源的提供来源是否直接影响该成分的水平有待于进一步研究。
本实验进行4种不同固体培养基的考察,结果表明,不同固体培养基对麦角甾醇成分的影响差异明显。虽然一定程度上固体培养基的组成对蝉花虫草的生长和次生代谢产物的形成起着至关重要的作用,但当固体培养基中组成固定时,成分的结构比例对成分的形成影响较大。本实验所用的固体培养基均为小麦,其成分主体结构相同,因产地及品种的差异导致其营养成分的组成比例(碳源、氮源)存在差异,而这种差异又最终从微观成分的角度上有所体现,各成分之间在形成过程中是否存在着直接相关或交互作用本课题组会在进一步试验中加以证明。
液体发酵时间对蝉拟青霉菌丝生长有着直接的影响,这种影响在菌丝显微形态和液体种子液状态上有着外观体现,而液体发酵过程又是微生物成分转化及发酵代谢产物生成的主要时期。因此,本实验选取麦角甾醇为指标,对液体发酵的整过过程进行系统分析,绘制成分生成曲线,由曲线判断液体发酵初期麦角甾醇水平变化平稳,而32~48 h迅速增长之后又趋于稳定,推测可能原因为液体发酵分为延滞期、指数期、稳定期、衰亡期4个阶段,麦角甾醇又是真菌细胞膜的重要组成成分。因此,通过麦角甾醇水平生长曲线可以判断蝉花菌丝生长的各个周期,为蝉花液体发酵生产工艺的确定提供了依据。
在液体发酵的基础上进行了固体培养过程,绘制了以麦角甾醇为评判指标的固体发酵过程生长曲线,结果表明,麦角甾醇在固体培养初期成分趋势稳定而后逐步降低最后又趋于稳定。推测可能原因为固态发酵前期麦角甾醇只是限量合成满足菌体生长细胞膜之需,之后菌体稳步增长阶段,菌丝分裂迅速导致积累在细胞内的麦角甾醇的量减少,而后麦角甾醇合成途径中酶活性上升又促使麦角甾醇再后生长期水平也有一定提升。
本实验对不同批次的蝉花培养物成品中麦角甾醇的水平进行了测定,结果表明,不同批次蝉花培养物成品中麦角甾醇的水平非常稳定,各批次之间统计差异不明显,也间接体现了不同周期蝉花培养工艺的稳定性,为蝉花产业化开发[17-20]及生产产量的提升提供了保证。
本实验主要针对整个蝉花培养过程中影响麦角甾醇的水平的多个过程进行了较为系统的研究。麦角甾醇作为蝉花活性成分之一,是蝉花发挥药理效应的基础与药效直接相关。前期的试验已经明确证实,除麦角甾醇外蝉花中还含有核苷类、多糖、虫草酸、等多种活性物质及微量元素。是否整个培养过程中其他成分也有着不同的体现?各成分在形成过程中的相关性及机制又有何种表现形式?本课题组会在进一步的研究中逐一揭示。
| [1] | 张红霞, 高新华, 陈伟, 等. 人工培育蝉花与天然蝉花中化学成分的比较[J]. 食用菌学报,2012,19 (3) :59–62. |
| [2] | 彭凡, 李春如, 耿德贵. 传统中药蝉花退化菌种虫体复壮的初步研究[J]. 安徽农业大学学报,2014,41 (2) :1–5. |
| [3] | 王琪, 刘作易. 药用真菌蝉花的研究进展[J]. 中草药,2004,34 (4) :469–471. |
| [4] | 王琼, 王春雷, 何福根, 等. 地方药材金蝉花的研究进展[J]. 肿瘤学杂志,2013,19 (3) :227–230. |
| [5] | Berg D, 唐 树人. 抗真菌的甾醇生物合成抑制剂[J]. 国外医药-合成药、生化药、制剂分册, 1987, 8 (2) :72. |
| [6] | 陈安徽, 陈宏伟, 徐洋, 等. 蝉花虫草中核苷类成分的分离纯化和鉴定[J]. 食品科学,2013,34 (1) :131–134. |
| [7] | 于士军, 柴新义, 樊美珍. 蝉花菌质主要营养成分和活性成分分析[J]. 食品与机械,2015,31 (1) :155–158. |
| [8] | 卫亚丽, 杨茂发, 刘爱英. 蝉花中脂肪酸成分和水平的分析[J]. 食品工业科技,2014,35 (5) :303–305. |
| [9] | 张薇薇, 龚韬, 韩东河, 等. RP-HPLC测定人工虫草和天然虫草中麦角甾醇水平[J]. 中国中医药信息杂志,2014,21 (4) :67–69. |
| [10] | 段韶军, 张忠鹏, 李菲菲, 等. 高效液相色谱法测定人工虫草中麦角甾醇的水平[J]. 山西医科大学学报,2006,37 (6) :611–612. doi:10.3969/j.issn.1007-6611.2006.06.014 |
| [11] | 汪宇, 杨光照, 康万军, 等. 高效液相色谱法测定天然冬虫夏草和蛹虫草及其人工培养物中3个核苷类化合物水平[J]. 中国医院药学杂志,2015,35 (9) :805–808. |
| [12] | 王尊生, 王升厚, 袁勤生. 冬虫夏草(Cordyceps sinensis)菌丝体固体发酵粉中麦角甾醇的定量分析[J]. 沈阳师范大学学报: 自然科学版,2005,23 (3) :293–296. |
| [13] | 李云华, 李修禄. 用高效液相色谱法测定冬虫夏草及虫草乌鸡胶丸中麦角甾醇的水平[J]. 药学学报,1991,26 (10) :768–771. |
| [14] | 张萍, 肖新月, 黄玮, 等. RP-HPLC-UV法测定5种发酵虫草制剂中麦角甾醇的水平[J]. 药物分析杂志,2011,31 (2) :258–260. |
| [15] | 常泓, 张婕. 香棒虫草和冬虫夏草中甘露醇和麦角甾醇的测定分析[J]. 山西农业大学学报: 自然科学版,2001,21 (1) :63–65. |
| [16] | 段韶军, 张忠鹏, 李菲菲, 等. 高效液相色谱法测定人工虫草中麦角甾醇的水平[J]. 山西医科大学学报,2006,37 (6) :611–612. |
| [17] | 陈红梅. 超声波法提取红曲中麦角甾醇的条件优化研究[J]. 安徽农学通报,2007,13 (7) :84–85. |
| [18] | 徐铮, 曹永兵, 姜远英. 麦角甾醇生物合成途径中的抗真菌药作用靶酶[J]. 国外医药: 抗生素分册,2001,22 (5) :193–197. |
| [19] | 郑维发, 项小燕, 陈才法, 等. 不同培养基和三种金属离子对桦褐孔菌培养菌丝体的羊毛甾醇和麦角甾醇积累的影响(英文)[J]. 菌物学报,2008,27 (1) :126–139. |
| [20] | 张娴, 黄羽, 曾星. 麦角甾醇对肝癌细胞HepG2增殖及p21表达的影响[J]. 中药药理与临床,2011,27 (5) :26–29. |
 2016, Vol. 39
2016, Vol. 39


