糖尿病已成为威胁人类健康的重大慢性疾病,其代谢紊乱可引起心、脑、肾衰竭等多种并发症,胰岛素的应用给广大患者带来了福音[1-5]。但目前传统胰岛素的治疗仍存在一些缺陷,譬如作用时间短,血糖波动大及夜间低血糖危险,因此迫切需要一种新型的长效胰岛素类药物[6-11]。甘精胰岛素注射液通过基因重组技术对人胰岛素的氨基酸序列及结构进行局部修饰,改变了胰岛素的等电点,大大延长了其作用时间,并且无明显的作用峰值,成为一种疗效较好的长效胰岛素类似物[12-18],而目前有关其毒理学评价国内尚无文献报道。本试验旨在通过对Beagle犬长期毒性试验及其伴随的免疫原性研究,为临床不良反应监测及防治提供参考。
1 材料 1.1 实验动物普通级Beagle犬40条,6~8 kg,雌雄各半,由沈阳康平实验动物研究所提供,实验动物生产许可证号:SCXK(辽)2014-0003,所有动物均有检疫证书和个体档案,研究方案经动物福利委员会(Institutional Animal Care and Use Committee,IACUC)认证批准。动物实验操作均在GLP实验室进行。动物饲养于天津药物研究院新药评价有限公司动物实验楼(屏障环境),温度设定范围20~26 ℃,湿度设定范围40%~70%,换气次数每小时不少于8次全新风,光照时间为12 h/12 h明暗交替。犬粮由北京科澳协力饲料有限公司提供,自由饮用城市生活自来水。
1.2 药品与试剂甘精胰岛素注射液(300 IU∶3 mL,批号20130701)、来得时注射液(300 IU∶3 mL,批号3B006A)、甘精胰岛素注射液溶媒(批号20130701,于2~8 ℃保存备用),均购于北京赛诺菲安万特制药有限公司。
犬免疫球蛋白IgG(犬IgG,批号D4410-QD40K)、辣根过氧化物酶标记的山羊抗犬IgG(IgG-HRP,批号E0111-R261G),均购于美国Southern-Biotech公司;酶反应底物3,3’,5,5’-四甲基联苯胺显色剂(TMB,美国ADL公司);牛血清白蛋白(BSA,批号585247-F,德国Roche公司);全血细胞检测试剂、白细胞分类试剂、网织红细胞检测试剂及质控(德国SIMENS公司);自动生化分析仪试剂(北京中生北控生物科技股份有限公司);凝血功能测定试剂和质控(美国Instrumentation Laboratory公司);尿液测定试纸(桂林优利特医疗电子有限公司)。
1.3 仪器电子天平(上海梅特勒托利多仪器有限公司);OCS-W-100 kg型无线吊钩秤(昆山钰恒电子衡量器有限公司);ADVIA2120血液分析仪(德国SIMENS公司);7080型全自动生化分析仪(日本日立公司);ACL9000凝血分析仪(美国Instrumentation Laboratory公司);CONTEC8000心电工作站(秦皇岛市康泰医学系统有限公司);URITEST-300尿液分析仪(桂林优利特电子集团有限公司);电子肛温计(瑞士Microlife公司);Accu-Chek血糖仪(德国罗氏公司);脱水机、包埋机、封片机、切片机及染色机(日本樱花检验仪器株式会社);Vaioskan Flash酶标仪(美国Thermo公司);DKB-501A型恒温水槽(上海精宏实验设备有限公司);HPLC:Agilent 1260(美国安捷伦科技有限公司)。
2 方法 2.1 动物分组及给药40条Beagle犬按体质量随机分为5组,即甘精胰岛素注射液低、中、高(0.5、1.0、2.0 IU/kg)剂量组,溶媒对照组及原研对照组(来得时,2.0 IU/kg),所有动物每天sc给药1次,给药体积为0.2 mL/kg,连续给药30 d,停药恢复16 d。
2.2 长期毒性检测指标试验期间每日观察动物的外观体征及进食量。
选取适应期,给药第5、12、22、30天及恢复第7、16天,用针刺破前肢静脉取微量血,血糖仪监测空腹约18 h全血血糖。
于适应期和给药期第11、29天及恢复期第15天分别测定动物肛温、体质量及其增长率,其中体质量增长率=(当前体质量-药前体质量)/药前体质量,并采用心电工作站进行心电图检查,包括测量Ⅱ导联心电图中5个心动周期的心率、P波电压、R波电压、T波电压、P-R间期、QRS时限、Q-T间期、ST段电压。
同时收集动物尿液用尿液分析仪进行分析,分析指标有胆红素(BIL)、尿胆原(UBG)、酮体(KET)、抗坏血酸(ASC)、尿糖(GLU)、尿蛋白(PRO)、隐血(BLD)、亚硝酸盐(NIT)、白细胞(LEU)、尿比重(SG)和pH值。
空腹约18 h后,次日经动物前肢头静脉采血约6 mL,其中2 mL经EDTA-K2抗凝、采用血液分析仪进行血细胞分析;1 mL经枸橼酸钠抗凝处理后离心分离血浆,采用凝血分析仪进行凝血功能分析。检测指标有:白细胞(WBC)、红细胞(RBC)、血红蛋白(Hb)、红细胞压积(HCT)、红细胞平均压积体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白含量(MCHC)、血小板(PLT)、网织红细胞(RET)、凝血酶原时间(PT)、活化部分凝血酶时间(APTT)。
3 mL血液加入含分离胶/促凝剂的真空管中放置30 min后,离心制备血清,用于血清生化、电解质及免疫原性测定。血清生化检测应用全自动生化分析仪,检测指标有:丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、尿素氮(BUN)、肌酐(Crea)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、总胆固醇(TCHO)、总胆红素(TBIL)、三酯甘油(TG)、肌酸激酶(CK)、γ-谷氨酰转肽酶(γ-GT)。
给药期结束和恢复期结束安乐死各组1/2动物进行骨髓细胞形态学及组织病理学检查,骨髓细胞形态学检查具体方法是取胸骨上1/3部位挤压出骨髓,立即滴在玻片上推片。
瑞氏染色,统计粒细胞系、红细胞系和淋巴细胞系的百分比并计算粒系和红系之间的比例,观察各类细胞的增生程度。
组织病理学检查器官:肾上腺、主动脉、骨(股骨)、骨髓(胸骨)、脑(大脑、小脑、脑干)、盲肠、结肠、子宫和子宫颈、十二指肠、附睾、食管、眼、胆囊、哈氏腺、心脏、回肠、空肠、肾脏、肝脏、肺脏(附主支气管)、淋巴结、乳腺、卵巢和输卵管、胰腺、垂体、前列腺、直肠、唾液腺、坐骨神经、精囊、骨骼肌、皮肤、脊髓(颈椎、中段胸椎、腰椎)、脾脏、胃、睾丸、胸腺、甲状腺(含甲状旁腺)、气管、膀胱、阴道、脂肪、注射部位的皮肤和肌肉组织等。
2.3 免疫原性试验采用酶联免疫法检测给药前、给药期及恢复期不同时间Beagle犬血清抗药的结合抗体;以同期溶媒对照组动物血清标本所测得吸光度(A)值的2.1倍作为产生抗体的阈值,凡给药后血清标本测得的A值大于或等于阈值者,判定为阳性[18]。
产生结合抗体的血清样品采用HPLC法,以标准对照品的保留时间和峰面积作为参照,以面积最小归一化法计算待检品的效价。
检查甘精胰岛素中和抗体时,将待检血清样品与甘精胰岛素孵育,若血清中具有中和抗体,则与甘精胰岛素特异结合为抗原抗体复合物,将使HPLC保留时间产生位移,甘精胰岛素峰消失或面积减少,以此检测甘精胰岛素体外生物活性效价。
2.4 统计学方法数据均以x±s表示,采用SPSS 11.5对数据进行统计分析。计量资料采用单因素方差分析或非参数检验,计数资料采用NPar Tests Mann-Whitney Test、x2或等级指数检验。各试验组与溶媒对照组之间进行显著性比较。
3 结果 3.1 一般症状及进食量观察甘精胰岛素注射液高剂量组在给药期第10天,发现有1只雌性动物于给药后6 h出现流涎、抽搐等异常反应状态,测定其全血血糖值为1.2 mmol/L,后经静脉注射50%葡萄糖20 mL进行抢救,症状有所改善;但次日上午发现该动物死亡。另外,原研对照组在给药期第8天,发现1只雌性动物于给药后5 h出现流涎、抽搐等症状,测定其血糖值为1.6 mmol/L,后经静脉注射50%葡萄糖20 mL后约20 min逐渐恢复。
给药期和恢复期各试验组的所有受试动物进食量均未见明显异常,饲喂后动物均能很快吃完定量的食物,表明药物对动物进食量没有明显影响。
3.2 体质量、肛温和血糖检查在给药期和恢复期,各剂量组动物的平均体质量与自身给药前体质量相比均呈增长趋势,其中给药期第11天的低、高剂量组平均体质量增长率略高于同期溶媒对照组,均属于动物正常范围内波动。结果见图 1。
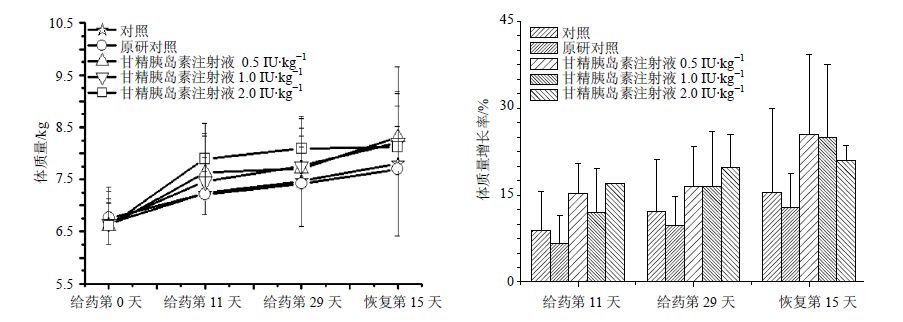
|
图 1 甘精胰岛素注射液对Beagle犬体质量的影响 Fig. 1 Effect of IGI on body weight of Beagle’s dogs |
给药期和恢复期各剂量组动物的肛温和血糖值与同期溶媒对照组比较,均无显著性差异(表 1、2)。
| 表 1 甘精胰岛素注射液对Beagle犬肛温的影响 Table 1 Effect of IGI on rectal temperature of Beagle’s dogs |
| 表 2 甘精胰岛素注射液对Beagle犬血糖的影响 Table 2 Effect of IGI on blood glucose of Beagle’s dogs |
采用尿液分析仪检测BIL、UBG、KET、ASC、GLU、PRO、BLD、NIT、LEU、SG和pH值等指标,未发现与药物相关的异常变化。
心电图结果显示,在给药期和恢复期发现溶媒对照组和各给药组的个别动物出现心律不齐、T波倒置、心动过速或过缓等现象,特别是高剂量组在给药期第11天出现的T波倒置比例略高于溶媒对照组(5/7 vs 1/8),停药后恢复正常。
3.3 血液学、血清生化和凝血功能检查Beagle犬sc不同剂量供试品和原研对照药后,某些指标检测结果的均值与同期溶媒对照组比较具有显著性差异(P<0.05、0.01),但综合分析,这些变化属正常范围内波动,并且无明显的时程-反应关系,考虑与受试药物作用无关。结果见表 3、4。
| 表 3 甘精胰岛素注射液对Beagle犬血液学及凝血的影响 Table 3 Effect of IGI on routine hematology and coagulation of Beagle’s dogs |
| 表 4 甘精胰岛素注射液对Beagle犬血清生化的影响 Table 4 Effect of IGI on serum biochemistry of Beagle’s dogs |
3.4 系统尸检、脏器系数和组织病理学检查
大体剖检可见各只动物毛顺,有光泽,营养状况良好;胸、腹膜光滑,胸、腹腔内未见积液、粘连,被检脏器形态、颜色、位置等未见肉眼可见的病理改变。在给药期及恢复期结束发现个别脏器重量和脏器系数与同期溶媒对照组比较具有显著性差异,但这些指标的变化属正常范围内波动,无明显量效关系,考虑与药物作用无关。组织病理学改变主要是气管的自发性病变,包括给药30天和停药恢复16天发生在各试验组少量动物的气管局部黏膜鳞状上皮化生,上述病变出现的比例和病变程度经等级指数检验无统计学差异。根据病变性质和发病情况分析与药物作用无关。
3.5 免疫原性检测受检动物血清用样品稀释液进行系列稀释后,即1∶4、1∶8、1∶16、1∶64,采用间接ELISA方法测定不同稀释度血清中抗药的结合抗体。结果显示,甘精胰岛素注射液高剂量组于给药期第12天检测到1只雄性动物产生抗药的结合抗体(1/7),阳性率为14.3%,当血清样品稀释32倍后,所测A值低于同期溶媒对照组计算的阈值(溶媒对照组A值均值的2.1倍),即抗体滴度为1∶16,结果见表 5。
| 表 5 阳性动物血清抗体滴度分析 Table 5 Analysis of antibody titer in animals with positive serum |
其他受检血清中均未检测到抗药的结合抗体。产生结合抗体的待检动物血清分别与10 U/mL的甘精胰岛素溶液按1∶1、2∶1、4∶1、8∶1、16∶1的比例混合,孵育后上清液中的甘精胰岛素效价与计算值没有显著差异,回收率最低时为91.0%。因此,可以认为产生中和抗体的动物血清不具备中和甘精胰岛素活性的作用。
4 讨论长期毒性试验是新药非临床前评价的重要内容,它可以预测药物可能引起的临床不良反应及其毒性的靶器官,为临床的安全使用剂量及不良反应监测提供参考[19]。本实验将赛诺菲研发上市的来得时设为原研对照药,对其毒性反应和免疫原性进行了对比研究。结果显示,Beagle犬在sc重复给药前期高剂量和原研对照组各有1只动物出现流涎、呕吐、抽搐、站立不稳等毒性反应症状,此时动物血糖值处在1.2~1.6 mmol/L之间,后经静脉给予一定葡萄糖后均有所改善。由于动物之间的个体差异,高剂量组的该异常动物次日出现死亡,从发生给药后的时间和临床症状表现,可认为高剂量组和原研对照组所引发的的毒性症状均与该药的药理活性有关,两者表现出由于低血糖而致的类似毒副反应。另外,给药期和恢复期发现个别动物出现的心电图异常,特别是高剂量组在给药前期出现的T波倒置比例偏高。这可能一方面与动物个体差异及自身生理变化有关;另一方面,可能与高剂量胰岛素降低正常动物血糖后而处于低血糖所产生的对心电图一过性可逆影响,与胰岛素的药理学活性相关。以上提示甘精胰岛素在临床应用时,应密切监测患者的血糖情况,及时调整给药剂量和频率,防止低血糖症的发生。
甘精胰岛素注射液是通过重组DNA技术合成的新型长效胰岛素类似物[20-23],是否产生免疫原性与药物本身的性质和动物种属相关。在重复给药的毒性试验中,如果出现中和活性的抗体就会削弱药物的药理作用,同时产生的抗原抗体复合物可能会引起新的毒性,因此对生物技术药物的免疫原性评价显得意义重大[24]。本实验伴随着Beagle犬长期毒性试验进行了免疫原性研究,结果显示仅高剂量组1只雄性动物于给药期产生了抗药抗体,进一步对产生结合抗体的血清样品检测显示,其不具备中和活性,从而为甘精胰岛素的临床前安全性评价的准确性提供了科学依据。
| [1] | 许小红, 昝旺, 吴敏. 糖尿病治疗药物——胰岛素研究进展[J]. 西南军医,2007,9 (1) :83–86. |
| [2] | 邓正照, 钱荣立. 糖尿病脂代谢异常与治疗[J]. 中国糖尿病杂志,2001,9 (4) :251–254. |
| [3] | Eichner H. Controlling costs and improving diabetes care[J]. Case Manager, 2002, 13 (2) :75–77. |
| [4] | 母义明, 杨丽娟. 糖尿病药物及胰岛素治疗新进展[J]. 中国实用内科杂志,2007,27 (1) :29–32. |
| [5] | 富丽萍, 惠永平, 罗晓春. 糖尿病的胰岛素治疗[J]. 中国医疗前沿,2007,2 (19) :5–6. |
| [6] | Frid A. Documented advantages of insulin Lantus when compared with NPH insulin[J]. Lakartidningen, 2004, 101 (39) :3014. |
| [7] | Jermendy G. Evidence based therapy with insulin diabetic patients[J]. Orv Hetil, 2005, 146 (8) :341–352. |
| [8] | 曹凤林, 郑少雄. 胰岛素类似物:糖尿病治疗的新选择[J]. 医学综述,2007,13 (1) :32–34. |
| [9] | Vajo Z, Duckworth W C. Advances in the treatment of diabetes-insulin analogues[J]. Minerva Endocrinol, 2002, 27 (3) :167–80. |
| [10] | 王祥香, 孙子林. 糖尿病药物治疗新进展[J]. 中国药科大学学报,2006,37 (2) :105–110. |
| [11] | Julio R, Sherwyn L S, Charles M C. Basal insulin therapy in type 2 diabetes:28-week comparison of insulin glargine (HOE 901) and NPH insulin[J]. Diabetes Care, 2001, 24 (4) :631–636. |
| [12] | Freemantle N, Chou E, Frois C. Safety and efficacy of insulin glargine 300 U/mL compared with other basal insulin therapies in patients with type 2 diabetes mellitus: a network meta-analysis[J]. BMJ Open, 2016, 6 (2) :e009421. |
| [13] | Kuerzel G U, Shukla U, Scholtz H E. Biotransformation of insulin glargine after subcutaneous injection in healthy subjects[J]. Curr Med Res Opin, 2003, 19 (1) :34–40. |
| [14] | Mckeage K, Goa K L. Spotlight on insulin glargine in type1 and 2 diabetes mellitus[J]. Treat Endocrinol, 2002, 1 (1) :55–58. |
| [15] | Mckeage K, Goa K L. Insulin glargine: A review of its therapeutic use as a long-acting agent for management of type 1 and type 2 diabetes mellitus[J]. Drugs, 2001, 61 (11) :1599–624. |
| [16] | Kacerovsky B G, Dressier A, Freunscht R. Long-term glycaemic control with insulin glargine in type 2 diabetes[J]. Diabetes Res Clin Pract, 2006, 71 (2) :184–191. |
| [17] | 区岛良, 陈世雄. 甘精胰岛素联合阿卡波糖对2型糖尿病患者胰岛功能的影响[J]. 药物评价研究,2016,39 (1) :101–104. |
| [18] | XU Z K. Practicality of monoclonal antibody technique[M].the first edition. Xian: Shanxi Science and Technology Press, 1992 : 43 -47. |
| [19] | 吕秋军, 丁林茂. 生物技术药物临床前安全性评价研究进展[J]. 中国新药杂志,2001,10 (4) :252–256. |
| [20] | Chakkarwar P N, Manjrekar N A. Insulin glargine:A long acting insulin analog[J]. J Postgrad Med, 2005, 51 (1) :68–71. |
| [21] | Vajo Z, Fawcett J, Duckworth W C. Recombinant DNA technology in the treatment of diabetes: insulin analogs[J]. Endocr Rev, 2001, 22 (5) :706–717. |
| [22] | Christopher J D, Greg L P, Gillman M K. Insulin glargine: An updated review of its use in the management of diabetes mellitu[J]. Drugs, 2003, 63 :1743–1778. |
| [23] | Ashwell S G, Home P D. Insulin glargine: the first clinically useful extended-action insulin analogue[J]. Expert Opin Pharmacother, 2001, 2 (11) :1891–902. |
| [24] | 吕秋军. 生物技术药物的免疫毒性和免疫原性研究[J]. 毒理学杂志,2007,21 (4) :281–282. |
 2016, Vol. 39
2016, Vol. 39


