2. 中国药科大学, 江苏 南京 210009
2. China Pharmaceutical University, Nanjin 210009, China
阿齐沙坦(Azilsartan)是日本武田制药开发的新一代抗高血压药,其实质为一种血管紧张素Ⅱ受体的竞争性拮抗剂,在治疗高血压方面,治疗效果优于现有的缬沙坦和奥美沙坦[1-3]。阿齐沙坦酯(Azilsartan medoxomil)是阿齐沙坦的前药,在胃肠道吸收过程中会被芳香酯酶水解为阿齐沙坦[4-5]。阿齐沙坦酯于2011年通过美国FDA批准在美国上市,而阿齐沙坦则在2012年于日本上市[6]。本文旨在建立简单、快速、准确的测定大鼠血浆中阿齐沙坦的HPLC-荧光法,用于阿齐沙坦血药浓度的测定。
1 材料 1.1 仪器Agilent 1200,安捷伦科技(中国)股份有限公司出品;检测器:Agilent FLD,G-1321A;自动进样器:Agilent 1200 ALS,G-1329A;泵:Agilent 1200 Qμat Pμmp,G-1311A;脱气机:Agilent 1200 Degasser,G-1322A;柱温箱:Agilent 1200 TCC,G-1316A;记录工作站:Agilent chemstation B.03.02。
1.2 药品与试剂阿齐沙坦酯钾(供试品),质量分数99.3%,批号BJZSAK150520,日本武田制药公司产品;阿齐沙坦(对照品),质量分数99.7%,批号20150408,中国食品药品检定研究院产品;缬沙坦(内标),质量分数100.0%,批号100651-201203,中国食品药品检定研究院产品。
乙腈,色谱纯,购于Fisher Scientific;甲醇,色谱纯,Fisher Scientific;醋酸乙酯,色谱纯,天津市康科德科技有限公司。
1.3 实验动物SD大鼠6只,雌雄各半,体质量180~220 g,北京维通利华实验动物技术有限公司,生产单位许可证编号:SCXK(京)2012-0001。动物使用方案经天津药物研究院新药评价有限公司实验动物管理和使用委员会(IACUC)审查并批准。
2 方法 2.1 色谱条件流动相为0.1%磷酸水溶液-甲醇(35∶65),体积流量1.0 mL/min。色谱柱为Aglient Epilent plμs C18(250 mm×4.6 mm,5 μm)。激发波长265 nm,吸收波长378 nm。
2.2 溶剂配制稀释剂及复溶剂:70 mL乙腈与30 mL甲醇混合均匀,取70 mL与30 mL去离子水混合,再加入100 μL磷酸,混匀。
萃取剂:120 mL醋酸乙酯与80 mL乙腈溶液混合,加入200 μL磷酸,混匀。
2.3 阿齐沙坦标准系列溶液及质控溶液配制精密称取适量阿齐沙坦对照品,稀释剂溶解并稀释成质量浓度为1 000、500、100、50、10、5、1 μg/mL的阿齐沙坦标准系列溶液和质量浓度为800、50、2.5 μg/mL的质控溶液。
2.4 缬沙坦(内标)溶液配制精密称取缬沙坦适量,甲醇溶解并稀释成质量浓度为100 μg/mL的内标溶液。
2.5 模拟血浆样品配制取阿齐沙坦标准系列溶液及质控溶液15 μL加入空白大鼠血浆135 μL,混匀。
2.6 血浆样品处理过程取待测血浆样品150 μL,加入50 μL内标溶液(100 μg/mL),混匀,加入900 μL萃取剂,涡旋离心后取上清800 μL,氮气吹干,稀释剂复溶,涡旋离心,取上清进样测定。
3 动物给药方案及血浆样本采集SD大鼠6只,雌雄各半,ig给予2 000 mg/kg的阿齐沙坦酯钾,于药前(0 h)及药后0.25、1、4、10、24、48 h眼底静脉丛采血,肝素钠抗凝,12 000 r/min离心10 min,取上清−80℃冻存待测。
4 数据分析使用Agilent chemstation B.03.02工作站对目标峰进行积分,记录峰面积,以待测物浓度(X)为横坐标,待测物与内标物的峰面积比值(Y)为纵坐标,用加权最小二乘法(权重为1/X2)进行回归运算,求得回归方程即为血浆校正曲线。各毒代动力学参数用Das 2.0计算得出。
5 结果 5.1 专属性配制大鼠空白血浆、阿齐沙坦和内标溶液以及含药血浆样品,HPLC测定后得色谱图(图 1),结果显示,血浆内源性物质对目标峰不存在干扰,阿齐沙坦保留时间约7.4 min,内标保留时间约9.1min,阿齐沙坦与内标分离完全且峰形良好,证明该分析方法专属性良好,能够用于测定阿齐沙坦的血药浓度。
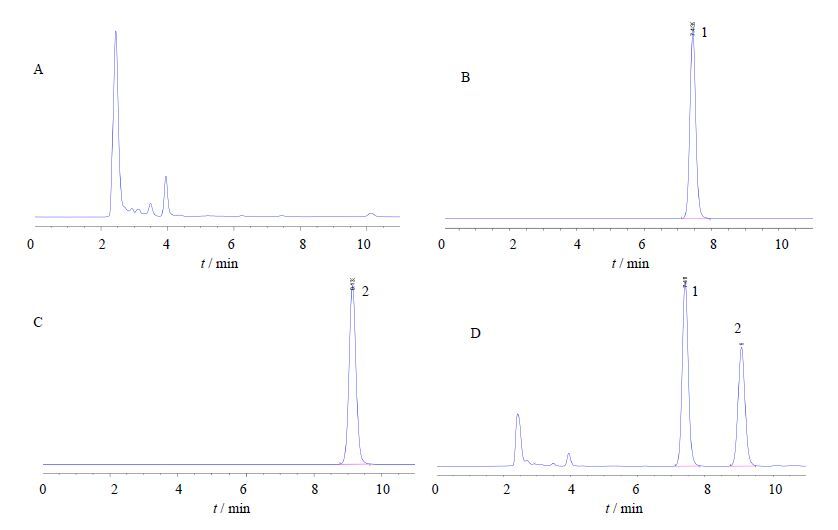
|
图 1 阿齐沙坦HPLC-荧光色谱图 Fig. 1 HPLC-fluorescence chromatogram of Azilsartan in rat plasma |
5.2 标准曲线及定量下限
取2.5项下配制的系列浓度阿齐沙坦模拟血浆样品,按照2.6方法操作,进行HPLC分析。求得回归方程:Y=0.032 7 X+0.009 5,R2=0.999。结果表明阿齐沙坦在0.1~100 μg/mL线性良好。
配制质量浓度为0.1 μg/mL的阿齐沙坦血浆样品,平行6份,按照2.6方法操作,进行HPLC检测,测定质量浓度为(0.102±0.001)μg/mL,RE为2.43%,RSD为1.34 %,说明本方法测定血浆中阿齐沙坦的定量下限可达到0.1 μg/mL。
5.3 提取回收率取2.5项下配制的质量浓度为0.25、5、80 μg/mL的质控模拟血浆样品,按照2.6方法提取,进行HPLC检测,样品峰面积记为A1。另配制质量浓度为0.25、5、80 μg/mL的阿齐沙坦标准溶液样品,进行HPLC检测,样品峰面积记为A2,以A1/A2计算回收率。结果显示,低中高浓度样品提取回收率分别为(87.76±1.39)%、(95.65±1.03)%及(94.13±2.11)%,符合相关生物样品检测标准。
5.4 精密度及准确度按照2.5项下配制方法,配制质量浓度为0.25、5、80 μg/mL的模拟血浆样品,每批每浓度平行6份,连续配制3批,按照2.6方法操作,进行HPLC检测,考察结果见表 1,结果显示,低中高浓度样品日内RSD分别为1.87%、1.46%、1.14%,日间RSD分别为0.75%、0.86%、1.47%,RE分别为3.10%、2.86%、−1.59%,符合生物样品检测标准。
| 表 1 稳定性实验结果(n=6) Table 1 Result of stability experiment (n = 6) |
5.5 样品稳定性
按照2.5项下配制方法,配制质量浓度为0.25、5、80 μg/mL的模拟血浆样品,考察血样室温放置4 h、−80℃冻融循环3次、处理后进样器放置24 h的稳定性,测定结果见表 1。结果表明,血样室温放置4 h、−80℃冻融循环3次及处理后进样器放置24 h后,样品测定结果RE<10%,说明在上述条件下样品稳定。
5.6 动物实验研究结果SD大鼠6只,ig给予2 000 mg/kg的阿齐沙坦酯钾后,血药浓度-时间关系见图 2,动力学参数分别见表 2。结果显示,ig给予2.0 g/kg的阿齐沙坦酯钾后,阿齐沙坦在大鼠体内AUC0-t为(5451.94±297.96)μg/L∙h,Cmax为(258.01±49.75)μg/mL。
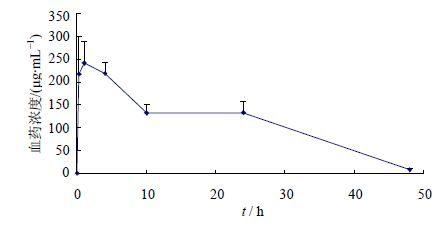
|
图 2 阿齐沙坦在大鼠体内的药时曲线(n=6) Fig. 2 Blood concentration-time curve of Azilsartan in rat (n = 6) |
| 表 2 阿齐沙坦在大鼠体内的毒代动力学参数(n=6) Table 2 Toxicokinetics parameters of Azilsartan in rat (n = 6) |
6 讨论
阿齐沙坦酯钾是阿齐沙坦酯的制剂形式,Naohiro等[5]对阿齐沙坦酯体内吸收过程进行了研究,结果表明大鼠空肠注射阿齐沙坦酯后,现有条件下,血浆中几乎检测不到阿齐沙坦酯,而阿齐沙坦作为主要的活性代谢产物大量存在于体内,说明阿齐沙坦酯进入体内后几乎完全水解为阿齐沙坦(图 3),因此可以通过研究阿齐沙坦体内变化间接反映阿齐沙坦酯在动物体内的代谢情况。
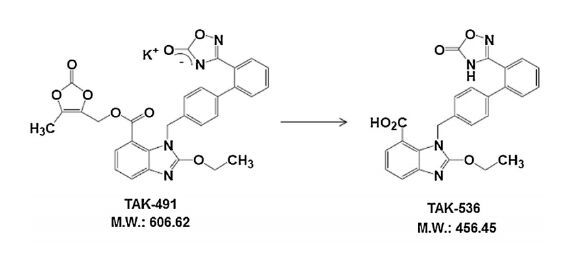
|
图 3 阿齐沙坦酯水解过程 Fig. 3 Hydrolysis process of the Azilsartan medoxomil |
目前,测定血浆中药物浓度常用的检测方法有HPLC-UV、LC-MS/MS等。Vekariya等[7]采用HPLC-PDA法测定血浆中阿齐沙坦的浓度,检出限仅为1.0 μg/mL,不能满足本研究中血浆药物浓度检测的要求。此外,采用HPLC-UV法进行测定,血浆样品中的内源性物质可能对待测物产生干扰。LC-MS/MS虽解决了上述问题,但同时也提高了检测成本。文献报道阿齐沙坦分子结构中存在能够发射强荧光的共轭结构[8],因此本文选择采用HPLC-荧光法测定阿齐沙坦的血药浓度。
在液相条件摸索阶段,参考相关文献[9-11],通过对流动相不同配比和pH条件进行筛选,对洗脱时间不断优化,最终确定本研究的色谱测定条件。稀释剂及复溶剂采用含0.1%磷酸的甲醇乙腈水的混合溶液,能够促进阿齐沙坦的溶解和维持样品的稳定。流动相中加入了0.1%磷酸,有利于样品及内标峰形的改善,提高了样品分离度。在实验样品处理过程中,选用醋酸乙酯作为提取剂,提取效果不佳,回收率仅60%左右,经实验摸索,发现采用醋酸乙酯与乙腈混合溶液(混合比例6∶4),加入0.1%磷酸作为提取剂,提取效果良好,回收率高达85%以上。
与HPLC-UV方法对比,本文建立的HPLC-荧光法具有更高的灵敏度和抗干扰能力,同时较LC-MS/MS更为经济实用。本方法线性范围为0.1~100 μg/mL,定量下限为0.1 μg/mL。在此线性范围内对准确度、日内日间精密度、提取回收率以及稳定性等项目进行了验证,考察结果均符合相关生物样品检测标准,可用于阿齐沙坦在大鼠体内的血药浓度测定。
| [1] | Rakugi H, Kario K, Enya K. Effect of azilsartan versus candesartan on nocturnal blood pressure variation in Japanese patients with essential hypertension[J]. Blood Press, 2013, 22 (1) :22–28. |
| [2] | 孙文俊, 阎卉, 王成港. 血管紧张素受体AT1亚型受体拮抗剂-阿齐沙坦酯[J]. 药物评价研究,2011,34 (3) :230–235. |
| [3] | Lam S. Azilsartan: a newly approved angiotensin receptor blocker[J]. Cardiol Rev, 2011, 19 (6) :300–304. |
| [4] | 赵春艳, 王京晶, 刘洋. 心血管疾病新药阿齐沙坦酯的药理与临床评价[J]. 中国新药杂志,2011,20 (19) :1831–1835. |
| [5] | Naohiro K, Takuya E, Toshiyuki T. Absorption of TAK-491, a new angiotensin Ⅱ receptor antagonist, in animals[J]. Xenobiotica, 2013, 43 (2) :182–192. |
| [6] | 陈玲, 邹栩, 黄文龙. 2011年FDA批准上市新药及全球新药研究最新进展[J]. 中国新药杂志,2011,20 (23) :2286–2300. |
| [7] | Vekariya P P, Joshi H S. Development and validation of RP-HPLC method for azilsartan medoxomil potassium quantitation in human plasma by solid phase extraction procedure[J]. Isrn Spectroscopy, 2013, 2013 (2013) :1–6. |
| [8] | 束蓓艳, 吴雪松, 岑均达. 阿齐沙坦的合成[J]. 中国医药工业杂志,2010,41 (12) :881–884. |
| [9] | 米楠, 苏慕君, 臧可昕. 阿齐沙坦油水分配系数的测定[J]. 药物评价研究,2013,36 (6) :452–455. |
| [10] | 顾维钧, 侯玉婷, 杨明华. 高效液相色谱法测定阿齐沙坦的含量和有关物质[J]. 药物分析杂志,2014,34 (12) :2085–2191. |
| [11] | 唐了平, 产运霞, 马贵红. 阿齐沙坦片国产品溶出度试验方法的建立及与原研品体外溶出行为比较[J]. 中国药房,2014,25 (17) :1609–1611. |
 2016, Vol. 39
2016, Vol. 39


