2. 天津药物研究院天津市新药安全评价研究中心, 天津 300193;
3. 天津药物研究院释药技术与药代动力学国家重点实验室, 天津 300193
2. Tianjin Center for Drug Safety Assessment, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China ;
3. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
代谢组学作为一门新兴技术被广泛应用于药物安全性评价研究中,但目前其生物样本大多来源于实验对象的血液、尿液等[1-3],对体外细胞的代谢组学研究报道相对较少。心脏毒性是目前新药研究中面临的最大挑战之一,很多新药往往由于不可避免的心脏毒性而被迫终止研发[4-5]。本研究将体外心肌细胞培养技术与代谢组学技术相结合,进行原代心肌(Primary cardiomyocytes,PC)细胞样本预处理方法的筛选,并对超高效液相色谱-飞行时间质谱联用(UPLC/Q-TOF-MS)法的色谱、质谱条件进行优化,为进一步全面研究药物的体外心肌毒性代谢组学提供参考依据。
1 材料 1.1 试剂DMEM/F12培养基、胎牛血清、青霉素-链霉素混合双抗试液、0.05%胰蛋白酶-0.02% EDTA溶液、Ⅱ型胶原酶,美国Invirtogen(Gibco)公司;磷酸盐缓冲液(PBS),美国HyClone公司;5-溴脱氧尿嘧啶核苷(BrdU),美国Sigma公司。
帕拉米韦,质量分数99.9%,批号091005,由天津药物研究院樊慧蓉老师赠予,用甲醇配制成质量浓度为1.0 µg/mL的内标溶液;甲醇,色谱纯,德国Merck公司;乙腈,色谱纯,美国Fisher公司;甲酸,色谱纯,美国Acros Organics公司;超纯水,由实验室超纯水机自制,其它试剂为分析纯。
1.2 仪器超高效液相色谱/四级杆-飞行时间串联质谱仪(Waters ACQUITY UPLC/Q-TOF-MS Premier)、ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱、Masslynx工作站和MarkerLynx数据预处理软件,美国Waters公司;SIMCA-P 12.0软件,瑞典Umetrics公司;MS2漩涡混匀器,广州仪科实验室技术有限公司;VELOCITY 14R台式冷冻离心机,澳大利亚Dynamica公司;DKB-501超级恒温水浴槽,上海森信实验仪器有限公司;MCO-18AIC二氧化碳培养箱,日本SANYO公司;Milli-Q ACADEMIC超纯水机,美国Millipore公司;细胞刮刀,丹麦Nunc公司。
1.3 动物新生24 h内的SD大鼠,雌雄不限,体质量约12 g,由北京维通利华实验动物技术有限公司提供的雌、雄大鼠合笼饲养生育获得,许可证号SCXK(京)2006-0009。
2 方法 2.1 PC细胞培养参照文献方法[6]并缩短差速贴壁时间至20 min,利用新生24 h内的SD大鼠乳鼠制备PC细胞。以5×105/mL的密度接种于6孔板中,每孔2 mL,培养48 h后换液,除去BrdU,继续培养1 d,待呈现活力良好且均一节律性搏动的细胞簇时即可用于后续实验。
2.2 心肌细胞样品预处理方法考察参照文献方法[7-10],并结合实验室条件,比较用胰酶消化法收集细胞后直接用甲醇提取处理和在PBS缓冲液中刮取细胞后采用6种不同溶剂提取的预处理方法。
2.2.1 胰酶消化收集细胞后采用甲醇提取的预处理0.05%胰酶-0.02%EDTA消化后,收集6孔板中大鼠心肌细胞,4 ℃、1 000 r/min离心5 min,小心吸弃上清,加入PBS小心洗涤至少1次,离心并弃上清。立即加入200 µL预冷的-80 ℃甲醇,随即冻存于-80 ℃冰箱保存备用。检测前,于每份样本中各加入50 µL内标溶液,涡旋3 min,充分混合后,4 ℃、13 000 r/min离心10 min,取上清于进样小瓶的内衬管中进样。
2.2.2 刮取细胞后采用不同溶剂提取的预处理吸弃6孔板中培养基,加入PBS洗涤细胞表面1次,吸弃后再次加入PBS,每孔100 µL,用细胞刮刀轻柔刮取细胞收集于1.5 mL离心管中。4 ℃、1 000 r/min离心5 min,仔细吸弃上清后,立即分别加入200 µL提取溶剂:(1)纯甲醇;(2)先用20%水浸泡细胞,后加入80%甲醇多次涮洗收集;(3)甲醇-水(80∶20);(4)乙腈;(5)乙腈-水(20∶80);(6)甲醇-异丙醇-水(47.6∶47.6∶4.8)。随即冻存于-80 ℃冰箱保存备用。检测前,于每份样本中各加入50 µL内标溶液,涡旋3 min,充分混合后,4 ℃、13 000 r/min离心10 min,最后取上清于进样小瓶的内衬管中进样。
2.3 UPLC/Q-TOF-MS分析条件的摸索与优化 2.3.1 色谱条件及其优化采用ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相为乙腈(A)-0.1%甲酸水(B);为了使色谱图中各特征峰获得较好的分离度和峰形,筛选多种梯度洗脱方案以确定最佳洗脱程序(表 1);体积流量0.4 mL/min;柱温30 ℃;进样量5 μL。
| 表 1 UPLC/Q-TOF-MS梯度洗脱程序的选择 Table 1 Gradient elution program selection of UPLC/Q-TOF-MS |
2.3.2 质谱条件及其优化
UPLC/Q-TOF-MS系统使用电喷雾离子源(ESI),为了最大限度地检测到内源性代谢物,本实验分别考察了心肌细胞样品在正、负离子检测模式下的出峰情况,以确定最佳的离子检测模式。离子源工作参数:毛细管电压3.0 kV,锥孔电压35 V,锥孔气体积流量50 L/h,脱溶剂气体积流量600 L/h,离子源温度100 ℃,脱溶剂气温350 ℃,0.1s(间隔0.02 s)采集1次谱图。
准确质量测定采用亮氨酸脑啡肽(m/z 556.277 1)溶液为质量锁定溶液,质量浓度100 pg/mL;体积流量0.05 µL/min;锥孔电压40 V;采集频率10 s采集1次;质量扫描范围m/z 50~1500。
2.3.3 方法学考察采用“勾兑”的方法,即吸取等量采用“2.2.1”项方法制备的心肌细胞样本,混匀,制备成质量控制样品(QC),对UPLC/Q-TOF-MS分析方法学进行考察。采用本研究确定的最佳洗脱程序和正离子模式扫描,洗脱程序如下:0 min,2.0% A;2 min,25.0% A;6 min,40.0% A;12 min,90.0% A;保持2 min;16 min,2.0% A;保持2 min。
仪器精密度试验:取QC样品溶液,连续进样6次,考察色谱峰面积和保留时间的一致性,计算6个稳定出现的较大共有独立峰的相对峰面积比值和保留时间的RSD。
方法精密度试验:取QC样品平行处理6份,制得6份样品溶液,进样分析,计算6个稳定出现的较大共有独立峰的相对峰面积比值和保留时间的RSD。
样品稳定性试验:取QC样品溶液,分别在0、6、12、18、24和48 h检测,计算6个稳定出现的较大共有独立峰的相对峰面积比值和保留时间的RSD。
2.4 统计学分析采用Waters Markerlynx软件对图谱数据进行预处理,包括峰识别、离子对提取、峰对齐、峰匹配和峰强度校正等。将预处理后的数据导入MatLab软件进行数据修约,即利用MatLab编程除去特征值中含有0值超过80%的列和std小于0.5的列。将修约后的数据导入SIMCA-P 12.0统计软件进行多维数据分析。通过MassLynx获取各特征峰与内标峰的峰面积数据,用相对峰面积比值表示代谢物的水平,以相对峰面积比值和保留时间的RSD值表示方法学考察结果。
3 结果 3.1 不同心肌细胞样品预处理方法对基峰离子流(BPI)色谱图的影响采用正离子模式扫描,洗脱程序如下:0 min,2.0% A;10 min,90.0% A;保持2 min;14 min,2.0% A;保持2 min。按照“2.2”项下方法分别考察了胰酶消化冰甲醇提取和刮刀刮取后用6种不同溶剂提取的心肌细胞样品预处理方法。基于整体表现,选用-80 ℃纯甲醇直接提取胰酶消化的心肌细胞为最佳的预处理方法,其可获得最多的特征峰数及最佳的分离度和峰形。各组预处理方法的BPI色谱图见图 1。
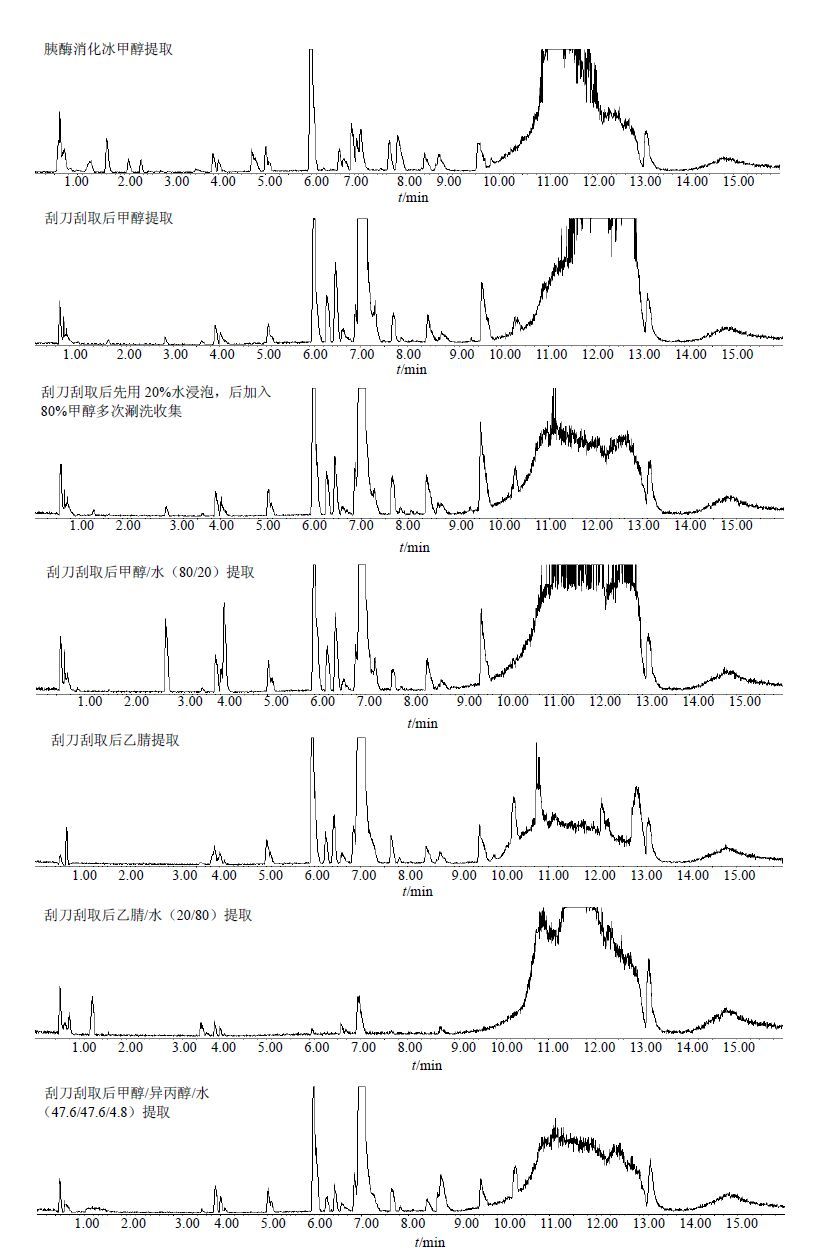
|
图 1 心肌细胞样品预处理方法考察 Fig. 1 Pre-treatment methods of cardiomyocytes samples |
3.2 色谱条件中梯度洗脱程序的优化
利用“2.2.1”项方法制备的心肌细胞样品在正离子模式下进行梯度洗脱程序优化,考察表 1中的5种梯度洗脱程序,与其余4种梯度洗脱程序比较,程序5可获得最多数目的特征峰,且其BPI图中各特征峰分离度和峰形均较好,因此,选择程序5为最佳洗脱程序。5种梯度洗脱程序的BPI图见图 2。
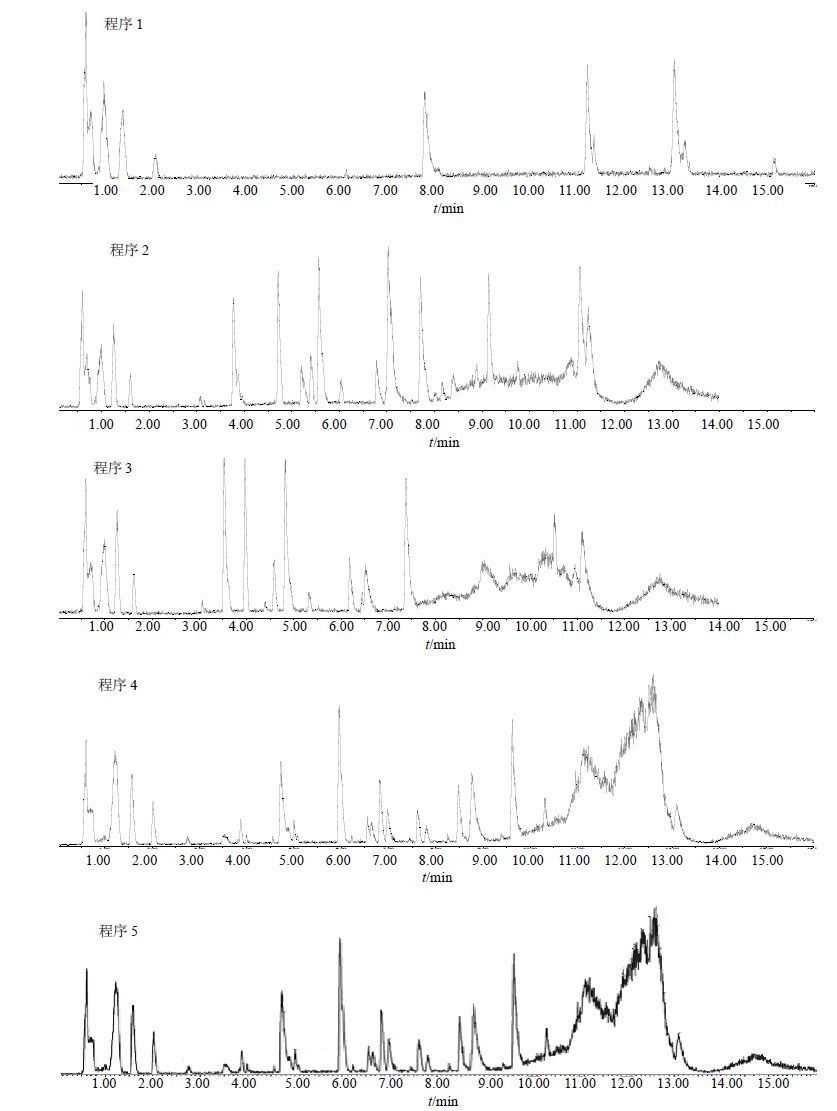
|
图 2 UPLC/Q-TOF-MS梯度洗脱程序的选择 Fig. 2 Gradient elution program selection for UPLC/Q-TOF-MS |
3.3 质谱条件中正负检测模式的选择
在梯度洗脱程序4的条件下,考察“2.2.1”项方法制备的心肌细胞样品在正、负离子模式检测下的出峰情况,结果显示,在正离子模式下检测到了>20个特征峰,而负离子模式只检测到了少数几个特征峰。因此,统一采用正离子模式检测。结果见图 3。
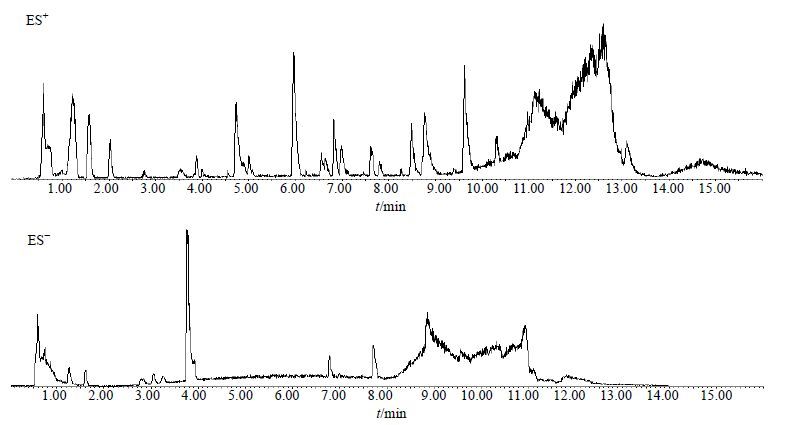
|
图 3 质谱检测离子模式选择 Fig. 3 Ion mode selection for mass spectrometry detection |
3.4 方法学考察结果
6个稳定出现的较大共有独立峰色谱图见图 4。仪器精密度中相对峰面积比值的RSD为4.9%~14.9%,保留时间的RSD均小于1.0%,表明仪器精密度良好;方法精密度中相对峰面积比值的RSD为8.6%~17.8%,保留时间的RSD均小于1.0%,表明方法精密度良好;样品稳定性试验中相对峰面积比值的RSD为5.2%~16.3%,保留时间的RSD均小于1.0%,表明样品在48 h内稳定,所以每批样品应保证在2 d内测定。结果见表 2。
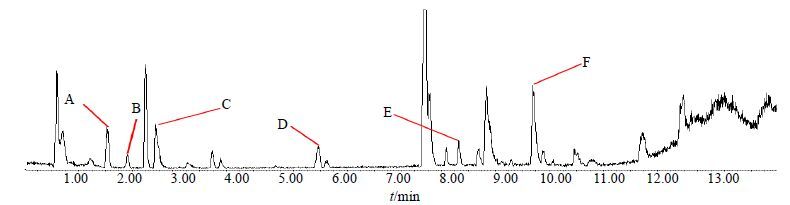
|
图 4 方法学考察所用的6个色谱峰 Fig. 4 Six chromatographic peaks indicated in methodological evaluation |
| 表 2 仪器精密度、方法精密度和稳定性实验结果 (n= 5) Table 2 Results of instrument precision,method precision,and stability tests (n = 5) |
4 讨论
完整的代谢组学研究流程包括生物样品的采集和预处理、数据的采集、数据的处理与分析及生物学内涵的解析[1]。生物样品的采集和预处理是代谢组学研究的第一个关键步骤和前提条件。生物体液(血液、尿液等)和细胞或组织提取物等均为代谢组学的生物样本。但鉴于试验样本的易获得性和涵盖整体特征的代谢物信息,目前代谢组学研究最多的生物样本是血液、尿液等[1-3],对体外细胞进行系统的代谢组学研究的报道较少。PC细胞是心血管疾病及药物安全性试验等研究的重要体外实验模 型[11-12]。本研究将体外心肌细胞培养技术与代谢组学技术相结合,通过前期的摸索和反复试验业已建立改良的原代心肌细胞培养方法,可快速、高效地获取存活率和纯度均高的PC细胞,为体外心肌毒性代谢组学研究提供了良好的物质基础。本研究对不同的PC细胞的样本预处理方法进行了考察。
生物样品预处理过程的关键是使用尽可能少的预处理步骤,获得尽可能多的保留和反映代谢产物信息全貌。常用的样品预处理方法有:有机溶剂沉淀法(通常采用水或甲醇、乙腈等有机溶剂提取)、液液萃取法和固相萃取法等[1]。一般情况下,常采用0.25%胰蛋白酶溶液消化收集细胞[7],但为了尽可能降低胰酶对PC细胞的损伤,本研究比较了分别使用细胞刮刀于缓冲液浸润下收获细胞和低浓度胰蛋白酶(0.05%)消化收获细胞后使用不同的有机溶剂进行提取的方法。细胞刮刀可接触细胞生长的所有表面,可将细胞成片刮起,减少了对单个细胞的损伤,但成片堆积的细胞可能由于分散不均使某些细胞不能与有机溶剂充分接触。0.05%胰蛋白酶可将PC细胞完全分散,与有机提取试剂充分接触以完全提取,但可能由于离心操作导致细胞总量损失。此外,对于细胞生物样品而言,其内部的代谢状态(代谢物的质与量)将随着内在酶的受敏变化而发生迅速改变。因此,常用冰冻/液氮降温法及冷冻、干燥等保存技术,瞬间阻断内在酶的活性。同时,需尽量避免氧化等活化因素,使细胞处于尽可能低的代谢活动水平,以期获得能正确反映在体的真实代谢信息[13]。因此,本研究在收获PC细胞后立即加入冰冻的-80 ℃有机溶剂以期尽可能达到瞬间阻断内在酶活性的目的,从而获得PC细胞“当时”的真实代谢信息。通过本实验发现,用0.05%胰酶消化后直接采用-80 ℃冰甲醇提取的预处理方法与其余处理方法相比,其BPI离子流图中获得的内源性代谢物峰数量最多,分离度和峰形最佳,能最大限度的复演PC细胞内代谢物的信息全貌,故为最适宜的PC细胞样品预处理方法。
数据的采集也是代谢组学研究流程中的关键步骤,主要依靠色谱、质谱、核磁共振等分离分析技术。近年来兴起的UPLC/Q-TOF-MS技术,因其快速、灵敏、高通量、峰容量大、选择性强,得到的质谱谱图数据完整、品质高以及能提供精准的分子量信息而成为代谢组学定性、定量分析研究的一大利器[14-15]。本研究分别对UPLC/Q-TOF-MS法的色谱及质谱条件进行优化,确定检测PC细胞中内源性代谢物的最佳实验分析条件。
本实验采用了1.7 μm颗粒度的Acquity UPLC填料的ACQUITY UPLC BEH C18(2.1 mm×100mm,1.7 μm)色谱柱,减少了固定相表面残余硅羟基,流动相中只加入酸抑制剂,不需添加有机胺即可使分子峰得到良好分离,同时也在一定程度上降低质谱噪音、减少对质谱的污染,且使用的流速适合与质谱直接联用,无需分流,可以进一步提高检测灵敏度,为本实验的分析提供良好的平台[16]。
根据质谱仪的基本原理,不同的化合物在不同离子状态下的响应不同,通常正离子模式适合分析碱性化合物,而负离子模式适于分析酸性化合物[17-18]。因此,为了最大限度的检测到更多的代谢物组分,本实验考察了心肌细胞样品分别在正、负离子模式检测下的出峰情况,结果提示心肌细胞样品在正离子模式下检测到了更多的特征峰,而负离子模式则只检测到了少数特征峰。因此,本实验的所有样本将统一采用正离子模式检测。
为了使色谱图中各特征峰获得较好的分离度和峰形,尝试多种梯度洗脱方案。方案1洗脱程序总时长为30 min,洗脱时间较长,且出峰个数较少,峰与峰之间的间隔较长。方案2缩短了检测时间,流出了较多的谱峰,且分离度也得到了一定改善,但发现1.75~3min这段时间没有谱峰流出,较为稀疏空旷。方案3在方案2的基础上增加了一次流动相配比改变,但发现出峰不如方案2。进一步改变流动相比例,调整洗脱程序,得到方案4和方案5,结果显示这两种方案的分离效果基本相似,不仅分析时间适宜,分离度较好,峰形也较美观,基于整体的表现和为内标峰的选取提供余地的考虑,本实验确定方案5为最佳洗脱程序。
在上述已经确定的UPLC/Q-TOF-MS分析条件下,各种内源性代谢物依次从UPLC色谱柱中洗脱,分离度良好。本研究利用QC样品对体外心肌细胞代谢组学的UPLC/Q-TOF-MS分析方法进行了仪器精密度、方法精密度和样本稳定性试验考察。仪器精密度、方法精密度和样本稳定性以相对峰面积比值的RSD计均<20%,保留时间的RSD均<1.0%,表明本方法仪器精密度和方法精密度良好,待测样品在48 h内稳定性良好,因此每批样品应保证在2 d内测定即可。
综上,本研究通过对PC细胞样本预处理方法的筛选及对UPLC/Q-TOF-MS分析条件的摸索与优化,确定了最佳的体外心肌毒性代谢组学的样本预处理方法与数据采集分析条件,为进一步建立与完善体外心肌毒性代谢组学研究方法奠定了不可或缺的基础,也为今后更多地开展体外细胞模型的代谢组学研究提供参考。
| [1] | 黄寅, 许风国, 张伟, 等. 药物代谢组学研究进展[J]. 中国药科大学学报,2013,44 (2) :105–112. |
| [2] | Liu T, Li J, Xu F, et al. Comprehensive analysis of serum metabolites in gestational diabetes mellitus by UPLC/ Q-TOF-MS[J]. Anal Bioanal Chem, 2016, 408 (4) :1125–1135. |
| [3] | Jiang T, Lin Y, Yin H, et al. Correlation analysis of urine metabolites and clinical staging in patients with ovarian cancer[J]. Int J Clin Exp Med, 2015, 8 (10) :18165–18171. |
| [4] | Li X, Zhang R, Zhao B, et al. Cardiotoxicity screening: a review of rapid-throughput in vitro approaches[J]. Arch Toxicol, 2015 . doi:10.1007/s00204-015-1651-1 |
| [5] | Scott C W, Zhang X, Abi-Gerges N, et al. An impedance-based cellular assay using human iPSC-derived cardiomyocytes to quantify modulators of cardiac contractility[J]. Toxicol Sci, 2014, 142 (2) :331–338. |
| [6] | Fu J J, Gao J, Pi R B, et al. An optimized protocol for culture of cardiomyocyte from neonatal rat[J]. Cytotechnology, 2005, 49 (2) :109–116. |
| [7] | Dettmer K, Nurnberger N, Kaspar H, et al. Metabolite extraction from adherently growing mammalian cells for metabolomics studies: optimization of harvesting and extraction protocols[J]. Anal Bioanal Chem, 2011, 399 (3) :1127–1139. |
| [8] | Ritter J B, Genzel Y, Reichl U. Simultaneous extraction of several metabolites of energy metabolism and related substances in mammalian cells: optimization using experimental design[J]. Anal Biochem, 2008, 373 (2) :349–369. |
| [9] | Faijes M, Mars A E, Smid E J. Comparison of quenching and extraction methodologies for metabolome analysis of Lactobacillus plantarum[J]. Microb Cell Fact, 2007, 6 :27. |
| [10] | 周大炜, 朱之燕. 微生物代谢组学的样品前处理[J]. 化学通报,2008,71 (6) :404–407. |
| [11] | 李晓梅, 包馨慧, 杨毅宁, 等. 体外心肌细胞缺血后适应模型的建立及评价[J]. 新疆医科大学学报,2014,37 (1) :24–28. |
| [12] | 郭俊芳, 张赢予, 莫亚宏, 等. 多柔比星诱导体外培养心肌细胞损伤模型的建立[J]. 重庆医学,2009,38 (24) :3132–3134. |
| [13] | 王智文, 马向辉, 陈洵, 等. 微生物代谢组学的研究方法与进展[J]. 化学进展,2010,1 (22) :163–172. |
| [14] | Yin P, Zhao X, Li Q, et al. Metabonomics study of intestinal fistulas based on ultraperformance liquid chromatography coupled with Q-TOF mass spectrometry (UPLC/Q-TOF MS)[J]. J Proteome Res, 2006, 5 (9) :2135–2143. |
| [15] | Wilson I D, Nicholson J K, Castro-Perez J, et al. High resolution "ultraperformance" liquid chromatography coupled to oa-TOF mass spectrometry as a tool for differential metabolic pathway profiling in functional genomic studies[J]. J Proteome Res, 2005, 4 (2) :591–598. |
| [16] | 林艳萍. 应用基于质谱技术的代谢组学研究肝损伤标志物[D]. 天津: 天津大学, 2009. |
| [17] | 牟玲丽, 余鹏, 金亚超. 体内药物分析中影响LC-ESI-MS离子化的因素[J]. 国际药学研究杂志,2011,28 (2) :137–141. |
| [18] | Patring J D M, Jastrebova J A. Application of liquid chromatography-electrospray ionisation mass spectrometry for determination of dietary folates: effects of buffer nature and mobile phase composition on sensitivity and selectivity[J]. J Chromatogr A, 2007, 1143 (1/2) :72–82. |
 2016, Vol. 39
2016, Vol. 39


