神经性疼痛(neuropathic pain,NP)是中枢或周围神经系统损害或功能障碍引起的疼痛综合征,以痛觉过敏、自发性疼痛和痛觉超敏为特征[1-2]。安络小皮伞Marasmius androsaceus(L.:Fr.)Fr.,是我国传统的药用真菌,属于担子菌纲、伞菌目、白蘑科、小皮伞属。安络痛是以安络小皮伞菌粉及醇提物制成的制剂,已有40多年的临床应用历史,对各类神经痛和风湿关节炎均有较好的疗效及安全性,但是其具体镇痛机制并不明确。
研究表明,脊髓水平中枢机制在神经病理性疼痛的发生及维持过程中发挥着重要的作用[3]。神经损伤使脊髓水平MAPK家族蛋白(p38、ERK、JNK)的激活及表达增多[4],而p38、ERK、JNK抑制剂能明显阻断这种现象,并能明显减弱伤害性刺激所导致的痛觉过敏[5-7]。可见,MAPK信号转导通路在疼痛敏化调控方面发挥着重要作用。此外,促炎性细胞因子也是神经病理性疼痛产生与维持的重要原因[8-12]。研究发现,在坐骨神经损伤等神经病理性疼痛大鼠模型中均出现了肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)表达的增高,鞘内给予正常大鼠外源性TNF-α或IL-1β能引起机械痛超敏和热痛觉过敏,而外周或鞘内给予TNF-α或IL-1β拮抗剂均能有效地抑制痛觉敏化的产生[13]。
安络小皮伞醇提取物是否通过对脊髓MAPK信号通路及促炎症因子的调节而缓解神经病理性疼痛,目前还未见报道。因此,本研究通过建立慢性坐骨神经结扎性损伤(chronic constriction injury,CCI)大鼠模型,研究安络小皮伞醇提取物(Marasmius androsaceus ethanolic extract,MAEE)对CCI模型大鼠机械痛超敏及热痛过敏的影响,同时检测实验大鼠脊髓L4-L6段TNF-α、IL-1β以及MAPK磷酸化蛋白表达水平,探讨安络小皮伞对神经病理性疼痛的镇痛作用。
1 材料 1.1 动物健康成年雄性SD大鼠,体质量180~220 g,由北京维通利华实验动物技术有限公司提供,许可证号SCXX(京)2012-0001。动物饲养条件为:温度(25±1)℃,相对湿度45%~50%,光照与黑暗时间比为1∶1,自由摄食饮水。
1.2 药品及主要试剂安络小皮伞菌粉(杭州众芝康菇生物技术有限公司,生产批号JC15110301);水合氯醛(国药集团化学试剂有限公司);铬羊肠线(上海浦东金环医疗用品有限公司);大鼠TNF-α、IL-1β ELISA试剂盒(上海科鉴生物科技有限公司);Trizol(南京诺唯赞生物科技有限公司);SYBR Green Master Mix(美国Bio-Rad公司);大鼠TNF-α、IL-1β引物(南京生兴生物技术有限公司);TransScript 1st-Strand cDNA Synthesis SuperMix(北京全式金生物技术有限公司);p-38、p-ERK、p-JNK抗体、羊抗兔二抗(美国Cell Signaling公司);GAPDH(美国Sigma- Aldrich公司)。
1.3 仪器von Frey纤毛(North Coast Medical公司);PL-200型全自动热痛刺激仪(成都泰盟科技有限公司);PCR仪、Quantitative Real-time PCR仪器(美国Bio-Rad公司);冷冻干燥机(美国Labconco公司)。
2 方法 2.1 安络小皮伞醇提取物的制备根据安络痛临床制剂的生产工艺制备MAEE,取安络小皮伞菌粉(及其培养基)加5倍量80%乙醇,70 ℃回流提取1 h,滤过,残渣重复上述操作,连续3次至提取液无色,合并提取液,回收乙醇后冷冻干燥,得MAEE,醇溶性浸出物>50%。将MAEE用生理盐水按给药剂量配制成不同浓度的溶液。
2.2 模型的制备根据Bennett等[14]的方法制备坐骨神经慢性结扎损伤(CCI)模型。大鼠在10%水合氯醛麻醉下,于左侧大腿中部切开皮肤,钝性分离肌肉,暴露10 mm坐骨神经,于神经起始处上方2 mm处,用4.0铬制羊肠线结扎4道,每道间隔约1 mm,强度以小腿肌肉微颤为准,逐层缝合;假手术组只暴露坐骨神经,不做结扎。
2.3 动物分组及给药40只成年SD大鼠随机分为假手术组、模型组、MAEE高、中、低剂量(800、400、200 mg/kg)组,每组8只。CCI术后14 d,MAEE组ig给予200、400、800 mg/kg的MAEE,假手术组和模型组给予等体积的生理盐水,连续给药7 d。于1、3、5、7 d给药后2 h测定大鼠机械痛阈(MWT)值和热痛阈(TWL)值,并在停药后连续测定3 d。
2.4 大鼠痛阈值的测定 2.4.1 MWT值检测将大鼠放置于升高透明的金属网格笼中,测定前适应10 min,探觅行为停止后开始测量。以不同折力的Von-Fery纤毛对大鼠左侧足底足心进行机械性刺激,逐渐加压至细丝弯曲,维持5 s[15]。从1.0 g开始,逐渐增加纤毛折力,引起大鼠撤足反射时读取力度的大小,间隔一段时间,重复测量5次,去掉最大值及最小值后计算3次平均值即为MWT。
2.4.2 TWL值检测参照Hargreaves K方法[16],实验前让大鼠适应环境10 min,待大鼠安静后,使用热刺痛仪刺激大鼠术侧后足足底,热刺激强度设定为35%,自动切断时间为20 s,以防止时间过长造成损伤,记录大鼠从开始刺激到出现撤足反应的时间,每次测定间隔一段时间,重复测定3次,取平均值为大鼠TWL。
2.5 ELISA法检测脊髓L4-L6节段TNF-α和IL-1β蛋白水平给药7 d后,大鼠深度麻醉,取脊髓腰膨大L4-L6节段,将组织块称取适量,加入预冷的PBS(0.01 mol/L,pH值为7.4,临用前加入蛋白酶抑制剂)匀浆,4 ℃、8 000 r/min离心10 min。吸取上清液采用双抗体夹心法按ELISA试剂盒说明书操作,制作标准曲线并计算TNF-α、IL-1β蛋白表达。
2.6 实时荧光定量PCR(qRT-PCR)法检测脊髓L4-L6节段TNF-α和IL-1β mRNA水平取脊髓L4-L6节段组织块破碎后(冰上操作),加入500 μL Trizol匀浆2 min,冰上裂解10 min,加氯仿100 μL,颠倒混匀,冰上静置15 min,4 ℃、12 000 r/min离心15 min;取上清液于另一1.5 mL EP管中,等体积加入异丙醇,颠倒混匀,室温静置10 min,4 ℃、12 000 r/min离心10 min;弃上清液,加冰预冷的DEPC水配制的75%乙醇1 mL,4 ℃、7 500 r /min离心5 min;弃上清液,空气干燥5~10 min后,用RNA溶解液将沉淀溶解。
取各样本RNA 5 μL,按TransScript®cDNA试剂盒说明书操作,依次添加Anchored Oligo(dT)18 Primer 1 μL,TransScript®RT/RI Enzyme Mix 1 μL,2×TS Reaction Mix 10 μL,Rnase-free ddH2O 3 μL,轻轻混匀,25 ℃,10 min;50 ℃,30 min;85 ℃,5 min;15℃,+∞。逆转录后进行qRT-PCR,使用SYBR GREEN染料进行实时荧光定量PCR,程序设置为95 ℃,30 s,然后 95 ℃,5 s;60 ℃,30 s;50个循环。每个样本3次重复。使用相对定量方法,应用2−ΔΔCt分析。引物序列见表 1。
| 表 1 qRT-PCR中目的基因的引物序列 Table 1 Primer sequences of target genes in qRT-PCR |
2.7 Western blotting法检测脊髓p-ERK、p-JNK和p-p38 MAPK蛋白表达
取大鼠脊髓L4-L6节段组织块破碎后(冰上操作),按一定比例加入RIPA裂解液(含蛋白酶抑制剂及磷酸酶抑制剂)匀浆。使用BCA法测定蛋白浓度。经SDS-PAGE电泳,转移至PDVF膜上,6% BSA封闭液室温封闭3 h,分别加入p-ERK、p-JNK和p-p38 MAPK等一抗(1∶1 000)室温孵育3 h,4 ℃过夜,TBST洗5 min×3次,加入羊抗兔二抗(1∶1 000),室温下孵育3 h,TBST洗5 min×3次。Bio-Rad凝胶成像仪显影后采用Quantity One-4.6.5软件对各组数据图像灰度进行统计与分析。
2.8 统计学分析结果均以x±s表示,用SPSS 19.0分析软件进行组间t检验。
3 结果 3.1 对CCI诱导的大鼠MWT及TWL的影响结果表明,各组大鼠术前MWT及TWL无显著性差异;CCI大鼠术后14 d,与假手术组比较,MWT及TWL显著降低(P<0.01);与模型组比较,第1天给药后MWT及TWL显著升高(P<0.05、0.01)。结果提示,单次给予不同剂量的MAEE能剂量相关性的降低CCI诱导的机械学超敏及热痛学过敏。
连续7 d给予不同剂量的MAEE也能剂量相关性的缓解CCI诱导的神经病理性疼痛且没有耐受性,并且随着MAEE给药次数的增加,疼痛症状改善更为显著。在停药1、2 d后,MAEE中、高剂量组与模型组比较仍差异显著(P<0.01),MAEE高剂量组停药后3 d仍能缓解CCI诱导的神经病理性疼痛(P<0.05)。这与安络小皮伞的临床用药特点相符合。结果见表 2、3。
| 表 2 各组大鼠不同时间点MWT的变化(x±s,n = 8) Table 2 Changes of MWT in rats among different groups at different time points (x±s,n = 8) |
| 表 3 各组大鼠不同时间点TWL的变化(x±s,n = 8) Table 3 Changes of TWL in rats among different groups at different time points (x±s,n = 8) |
3.2 对CCI大鼠脊髓L4-L6节段TNF-α及IL-1β水平的影响
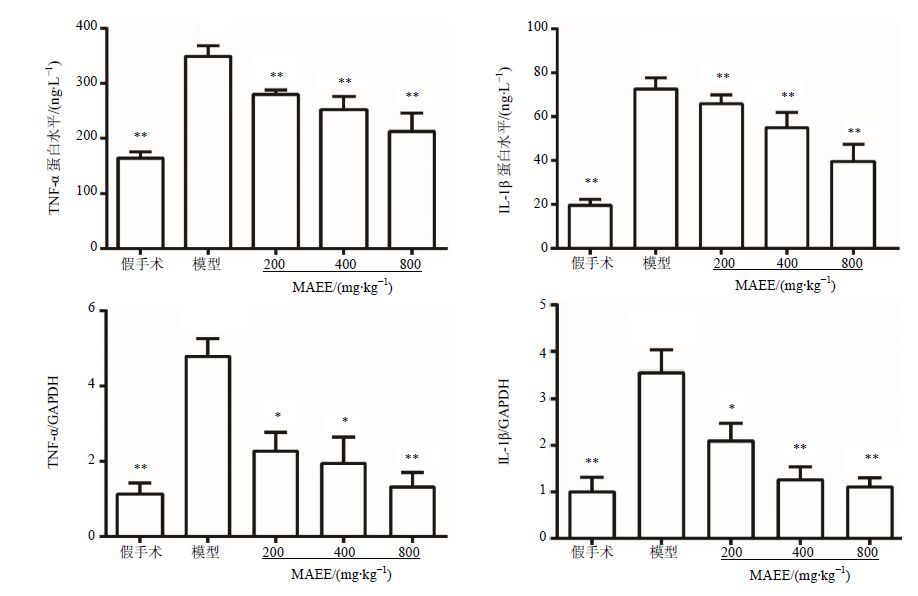
ELISA检测结果显示,假手术组IL-1β及TNF-α水平较低;与假手术组比较,CCI大鼠IL-1β及TNF-α表达水平明显升高(P<0.01)。与模型组比较,而给予不同剂量的MAEE能够降低IL-1β及TNF-α表达水平(P<0.01),其中高剂量组抑制作用最为显著。
qRT-PCR检测结果与ELISA的结果相一致,MAEE能够剂量依赖性的降低CCI大鼠脊髓L4-L6节段中上调的IL-1β以及TNF-α mRNA水平。见图 2。
|
图 2 CCI大鼠给予MAEE后下调TNF-α和IL-1β的表达(x±s,n = 6) Fig. 2 Suppression of MAEE on expression of TNF-α and IL-1β in CCI rats (x±s,n = 6) |
3.3 对CCI大鼠脊髓L4-L6节段p-ERK、p-JNK和p-p38 MAPK蛋白水平的影响
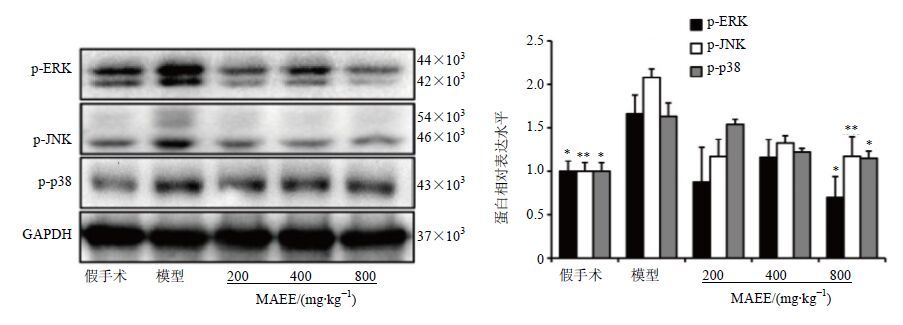
结果表明,在CCI诱发的神经病理性疼痛模型大鼠中,与假手术组比较,p-ERK、p-JNK、p-p38的表达水平显著上升(P<0.05、0.01);与模型组比较,CCI大鼠在MAEE不同剂量给药7 d后,脊髓L4-L6节段MAPK磷酸化蛋白水平降低,其中高剂量组差异显著(P<0.05、0.01)。结果见图 3。
|
图 3 Western blotting法检测脊髓L4-L6节段p-ERK、p-JNK和p-p38 MAPK蛋白表达水平(x±s,n = 3) Fig. 3 Relative expression levels of p-ERK, p-JNK,and p-p38 MAPK signaling way proteins in spinal dorsal horns (L4—L6) of rats detected by Western blotting (x±s,n = 3) |
4 讨论
安络小皮伞已被临床证实对多种类型神经痛和神经炎痛均有很好的疗效,但其作用机制仍不明确。本课题研究结果表明,CCI大鼠模型能够诱发大鼠机械痛觉超敏及热痛学过敏,同时伴有脊髓MAPK家族磷酸化蛋白水平上调以及促炎细胞因子TNF-α、IL-1β表达增高,连续给予MAEE可显著持久性改善CCI大鼠机械痛觉超敏及热痛觉过敏症状,下调脊髓促炎细胞因子TNF-α、IL-1β的表达,降低ERK、JNK和p38 MAPK磷酸化蛋白水平。
研究显示,MAPK信号传导通路及促炎性细胞因子是神经性疼痛产生与维持的重要因素。神经损伤产生的伤害性刺激使脊髓背角中MAPK特异性激活和表达增多,MAPK是信号从细胞表面传导到细胞核内部的重要传递者,当MAPK激活后通过一系列激酶的磷酸化级联反应影响细胞核内基因的转录和调控,最终导致痛觉过敏及中枢敏化,而这种现象能被MAPK特异性抑制剂明显阻断;神经损伤引起炎性细胞激活,从而释放促炎性细胞因子TNF-α、IL-1β等,导致神经源性炎症,使周围的伤害性感受器进一步敏感化。阻断脊髓MAPK信号蛋白的磷酸化及降低促炎性细胞因子的表达是抑制神经病理性疼痛的途径之一。
本研究表明,MAEE可能通过抑制MAPK信号蛋白的磷酸化、抑制促炎性细胞因子的释放而发挥抑制神经病理性疼痛作用。
| [1] | Bouhassira D, Lantéri-Minet M, Attal N, et al. Prevalence of chronic pain with neuropathic characteristics in the general population[J]. Pain, 2008, 136 (3) :380–387. |
| [2] | Toth C, Lander J, Wiebe S. The prevalence and impact of chronic pain with neuropathic pain symptoms in the general population[J]. Pain Med, 2009, 10 (5) :918–929. |
| [3] | Fairbanks C A, Goracke-Postle C J. Neurobiological studies of chronic pain and analgesia:Rationale and refinements[J]. Eur J Pharmacol, 2015, 759 :169–181. |
| [4] | Milligan E, Watkins L. Pathological and protective roles of glia in chronic pain[J]. Nat Rev Neurosci, 2009, 10 (1) :23–36. |
| [5] | Anand P, Shenoy R, Palmer J E, et al. Clinical trial of the p38 MAP kinase inhibitor dilmapimod in neuropathic pain following nerve injury[J]. Eur J Pain, 2011, 15 (10) :1040–1048. |
| [6] | Iriana G A, Gerardo A M, Agueda F D, et al. Oral administration of the p38α MAPK inhibitor, UR13870, inhibits affective pain behavior after spinal cord injury[J]. Pain, 2014, 155 (10) :2188–2198. |
| [7] | Park J Y, Park J J, Jeon S, et al. From peripheral to central:the role of ERK signaling pathway in a cupuncture analgesia[J]. J Pain, 2014, 15 (5) :535–549. |
| [8] | Li Z Y, Zhang Y P, Jie Z, et al. The possible involvement of JNK activation in the spinal dorsal horn in bortezomib-induced allodynia:the role of TNF-α and IL-1β[J]. J Anesth, 2015, 30 (1) :55–63. |
| [9] | Yang K Y, Bae W S, Min J K, et al. Participation of the central p38 and ERK1/2 pathways in IL-1β-induced sensitization of nociception in rats[J]. Prog Neuro-Psycho, 2013, 46 (4) :98–104. |
| [10] | Reyes-Gibby C C, Wang J, Silvas M R T, et al. MAPK1/ERK2 as novel target genes for pain in head and neck cancer patients[J]. Bmc Genet, 2016, 17 (1) :1–13. |
| [11] | Roberts J, Ossipov M H, Porreca F. Glial activation in the rostroventromedial medulla promotes descending facilitation to mediate inflammatory hypersensitivity[J]. Eur J Neurosci, 2009, 30 (30) :229–241. |
| [12] | Hu X M, Liu Y N, Zhang H L, et al. CXCL12/CXCR4 chemokine signaling in spinal glia induces pain hypersen-sitivity through MAPKs-mediated neuro-inflammation in bone cancer rats[J]. J Neurochem, 2015, 132 (4) :452–463. |
| [13] | Byung-Sang L, In-Gu J, Sung-Hoon K, et al. Intrathecal gabapentin increases interleukin-10 expression and inhibits pro-inflammatory cytokine in a rat model of neuropathic pain[J]. J Korean Med Sci, 2013, 28 (2) :308–314. |
| [14] | Bennett G J, Xie Y K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain, 1988, 33 (1) :87–107. |
| [15] | Austin P J, Wu A, Moalem-Taylor G. Chronic constriction of the sciatic nerve and pain hypersensitivity testing in rats[J]. Jove-J Vis Exp, 2012 . doi:10.3791/3393 |
| [16] | Hargreaves K, Dubner R, Brown F, et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J]. Pain, 1988, 32 (1) :77–88. |
 2016, Vol. 39
2016, Vol. 39


