2. 中国科学院大连化学物理研究所, 药用资源开发组, 辽宁 大连 116023
2. Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Laboratory of Pharmaceutical Resource Discovery, Dalian 116023, China
淫羊藿是我国传统的补益中药,其主要化学成分包括黄酮、木脂素、生物碱及多糖,此外还含有少量的挥发油、棕榈酸和硬脂酸等[1]。黄酮及其衍生物是淫羊藿化学成分的重要组成部分,体内外药理学实验表明,这一类化合物均存在壮阳作用、雌激素样作用、抗肿瘤、抗炎、抗氧化、心血管及神经系统保护作用等广泛的药理活性[2]。
淫羊藿苷是淫羊藿主要的黄酮苷类化合物之一[3-4],其可被人肠道菌代谢转化为淫羊藿次苷Ⅱ,淫羊藿次苷Ⅱ是大鼠ig给予淫羊藿苷后吸收入血的主要成分,是淫羊藿苷发挥药效的物质基础[5-6]。此外,包括朝藿定A、B、C在内的含有8位异戊烯基的黄酮苷类化合物在肠道菌的作用下也可以转化成次级苷,即淫羊藿次苷Ⅱ,进而吸收入血发挥药效作用[7]。
体外药理学研究发现,淫羊藿次苷Ⅱ是高选择性5型磷酸二酯酶(PDE5)抑制剂,对PDE5A1抑制作用的IC50值为160 nmol/L,抑制强度是其他5型磷酸二酯酶的10倍[8-9]。但淫羊藿次苷Ⅱ体内实验数据显示,该化合物口服后受首关效应影响,在大鼠体内的生物利用度仅为4.1%[10]。
进一步的代谢研究发现,葡萄糖醛酸化反应是淫羊藿次苷Ⅱ在大鼠体内主要的生物转化过程,3位与7位双葡萄糖醛酸代谢产物与7位单葡萄糖醛酸代谢产物是大鼠血中检测到的主要代谢产物。在大鼠胆汁和尿中7位单葡萄糖醛酸代谢产物是检测到的主要产物,而淫羊藿素为在大鼠粪便中主要检测到的代谢产物[11]。由尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGT)介导的葡萄糖醛酸化反应是药物在体内重要的Ⅱ相代谢反应,参与近40%临床药物的代谢[12]。在人体内,UGT1A与UGT2B亚家族参与经皮肤、呼吸道以及口腔进入体内的外源性化合物的葡萄糖醛酸化代谢,使之易于排出体外,对机体起到保护作用[13]。对于存在明显首关效应的药物而言,代谢行为可能是影响其生物利用度的主要原因之一,而UGT代谢酶抑制剂的存在能够增加药物的吸收,减慢药物的清除,进而对其生物利用度产生一定程度的改善。
因此,本研究通过体外实验技术,以淫羊藿次苷Ⅱ为底物,分别考察槲皮素、山柰酚、桔皮素、柚皮素、水飞蓟素、胡椒碱、草质素、甘草查尔酮A及异银杏双黄酮对淫羊藿次苷Ⅱ在不同种属肝微粒体及人肠微粒体中葡萄糖醛酸化反应的抑制作用,并对具有较强抑制作用的抑制剂(半数抑制浓度IC50≤10 μmol/L)在人肝微粒体中的抑制机制进行系统的研究,测定IC50及抑制常数(Ki)值,为提高淫羊藿次苷Ⅱ生物利用度提供有价值的参考信息。
1 材料 1.1 药品与试剂淫羊藿次苷Ⅱ(批号150627)、山柰酚(批号150414)、槲皮素(批号150302)、柚皮素(批号140330)、桔皮素(批号140912)、水飞蓟素(批号141102)、胡椒碱(批号150329)、草质素(批号141217)、甘草查尔酮A(批号150724)、异银杏双黄酮(批号140316),质量分数均大于98%,购于成都普菲德生物技术有限公司。
淫羊藿次苷Ⅱ-7-O-葡萄糖醛酸代谢产物,实验室制备,制备方法见“2.3”项;尿苷二磷酸葡萄糖醛酸(UDPGA,批号069K7017V)、聚乙二醇十六烷基醚(批号055K0045),购于美国Sigma-Aldrich公司;氯化镁(MgCl2,批号20100110)、盐酸(分析纯,批号20150818),购于天津市科密欧化学试剂有限公司;Tris碱(批号527K073),购于北京索莱宝科技有限公司;甲酸(色谱纯,批号A0326132),购于美国Acros organics公司。
SD大鼠肝微粒体(批号BDVH)、恒河猴肝微粒体(批号ZDD)、小型猪肝微粒体(批号RUIB)、人肝微粒体(批号LPS)、人肠微粒体(批号UGU),均购于上海瑞德肝脏疾病研究有限公司;甲醇和乙腈(色谱纯),购于美国Fisher Scientific公司;二甲基亚砜(DMSO,批号14010920),购于美国TEDIA公司;去离子水,自制。
1.2 仪器SHIMADZU超快速高效液相色谱仪(UFLC)、LC-30AD高压泵、SPD-20A紫外/可见光检测器、CBM-20A系统控制器、DGU-20A真空在线脱气机、SIL-30AC自动进样器、CTO-30A柱温箱、LabSolutions 5.81数据处理系统,日本SHIMADZU公司;Thermo-Shaker MS-100恒温混匀仪、HERAEUS X1R低温高速离心机,美国Thermo Scientific公司;LAB DANCER S25涡旋振荡器,德国IKA公司;BSA224S分析天平,北京赛多利斯科学仪器有限公司;Milli-Q超纯水制备系统,美国MILLIPORE公司;IMS-20制冰机,江苏省常熟市雪科电器有限公司。
2 方法 2.1 主要溶液的配制精密称取淫羊藿次苷Ⅱ适量,DMSO溶解,配制成浓度为0.5 mmol/L的标准溶液;分别精密称取山柰酚、槲皮素、柚皮素、桔皮素、水飞蓟素、胡椒碱、草质素、甘草查尔酮A、异银杏双黄酮适量,DMSO溶解,配制成浓度为20 mmol/L的标准溶液,DMSO依次稀释,分别得到浓度为2.0、0.2 mmol/L的标准溶液,保存于4 ℃冰箱待用。
2.2 UFLC色谱条件SHIMADZU VP-ODS C18色谱柱(5 μm,150.0 mm×2.1 mm);柱温40 ℃;流动相为乙腈(A)-0.2%甲酸水(B);梯度洗脱程序:0~7.0 min,90%~10% B;7.0~8.0 min,10% B;8.0~9.0 min,10%~90% B;9.0~12.0 min,90% B;体积流量0.4 mL/min;检测波长270 nm;进样量5 μL。
2.3 淫羊藿次苷Ⅱ葡萄糖醛酸代谢产物的制备采用500 μmol/L淫羊藿次苷Ⅱ与蛋白浓度为0.5 mg/mL的人重组酶UGT1A1进行代谢产物制备。37 ℃孵育24 h,加入等体积乙腈终止反应,离心移取上清液置旋转蒸发仪中除去有机溶剂。残留液通过SPE固相萃取柱(C18WAX,北京华谱新创科技有限公司)进行富集和选择性洗脱。
2.4 淫羊藿次苷Ⅱ的UGT抑制剂筛选孵育体系包括:50 mmol/L Tris-HCl缓冲液(pH值为7.4)、5 mmol/L MgCl2、2 mmol/L UDPGA、1 mg/mL Brij 58。人肝、肠微粒体蛋白浓度分别为0.03、0.10 mg/mL,淫羊藿次苷Ⅱ浓度分别为2.5、5.0 μmol/L。大鼠和猴肝微粒体蛋白浓度均为0.03 mg/mL,小型猪肝微粒体蛋白浓度为0.2 mg/mL,淫羊藿次苷Ⅱ浓度均为5 μmol/L。
抑制剂槲皮素、山柰酚、桔皮素、柚皮素、水飞蓟素、胡椒碱、草质素、甘草查尔酮A及异银杏双黄酮浓度分别为1、10、100 μmol/L,每个样品体积为200 μL,双样本,反应体系中DMSO水平控制在1%。
孵育反应液在金属恒温震荡仪中预孵3 min后,加入UDPGA启动反应,于37 ℃孵育20 min后加入200 μL冰乙腈终止反应,立即涡旋混匀,4 ℃、14 000 r/min离心20 min,取上清液置UFLC检测。对照组不加抑制剂。
以淫羊藿次苷Ⅱ葡萄糖醛酸化反应代谢产物的生成速率反应孵育体系中UGT酶的活性,对照组UGT酶活性记为100%,样品组中淫羊藿次苷Ⅱ代谢产物的生成速率与对照组中代谢产物生成速率的百分比用以标记UGT酶的残余活性,计算公式如下:
代谢产物生成速率=代谢产物浓度/孵育时间/蛋白浓度
残余活性百分比=样品组代谢产物生成速率/对照组代谢产物生成速率
2.5 所选抑制剂IC50值的测定孵育体系包括:人肝微粒体蛋白浓度为0.03 mg/mL,淫羊藿次苷Ⅱ浓度为2.5 μmol/L,山柰酚与槲皮素浓度均选取为0、0.1、0.2、0.4、0.6、0.8、1.0、1.5、3.0、6.0 μmol/L,甘草查尔酮A的浓度选取为0、1.0、1.4、2.0、3.0、4.0、5.0、6.0、8.0 μmol/L,其余同“2.4”项下条件与操作。
2.6 所选抑制剂Ki值的测定孵育体系包括:人肝微粒体蛋白浓度为0.03 mg/mL,淫羊藿次苷Ⅱ选取的浓度分别为0.80、1.25、2.50、5.00 μmol/L,山柰酚与槲皮素的浓度均选取为0、0.4、0.8、1.6、3.2 μmol/L,甘草查尔酮A的浓度选取0、1、2、3、5 μmol/L,其余同“2.4”项下条件与操作。
2.7 统计学分析竞争性抑制见方程式1,混合性抑制见方程式2,式中的Km和Vmax分别为米氏常数与最大反应速率,[I]是游离抑制剂的浓度,[S]是底物浓度,Ki为抑制常数。IC50应用Graphpad Prism 6.0软件中非线性回归分析计算而得。Ki通常需要在反应体系中设计3~4个底物浓度以及4~5个包括0点在内的抑制剂浓度。抑制动力学类型通过Dixon作图法和Lineweaver-Burk作图法确定,二次作图法计算Ki。
| $v = {{{V_{\max }}\left[ S \right]} \over {{K_m}\left( {1 + \left[ I \right]/{K_i}} \right) + \left[ S \right]}}$ | (1) |
| $v = {{{V_{\max }}\left[ S \right]} \over {{K_m}\left( {1 + \left[ I \right]/{K_i}} \right) + \left[ S \right]\left( {1 + \left[ I \right]/{K_i}} \right)}}$ | (2) |
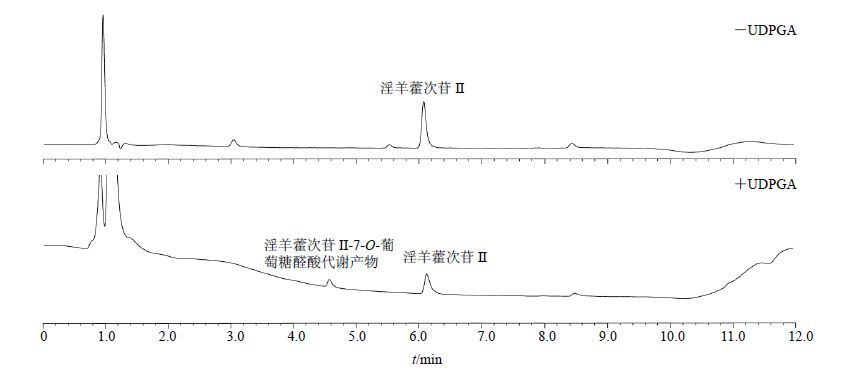
淫羊藿次苷Ⅱ在不同种属肝及人肠微粒体中,主要葡萄糖醛酸代谢产物为淫羊藿次苷Ⅱ-7-O-葡萄糖醛酸代谢产物,人肝微粒体中淫羊藿次苷Ⅱ及其葡萄糖醛酸代谢产物UFLC检测色谱图见图 1。
|
图 1 人肝微粒体中淫羊藿次苷Ⅱ及其葡萄糖醛酸代谢产物UFLC检测色谱图 Fig. 1 UFLC of icariside Ⅱ and its glucuronide in human liver microsomes |
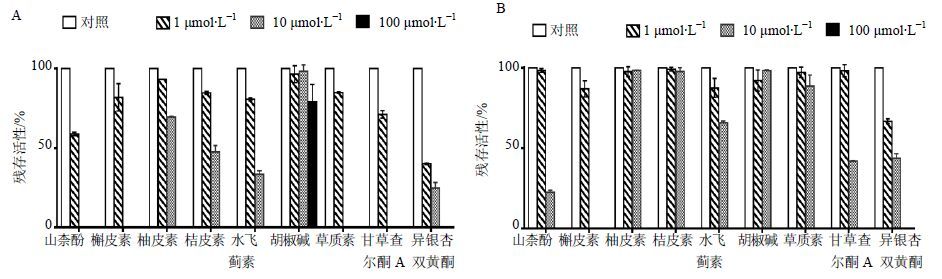
在人肝微粒体中,当抑制剂山柰酚和异银杏双黄酮浓度为1 μmol/L时,代谢酶残余活性分别为58.9%和40.0%;当抑制剂山柰酚、槲皮素、草质素及甘草查尔酮A浓度为10 μmol/L时,代谢酶残余活性均为0。在人肠微粒体中,当抑制剂槲皮素浓度为10 μmol/L时,代谢酶残余活性为0,结果见图 2。
|
图 2 人肝(A)、肠(B)微粒体中抑制剂筛选结果(x±s,n = 2) Fig. 2 Inhibitor screening of icariside Ⅱ in human liver (A) and intestinal microsomes (B) (x±s,n = 2) |
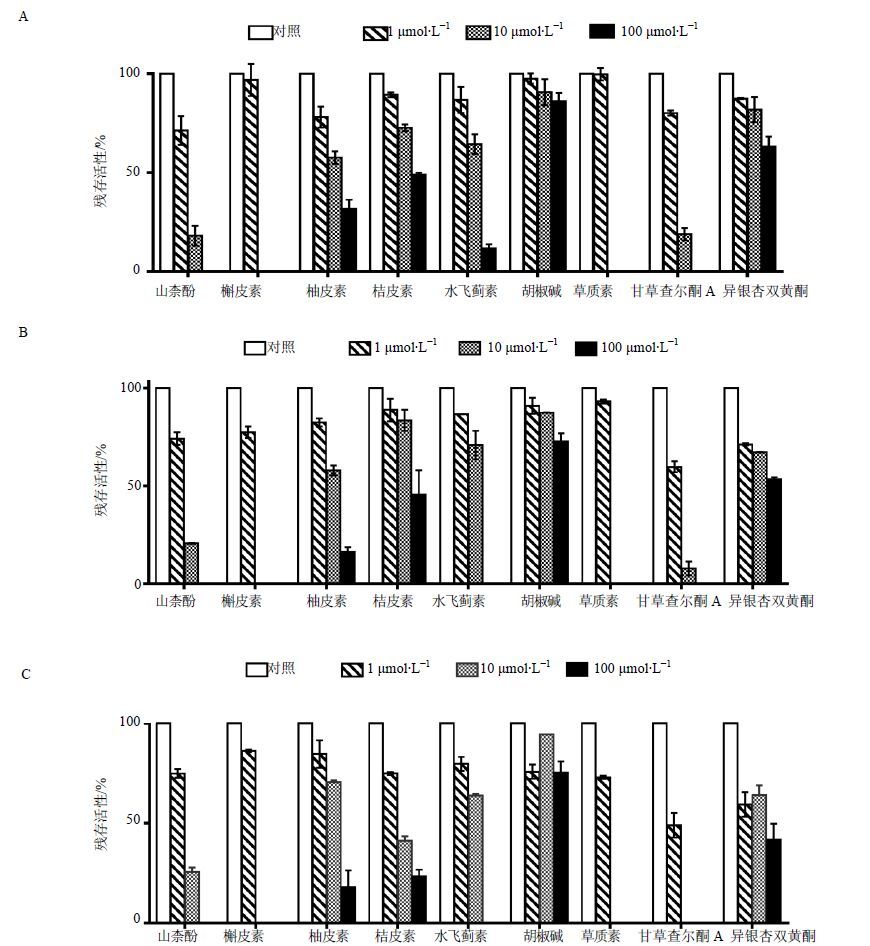
在大鼠肝微粒体中,当抑制剂山柰酚和甘草查尔酮A浓度为10 μmol/L时,代谢酶残余活性分别为18.2%、19.0%。在小型猪肝微粒体中,当抑制剂甘草查尔酮A浓度为1 μmol/L时,代谢酶残余活性为59.7%;当抑制剂槲皮素与草质素浓度为10 μmol/L时,代谢酶残余活性均为0,山柰酚和甘草查尔酮A组代谢酶残余活性分别为20.6%、7.88%。在猴肝微粒体中,当抑制剂甘草查尔酮A和异银杏双黄酮浓度为1 μmol/L时,代谢酶残余活性分别为48.9%、59.4%;当抑制剂槲皮素、草质素和甘草查尔酮A浓度为10 μmol/L时,代谢酶残余活性为0,山柰酚组代谢酶残余活性为25.5%,结果见图 3。
|
图 3 大鼠(A)、小型猪(B)和猴(C)肝微粒体中抑制剂筛选结果 (x±s,n = 2) Fig. 3 Inhibitor screening of icariside Ⅱ in rat (A),pig (B),and monkey (C) liver microsomes (x±s,n = 2) |
结果表明,在人、大鼠、小型猪、猴肝微粒体及人肠微粒体中,山柰酚、槲皮素、草质素及甘草查尔酮A均对淫羊藿次苷Ⅱ的葡萄糖醛酸化反应有较强的抑制作用。根据实验结果,选择具有较强抑制作用的山柰酚、槲皮素和甘草查尔酮A,测定其对人肝微粒体中淫羊藿次苷Ⅱ葡萄糖醛酸化代谢抑制作用的IC50及Ki值。
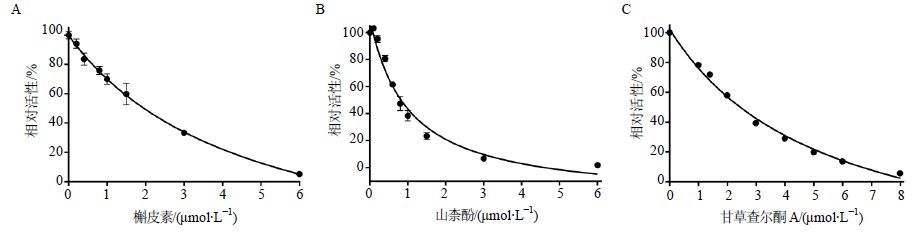
3.2 IC50及Ki值测定结果利用不同浓度的抑制剂绘制剂量相关性曲线,结果见图 4,非线性拟合求得抑制剂抑制作用的IC50值,结果见表 1。山柰酚、槲皮素及甘草查尔酮A对淫羊藿次苷Ⅱ在人肝微粒体中的葡萄糖醛酸化反应均有较强程度的抑制作用,IC50值分别为(1.01±0.26)、(4.65±0.51)、(5.34±1.00) µmol/L,山柰酚对人肝微粒体的抑制作用略强于槲皮素及甘草查尔酮A。
|
图 4 抑制剂槲皮素(A)、山柰酚(B)与甘草查尔酮A(C)的剂量依赖性曲线(x±s,n = 2) Fig. 4 Dose-dependent curves of inhibitors quercetin (A),kaempferol (B),and licochalcone A (C) (x±s,n = 2) |
| 表 1 抑制剂山柰酚、槲皮素与甘草查尔酮在人肝微粒体中IC50与Ki值 Table 1 IC50 and Ki values of inhibitor kaempferol,quercetin,and licochalcone A in human liver microsomes |
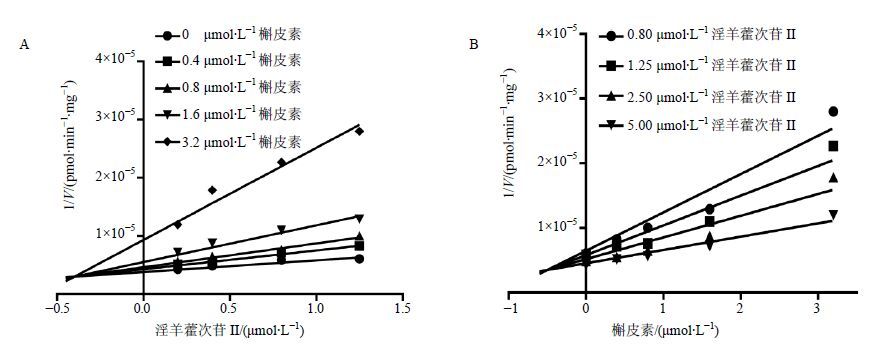
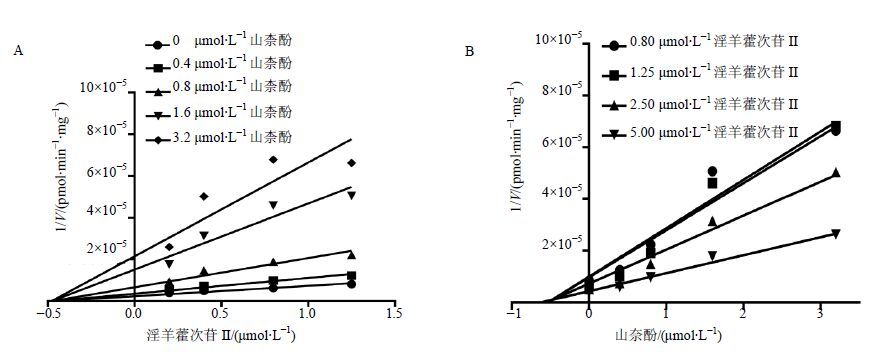
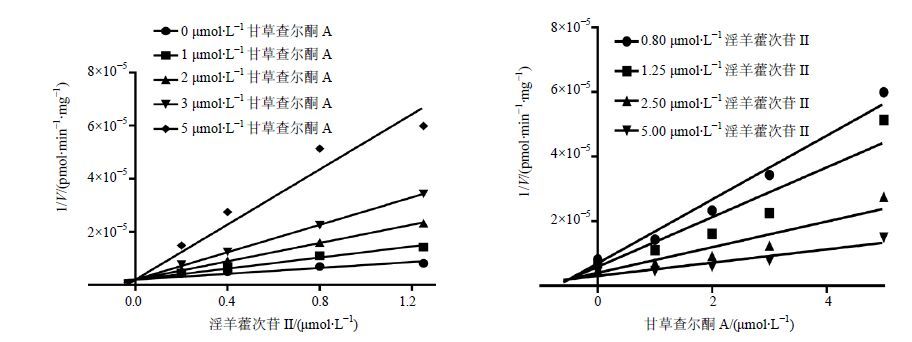
分别以混合型、竞争性及非竞争性抑制模型拟合数据,结果见图 5至图 7,Dixon作图法及Lineweaver- Burk作图法表明,甘草查尔酮A能够竞争性抑制淫羊藿次苷Ⅱ在人肝微粒体中的葡萄糖醛酸化反应,Ki值为0.18 µmol/L;槲皮素对淫羊藿次苷Ⅱ的葡萄糖醛酸化反应遵循混合型抑制动力学模型,Ki值为0.23 µmol/L;山柰酚则符合非竞争型抑制动力学模型,Ki值为0.36 µmol/L,结果见表 1。
|
图 5 抑制剂槲皮素的Dixon图(A)与Lineweaver-Burk图(B)结果(n = 2) Fig. 5 Dixon plot (A) and Lineweaver-Burk plot (B) of inhibitory effects of quercetin (n = 2) |
|
图 6 抑制剂山柰酚的Dixon图(A)与Lineweaver-Burk图(B)结果 (n = 2) Fig. 6 Dixon plot (A) and Lineweaver-Burk plot (B) of inhibitory effects of kaempferol (n = 2) |
|
图 7 抑制剂甘草查尔酮A的Dixon图与Lineweaver-Burk图结果(n = 2) Fig. 7 Lineweaver-Burk plot and Dixon plot of inhibitory effects of licochalcone A (n = 2) |
4 讨论
本研究考察了山柰酚、槲皮素及甘草查尔酮A等9种化合物对人、大鼠、小型猪、猴肝微粒体及人肠微粒体中淫羊藿次苷Ⅱ葡萄糖醛酸化反应的影响。淫羊藿次苷Ⅱ属于黄酮类化合物,研究证实,多种黄酮类化合物联合使用时,其中的一种或者几种黄酮类化合物会对另一黄酮化合物的动力学产生影响,使其生物利用度得到改善[14],因此本实验抑制剂的选择主要以黄酮类化合物为主。
虽然有文献报道和实验室未发表数据表明上述9种化合物均是葡萄糖醛酸化反应的抑制剂[15-22],但代谢酶抑制剂存在底物选择性,底物不同,抑制剂对代谢酶的抑制能力不同。代谢研究的实验动物模型选择关系到预测人体内情况的准确性,故本研究首先对以上9种化合物在不同种属肝微粒体及人肠微粒体中对淫羊藿次苷Ⅱ葡萄糖醛酸化反应的抑制能力进行初筛,对化合物的抑制能力进行评价,为进一步体内实验动物模型的选择提供参考信息。在人、大鼠、小型猪、猴肝微粒体及人肠微粒体中,山柰酚、槲皮素、草质素及甘草查尔酮A均对淫羊藿次苷Ⅱ的葡萄糖醛酸化反应有较强的抑制作用,IC50估算值均在10 μmol/L以下。草质素虽然抑制能力强,但体外试验时发现,将草质素加入反应体系后会使体系颜色发生明显变化,由于机制不明确,因此不将其纳入下一步抑制机制的研究范围内。
代谢性药物-药物相互作用是一把“双刃剑”,对于治疗窗窄且通过单一酶代谢的药物而言,与其代谢酶抑制剂合用后往往会引起毒副作用增加,导致治疗失败;但其也可以被积极利用,特别是针对一些受首过效应影响显著导致生物利用度偏低的药物而言,与代谢酶抑制剂合用后生物利用度会得到明显改善。Basu等[23]利用姜黄素抑制霉酚酸的葡萄糖醛酸化反应,最终使霉酚酸的游离药物浓度提高了6到9倍。本研究结果显示,山柰酚、槲皮素及甘草查尔酮A对于淫羊藿次苷Ⅱ在微粒体中的葡萄糖醛酸化反应均具有较强的抑制作用,在人肝微粒体中的Ki值分别达到了0.36、0.23、0.18 μmol/L。尽管体外结果表明3者均能降低淫羊藿次苷Ⅱ的代谢速率,与淫羊藿次苷Ⅱ合用后有可能改善其生物利用度。但体外实验结果只是提供了一个选择的方向,并不能完全反应体内的真实情况,因此,三者分别与淫羊藿次苷Ⅱ合用后是否能够提高其生物利用度还需进一步体内实验的验证。
| [1] | 韩广轩, 王麦莉, 张军东, 等. 淫羊藿化学成分研究进展[J]. 药学实践杂志,2002,20 (6) :359–361. |
| [2] | Ma H, He X, Yang Y, et al. The genus Epimedium:an ethnopharmacological and phytochemical review[J]. J Ethnopharmacology, 2011, 134 (3) :519–541. |
| [3] | 韩惠, 单淇, 周福军, 等. 淫羊藿中活性成分的代谢产物研究进展[J]. 现代药物与临床,2013,28 (1) :78–82. |
| [4] | 徐文芬, 杨雯, 何顺志, 等. 一测多评法测定淫羊藿中淫羊藿苷和朝藿定A、B、C[J]. 中草药,2016,47 (1) :130–137. |
| [5] | 刘铁汉, 王毅, 王本祥, 等. 淫羊藿苷的肠菌代谢研究Ⅰ.肠内细菌对淫羊藿苷的代谢转化[J]. 中草药,2000,31 (11) :834–837. |
| [6] | 翟远坤, 葛宝丰, 陈克明, 等. 淫羊藿苷与其代谢产物淫羊藿次苷Ⅱ对骨髓间充质干细胞成骨性分化影响的比较研究[J]. 中药材,2010,33 (12) :1896–1900. |
| [7] | 韩惠, 单淇, 周福军, 等. 淫羊藿中活性成分的代谢产物研究进展[J]. 现代药物与临床,2013,28 (1) :78–81. |
| [8] | 周欣, 翟所迪. 选择性磷酸二酯酶5抑制剂治疗阴茎勃起功能障碍的临床评价[J]. 中国医院用药评价与分析,2009,9 (6) :408–410. |
| [9] | Wang H, Liu Y, Huai Q, et al. Multiple conformations of phosphodiesterase-5:implications for enzyme function and drug development[J]. J Biol Chem, 2006, 281 (30) :21469–21479. |
| [10] | Cheng T, Zhang Y, Zhang T, et al. Comparative pharmacokinetics study of icariin and icariside Ⅱ in rats[J]. Molecules, 2015, 20 (12) :21274–21286. |
| [11] | Zhao H, Fan M, Fan L, et al. Liquid chromatography-tandem mass spectrometry analysis of metabolites in rats after administration of prenylflavonoids from Epimediums[J]. J Chromatography B, 2010, 878 (16) :1113–1124. |
| [12] | Rowland A, Miners J O, Mackenzie P I. The UDP-glucuronosyltransferases:their role in drug metabolism and detoxification[J]. Int J Biochem Cell Biol, 2013, 45 (6) :1121–1132. |
| [13] | Tukey R H, Strassburg C P. Human UDP-glucuronosyl-transferases:metabolism, expression, and disease[J]. Annu Rev Pharmacol Toxicol, 2000, 40 (1) :581–616. |
| [14] | Moon Y J, Morris M E. Pharmacokinetics and bioavailability of the bioflavonoid biochanin A:effects of quercetin and EGCG on biochanin A disposition in rats[J]. Mol Pharm, 2007, 4 (6) :865–872. |
| [15] | Gufford B T, Chen G, Vergara A G, et al. Milk Thistle Constituents Inhibit Raloxifene Intestinal Glucuronidation:A Potential Clinically Relevant Natural Product-Drug Interaction[J]. Drug Metab Dispos, 2015, 43 (9) :1353–1359. |
| [16] | Sridar C, Goosen T C, Kent U M, et al. Silybin inactivates cytochromes P450 3A4 and 2C9 and inhibits major hepatic glucuronosyltransferases[J]. Drug Metab Dispos, 2004, 32 (6) :587–594. |
| [17] | Breinholt V M, Offord E A, Brouwer C, et al. In vitro investigation of cytochrome P450-mediated metabolism of dietary flavonoids[J]. Food Chem Toxicol, 2002, 40 (5) :609–616. |
| [18] | Zhou H, Shi R, Ma B, et al. CYP4501A2 and multiple UGT1A isoforms are responsible for jatrorrhizine metabolism in human liver microsomes[J]. Biopharm Drug Dispos, 2013, 34 (3) :176–185. |
| [19] | Stachel N, Skopp G. Formation and inhibition of ethyl glucuronide and ethyl sulfate[J]. Forensic Sci Int, 2016, 265 :61–64. |
| [20] | Williams J A, Ring B J, Cantrell V E, et al. Differential modulation of UDP-glucuronosyltransferase 1A1 (UGT1A1)-catalyzed estradiol-3-glucuronidation by the addition of UGT1A1 substrates and other compounds to human liver microsomes[J]. Drug Metab Dispos, 2002, 30 (11) :1266–1273. |
| [21] | Xin H, Qi X Y, Wu J J, et al. Assessment of the inhibition potential of Licochalcone A against human UDP-glucuronosyltransferases[J]. Food Chem Toxicol, 2016, 90 :112–122. |
| [22] | Singh J, Dubey R K, Atal C K. Piperine-mediated inhibition of glucuronidation activity in isolated epithelial cells of the guinea-pig small intestine:evidence that piperine lowers the endogeneous UDP-glucuronic acid content[J]. J Pharmacol Exp Ther, 1986, 236 (2) :488–493. |
| [23] | Basu N K, Kole L, Basu M, et al. Targeted inhibition of glucuronidation markedly improves drug efficacy in mice-a model[J]. Biochem Biophys Res Commun, 2007, 360 (1) :7–13. |
 2016, Vol. 39
2016, Vol. 39


