2. 河南省动物性食品安全重点实验室, 河南 郑州 450000
2. Key Laboratory for Animal-Derived Food Safety of Henan province, Zhengzhou 45000, China
中药的双向调节作用是指某一中药既可使机体从亢进状态向正常转化,也可使机体从功能低下状态向正常转化,因机体所处病理状态不同而产生截然相反的药理作用,最终使机体达到平衡状态。很多中药因其剂量、炮制方法、有效部位等不同,具有双向调节作用[1]。板蓝根多糖(Isatidis Radix polysaccharides,IRPS)是板蓝根中具有免疫调节活性的一类物质,对特异性免疫和非特异性免疫均有一定的促进作用[2-4],可促进猪、鸡脾脏淋巴细胞的增殖,提高猪、鸡的特异性免疫抗体。耿婵娟[5]报道,板蓝根多糖可提升免疫抑制小鼠的免疫功能。本实验室前期研究发现,板蓝根多糖因剂量不同而表现出双向调节作用,那么最佳的免疫增强剂量对于处于不同状态的机体是否具有双向调节作用呢?本实验用环磷酰胺(Cy)制备免疫亢进和免疫抑制大鼠模型,研究板蓝根多糖的双向免疫调节作用。
1 材料 1.1 药物及主要试剂板蓝根,购自郑州市药材公司,经河南农业大学农学院中药学系高致明教授鉴定为十字花科植物菘蓝Isatis indigotica Fort.的干燥根。水煮醇沉法[6]提取IRPS,提取率为3.45%,经硫酸-蒽酮法测定其中多糖质量分数为64.2%。
鸡卵清白蛋白(OVA),索来宝公司;注射用Cy,美国Baxter公司;CCK-8,日本同仁公司。
1.2 细胞淋巴瘤YAC-1细胞,购于上海复祥生物科技有限公司。
1.3 主要仪器电子天平,上海青海仪器有限公司;旋转蒸发仪,上海青浦沪西仪器厂;可见紫外分光光度计,上海美谱达仪器有限公司;低速离心机,安徽中科中佳科学仪器有限公司;CO2培养箱,日本三洋公司;XD-202倒置式生物显微镜,江南永新光学有限公司;双人双面净化工作台,苏州净化设备有限公司;酶标仪,美国Thermo公司。
1.4 动物颈静脉插管SD大鼠,购自北京赛默赛斯生物科技有限公司,体质量(220±20)g,生产许可证号SCXK(京)2011-0004。
2 方法 2.1 动物分组36只颈静脉插管大鼠,随机分为6组:免疫正常(NS)组、免疫亢进(IH)组、免疫抑制(IS)组、IRPS组、IH+IRPS组、IS+IRPS组,每组6只。各组大鼠均ip 100 mg OVA进行免疫,IH[7]和IH+IRPS组免疫前3 d进行单次ip Cy 20 mg/kg,IS[7]和IS+IRPS组于免疫后6 h进行单次ip Cy 100 mg/kg,NS和IRPS组于免疫后6 h ip等量生理盐水。从免疫第2天开始,IRPS、IH+IRPS和IS+IRPS组每天ig 60 mg/kg(生药浓度)IRPS[8],NS、IH和IS组每天ig等量生理盐水,连续3 d。
2.2 淋巴细胞增殖实验免疫后第6、12天,每组大鼠分别处死3只,无菌取脾脏,分离淋巴细胞[9],测定淋巴细胞增殖情况[10]。
2.3 NK细胞活性检测取“2.2”项制备的淋巴细胞作为效应细胞,取培养24 h处在对数生长期的YAC-1细胞作为靶细胞,测定NK细胞活性[7]。
2.4 OVA抗体水平检测免疫后第6、12天,大鼠眼球采血,4 ℃静置直至血清析出,1 500 r/min离心15 min,随后吸出血清,按试剂盒说明书检测各组血清OVA抗体水平。
2.5 细胞因子检测在免疫后第1~10、12天,各组大鼠颈静脉采血,37 ℃静置2 h,4 ℃静置直至血清析出,1 500 r/min离心15 min,吸出血清放置-40 ℃保存,样品送往上海MILLIPLEX公司,液相芯片多重细胞因子技术检测γ-干扰素(IFN-γ)、白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)以及肿瘤坏死因子-α(TNF-α)水平。
2.6 数据处理采用SPSS 18.0软件进行统计学分析,数据以x±s表示,组间比较采用方差分析中多重比较。
3 结果 3.1 对不同免疫状态大鼠T、B淋巴细胞增殖的影响免疫后第6天,IH组T、B淋巴细胞增殖能力显著高于NS组,IRPS显著降低IH组B淋巴细胞增殖,升高T淋巴细胞增殖;IS组B淋巴细胞增殖能力显著下降,IRPS对其有促进作用,但差异不显著;IRPS对免疫正常大鼠的B淋巴细胞增殖有显著抑制作用。
免疫后第12天,IRPS可显著促进NS和IH组大鼠T、B淋巴细胞的增殖;IS组T淋巴细胞增殖能力显著低于NS组,IRPS可促进IS模型大鼠T淋巴细胞增殖活性接近NS组;IRPS可显著提升IS组B淋巴细胞增殖活性。结果见表 1。
| 表 1 IRPS对不同免疫状态大鼠淋巴细胞增殖的影响(x±s,n = 10) Table 1 Effect of IRPS on lymphocyte proliferation of rats in different immune status after immunization (x±s,n = 10) |
3.2 对不同免疫状态大鼠NK细胞活性的影响
免疫后第6天,IS组NK细胞活性显著低于NS组;IRPS显著提升IS和NS组大鼠NK细胞活性,显著抑制IH组大鼠NK细胞活性。免疫后第12天,IS组NK细胞活性显著升高,IRPS显著降低IS组NK细胞活性,使其接近NS组。结果见表 2。
| 表 2 IRPS对不同免疫状态大鼠NK细胞活性的影响(x±s,n = 10) Table 2 Effect of IRPS on NK cell activity of rats with different immune status after immunization (x±s,n = 10) |
3.3 对不同免疫状态大鼠OVA抗体生成的影响
免疫后第6天,与NS组比较,IH组大鼠抗体显著升高,IH+IRPS组抗体水平更高;IS组抗体显著降低,IS+IRPS组抗体水平较IS组增高,与NS组差异不显著。第12天各组大鼠抗体水平差异不显著。结果见表 3。
| 表 3 IRPS对不同免疫状态大鼠OVA抗体产生的影响 (x±s,n = 10) Table 3 Effect of IRPS on levels of OVA IgG of rats with different immune status after immunization (x±s,n = 10) |
3.4 对Th1细胞因子的影响 3.4.1 对IFN-γ分泌的影响
IH组IFN-γ的分泌一直低于NS组,前7 d几乎为0,IRPS在2~4和8~10 d可显著促进IH大鼠IFN-γ的分泌,2、8和10 d差异显著;IS组大鼠IFN-γ的分泌在4、9、12 d显著高于NS组,而IRPS在1~4、9和12 d可降低IS大鼠IFN-γ的分泌,9 d差异显著;IRPS对NS大鼠IFN-γ的分泌在2~4、8和10 d有显著促进作用。结果见图 1。
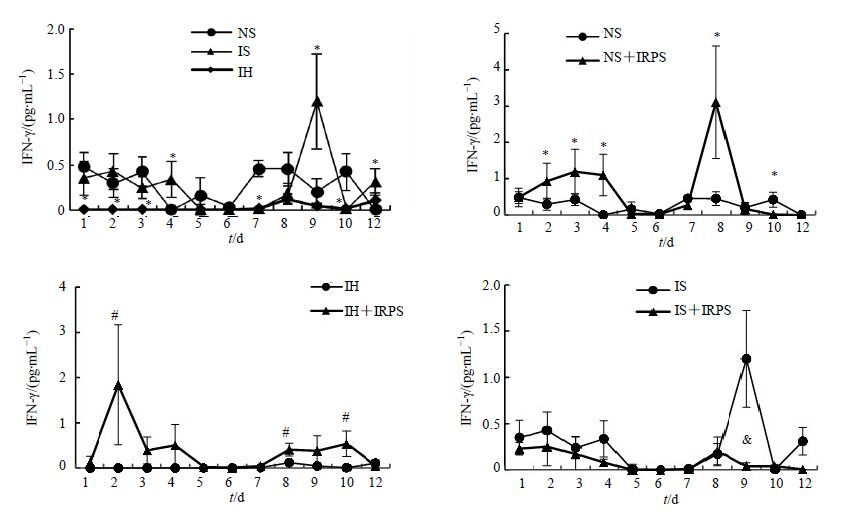
|
图 1 不同组别大鼠IFN-γ水平(x±s,n = 10) Fig. 1 IFN-γ secration of rats in different groups (x±s,n = 10) |
3.4.2 对IL-2表达的影响
IH组IL-2的分泌与NS组比较差异不显著,IRPS对这两组大鼠在1~5 d作用趋势相同,均促进IL-2的分泌;IS组在第7天显著低于对照组,而IRPS对IS大鼠IL-2的分泌影响不大。结果见图 2。
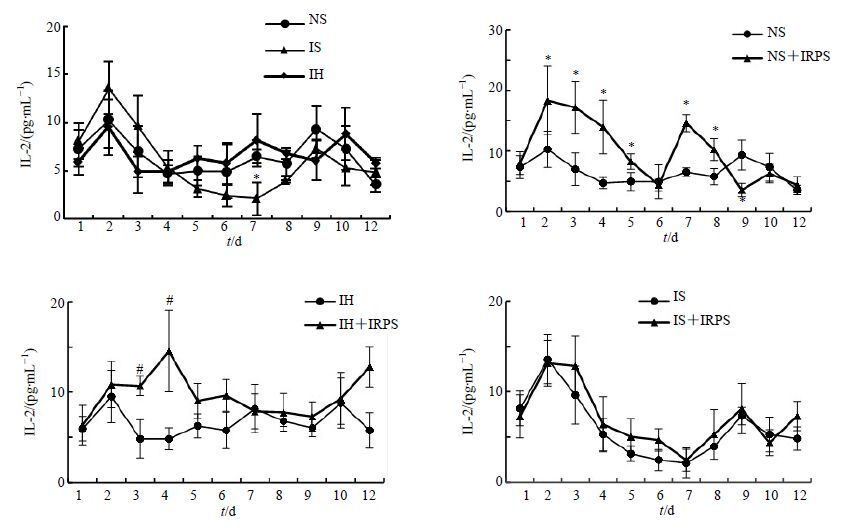
|
图 2 不同组别大鼠IL-2水平(x±s,n = 10) Fig. 2 IL-2 secration of rats in different groups (x±s,n = 10) |
3.4.3 对TNF-α表达的影响
与NS组比较,IH组大鼠TNF-α分泌无显著差异,第4天低于NS组,7、8、9 d高于NS组,而IRPS在3~6 d促进、7~10 d抑制IH大鼠TNF-α的分泌,3、4 d差异显著。
IS组大鼠TNF-α的分泌在5~7 d显著高于NS组,IRPS降低IS大鼠TNF-α的分泌,5 d差异显著,结果见图 3。
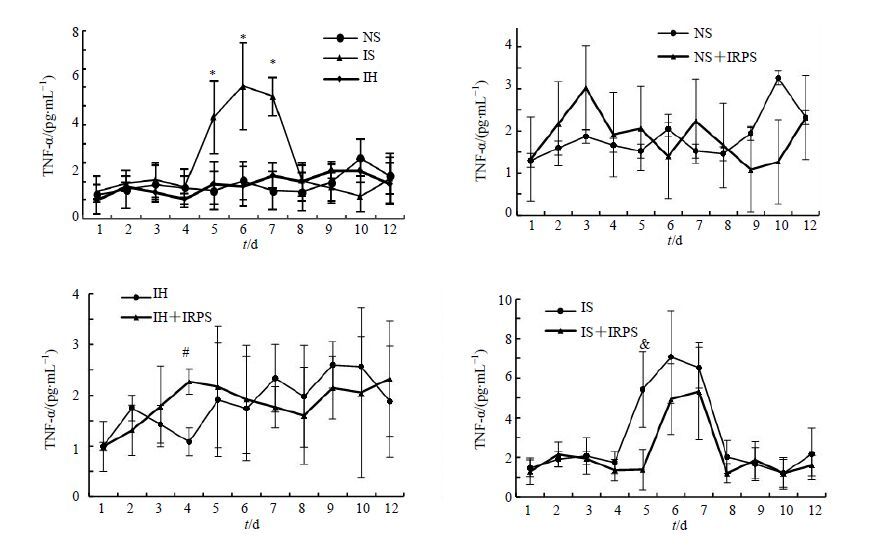
|
图 3 不同组别大鼠TNF-α水平(x±s,n = 10) Fig. 3 TNF-α secration of rats in different groups (x±s,n = 10) |
3.5 对Th 2型细胞因子的影响 3.5.1 对IL-4表达的影响
IH组大鼠与NS组比较,各个时间点IL-4一直处于较低水平,而IRPS在2~4和9~10 d,显著促进IH组大鼠IL-4分泌。IS组在4 d IL-4显著高于NS组(P<0.05),而IRPS在4 d显著降低IS大鼠IL-4的分泌;9 d显著低于NS组,IRPS在9 d显著提升IS大鼠IL-4的分泌(P<0.05)。结果见图 4。
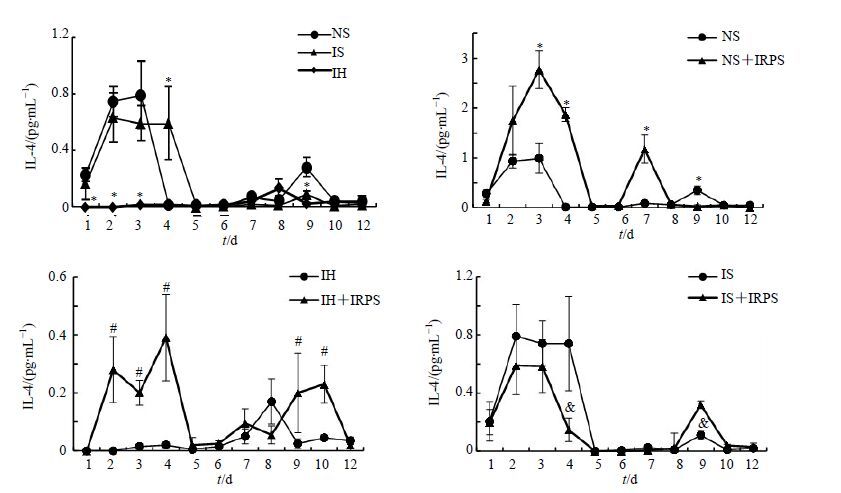
|
图 4 不同组别大鼠IL-4水平(x±s,n = 10) Fig. 4 IL-4 secration of rats in different groups (x±s,n = 10) |
3.5.2 对IL-6表达的影响
IH组大鼠IL-6水平与NS组比较一直很低,第8天显著升高;而IRPS在2~4 d能显著促进IH组大鼠IL-6的表达(P<0.05),在8 d显著下调IL-6的表达,使之趋向于正常。
IS组大鼠IL-6多数时间点一直较高,6和9 d显著高于NS组;而IRPS在3、4、6和9 d,显著降低IS组大鼠IL-6的分泌(P<0.05)。
IRPS在2~4和7~8 d能显著促进NS组大鼠IL-6的分泌(P<0.05),结果见图 5。
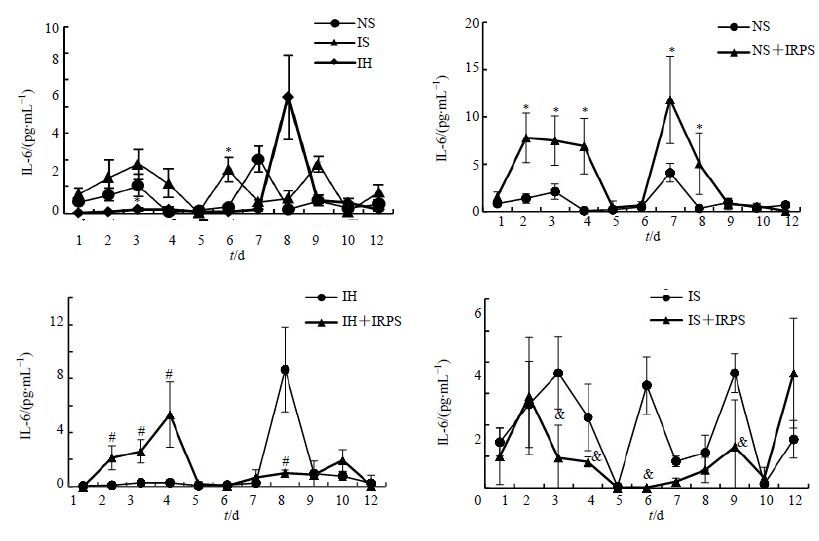
|
图 5 不同组别大鼠IL-6水平(x±s,n = 10) Fig. 5 IL-6 secration of rats in different groups (x±s,n = 10) |
3.5.3 对IL-10表达的影响
IH组IL-10的分泌量与NS组比较,除了第10和12天,其他时间点差异不大,IRPS对NS组和IH组大鼠IL-10分泌的影响趋势相似,第6天之后抑制其分泌,6~10 d差异显著(P<0.05)。
IS组大鼠IL-10表达始终低于NS组,而IRPS在8~12 d促进IS组大鼠IL-10的分泌,8~9 d差异显著(P<0.05),结果见图 6。
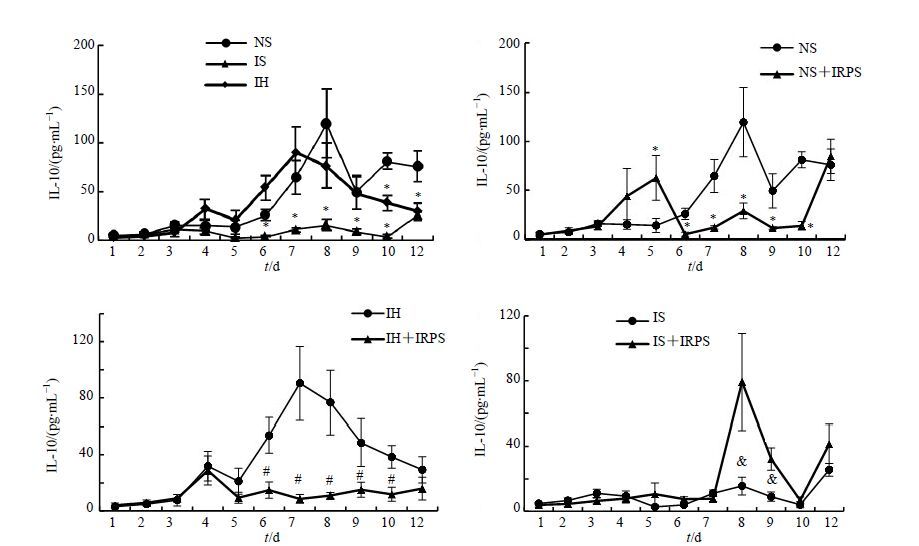
|
图 6 不同组别大鼠IL-10水平(x±s,n = 10) Fig. 6 IL-10 secration of rats in different groups (x±s,n = 10) |
4 讨论
机体的免疫功能可以从免疫细胞、免疫抗体、细胞因子等多方面来评价,本实验选取T、B淋巴细胞转化以及NK细胞活性、OVA抗体和细胞因子作为评价机体免疫功能的指标。
4.1 对不同免疫状态大鼠T、B淋巴细胞增殖的影响IRPS对免疫功能正常大鼠的B淋巴细胞增殖在第6天有显著抑制、第12天显著促进作用。IH组B淋巴细胞增殖能力在6 d显著高于对照组,IRPS则能显著降低其增殖。IS组B淋巴细胞增殖能力在6 d显著低于对照组,IRPS则能促进其增殖,到12 d时差异显著。可以看出IRPS对于不同免疫状态大鼠的B淋巴细胞增殖具有双向调节作用。
IRPS在第6天对免疫功能正常大鼠的T淋巴细胞增殖无显著影响,而在12 d可显著促进T淋巴细胞增殖。IH组大鼠在6 d T淋巴细胞增殖活性显著高于对照组,IRPS在6、12 d能显著提升IH组T淋巴细胞增殖。IS组T淋巴细胞增殖能力显著低于NS组,IRPS可促进IS模型大鼠T淋巴细胞增殖活性接近NS组,但差异不显著。由此可以看出IRPS对于处于不同免疫状态的大鼠T淋巴细胞只有促进增殖作用,没有双向调节作用。
4.2 对不同免疫状态大鼠NK细胞活性的影响NK细胞介导天然免疫应答,在抗肿瘤和早期抗感染过程中起重要作用[11]。前期IRPS对IH大鼠的NK细胞活性有显著抑制作用,对免疫正常和IS大鼠NK细胞有显著促进作用;后期IS大鼠NK细胞活性和NS组比较显著升高,而IRPS则降低该趋势,使之趋于正常。IRPS对于处于不同免疫状态大鼠的NK细胞活性具有双向调节作用。
4.3 对不同免疫状态大鼠OVA抗体的影响与NS组比较,IH组大鼠免疫后第6天抗体显著升高,IH+IRPS组抗体水平更高;IS组抗体显著降低,IS+IRPS组抗体水平较抑制组增高,与NS组显著差异。第12天各组大鼠抗体水平差异不显著。
抗体是由浆细胞(效应B细胞)分泌的,虽然该结果与IRPS对B淋巴细胞增殖活性的影响并不一致,但与IRPS对T细胞的影响一致。B细胞的活化需要双信号作用,第一信号:由BCR-CD79识别抗原产生[12];第二信号:活化Th的CD40L(gP39),与B细胞CD40结合后,可诱导静止B细胞进入细胞增生周期[13]。因此该实验中各免疫状态大鼠的抗体水平变化也可能是辅助T细胞作用的结果,具体原因有待进一步研究。
4.4 对不同免疫状态大鼠Th1型细胞因子的影响目前研究认为Th 1型细胞主要分泌Th1型细胞因子IFN-γ、IL-2、TNF-α、淋巴毒素等,介导细胞免疫,在抗细胞内感染细菌、病毒等方面发挥生物学作用。
实验发现IH组大鼠IFN-γ、TNF-α的分泌多数时间点低于NS组,而IRPS则具有促进其分泌的作用。IS大鼠IFN-γ、TNF-α的分泌高于NS组,而IRPS则抑制其分泌。IRPS对IFN-γ、TNF-α具有双向调节作用。
IL-2在T细胞激活后开始分泌,其量可增加千倍以上。IL-2和受体结合,启动其受体IL-2R与链介导的信号转导通路,使T细胞不仅能持续激活,而且促进T细胞的增殖分化。IRPS能够促进免疫正常大鼠和IH大鼠IL-2的分泌,对抑制组的影响不显著,这与IRPS对各组T淋巴细胞增殖影响的结果相对应。
4.5 对Th2型细胞因子的影响Th2型细胞分泌IL-4、IL-6、IL-10、IL-13等细胞因子,主要介导体液免疫,在抗胞外感染中发挥调节作用[14-15]。IL-4被认为是B细胞生长因子,在抗原激活初始T细胞向Th2细胞分化中发挥重要作用。IL-6可促进T淋巴细胞活化和增生,辅助B淋巴细胞促使抗体合成和分泌,参与体液免疫过程。IL-10是一种多功能负性调节因子,主要由Th2细胞、活化的B细胞、单核细胞、巨噬细胞产生,其最主要功能是通过下调MHC II和共刺激分子CD80/CD86在巨噬细胞和DC的表达,可以作为IS剂参与自身免疫性疾病的调节。
实验发现IH大鼠IL-4和IL-6的分泌量多数时间点都低于NS组,IRPS能促进其表达;而在第8天,IL-4、IL-6高于对照组,IRPS能下调其分泌。IS组IL-4和IL-6的分泌多数时间点高于NS组,IRPS则降低其分泌。IRPS对IL-4、IL-6具有双向调节作用。
IRPS在中期能促进正常免疫状态大鼠IL-10分泌,之后对正常大鼠IL-10分泌有明显抑制作用;中后期IRPS对亢进组大鼠IL-10的表达有明显的抑制作用,抑制组大鼠IL-10的表达一直很低,IRPS起明显促进作用。IRPS对IL-10具有双向调节作用。
实验发现第6天IRPS对不同免疫状态大鼠B淋巴细胞增殖和NK细胞活性均有明显作用,第12天,对不同免疫状态大鼠T淋巴细胞和B淋巴细胞的增殖都有显著的促进作用。这说明IRPS作用于机体最早的靶细胞有可能是B淋巴细胞和NK细胞,之后对T淋巴细胞才有影响。
Th细胞主要分为Th1细胞与Th2细胞两种,其中,Th1细胞参与细胞免疫和迟发性超敏性炎症反应;Th2可辅助B细胞分化为抗体分泌细胞,参与体液免疫应答。对免疫正常大鼠来说,IRPS对Th1和Th2型细胞因子有促进作用,对T、B淋巴细胞的增殖活性也有促进,因此IRPS增强正常免疫大鼠的免疫作用可能是通过作用于免疫细胞进而增加细胞因子的分泌实现的。对IS大鼠来说,免疫第6天B淋巴细胞增殖能力显著下降,IRPS能提升B淋巴细胞增殖能力,而IRPS在7~8 d可提升Th2细胞因子的分泌;对IH组大鼠来说,第6天B淋巴细胞增殖显著升高,IRPS能显著降低B淋巴细胞的增殖能力,而7~8 d IRPS可使其下降。因此IRPS对体液免疫的影响可能是通过调整B细胞增殖能力,进而影响Th2细胞因子的分泌。
综上所述,板蓝根多糖对于处于不同免疫状态大鼠的免疫功能具有双向调节作用,其机制可能是先作用于B淋巴细胞和NK细胞,影响Th2细胞因子的分泌,为了保持Th1/Th2细胞因子的平衡,从而调节Th1细胞因子的分泌,进而影响T淋巴细胞的增殖。
| [1] | 张瑜, 李康清. 论中药双向调节作用机理[J]. 河南中医学院学报,2003,18 (6) :15–17. |
| [2] | 张红英, 赵现敏, 崔保安, 等. 板蓝根多糖对猪繁殖与呼吸综合征疫苗免疫猪T细胞亚群的影响[J]. 中国免疫学杂志,2007,23 (2) :134–137. |
| [3] | 邱妍, 崔保安, 胡元亮, 等. 4种多糖对免疫雏鸡抗体效价和T淋巴细胞的影响[J]. 南京农业大学学报,2008,31 (1) :77–81. |
| [4] | 姜涛, 邹正耀, 张红英, 等. 载板蓝根多糖MPEG-PLA聚合物微球对小鼠免疫力的影响[J]. 中国农学通报,2013,29 (20) :32–35. |
| [5] | 耿婵娟. 板蓝根多糖的提取及其免疫调节作用研究[D]. 大庆:黑龙江八一农垦大学, 2012. |
| [6] | 王学兵, 崔保安, 魏战勇, 等. 板蓝根多糖的提取及其对猪繁殖与呼吸综合征病毒的体外作用[J]. 江苏农业学报,2009,25 (2) :311–314. |
| [7] | 张俊, YongS S, 胡安君, 等. 环磷酰胺致大鼠IS和IH模型的建立与评价[J]. 中国实验动物学报,2015,23 (4) :395–400. |
| [8] | 张 俊. 基于转录因子T-bet、GATA3的IRPS双向免疫调节机理的研究[D]. 郑州:河南农业大学, 2015. |
| [9] | Yee H, Chunmao J, Yuan L H, et al. Immunoenhancement effect of rehmannia glutinosa poly-saccharideon lymphocyte proliferation and dendritic cell[J]. Carbohydr Polym, 2013, 96 (2) :516–521. |
| [10] | 张红英, 王亚宾, 王学兵, 等. 板蓝根多糖对体外培养的猪脾脏淋巴细胞增殖及分泌细胞因子和NO的影响[J]. 河南农业大学学报,2009,43 (2) :173–176. |
| [11] | 田志刚. NK细胞的免疫学调节功能[J]. 国际肿瘤学杂志,1997 (3) :136–138. |
| [12] | Barclay A N, Brown M H, Law S K A, et al. CD79/BCR[J]. Leucocyte Antigen Factsbook, 1997, 13 (11) :332–334. |
| [13] | Laman J D, Claassen E, Noelle R J. Functions of CD40 and its ligand, gp39 (CD40L)[J]. Crit Rev Immunol, 1996, 16 (1) :59–108. |
| [14] | Tamachi T, Takatori H, Fujiwara M, et al. STAT6 inhibits T-bet-independent Th1 cell differentiation[J]. Biochem Biophys Res Commu, 2009, 382 (4) :751–755. |
| [15] | Yates A, Callard R, Stark J. Combining cytokine signalling with T-bet and GATA-3 regulation in Th1 and Th2 differentiation:a model for cellular decision-making[J]. J Theor Biol, 2004, 231 (2) :181–196. |
| [16] | Chakir H, Wang H, Lefebvre D E, et al. T-bet/GATA-3 ratio as a measure of the Th1/Th2 cytokine profile in mixed cell populations:predominant role of GATA-3[J]. J Immunol Methods, 2003, 278 (1-2) :157–169. |
 2016, Vol. 39
2016, Vol. 39


