2. 中国科学院西北高原生物研究所青海省藏药药理学和安全性评价研究重点实验室, 青海 西宁 810001;
3. 中国科学院大学, 北京 100049
2. Key Laboratory of Tibetan Medicine Research, Chinese Academy of Sciences, Xining 810001, China ;
3. University of Chinese Academy of Sciences, Beijing 10049, China
抑郁症是一类情感障碍或心境障碍疾病,临床症状主要为情感低落、焦虑、思维和运动迟缓、精力缺乏、食欲减退、体质量下降、睡眠障碍等,重症抑郁患者甚至会多次出现自伤和自杀行为。全世界患有抑郁症的人数在不断增长,已经成为世界第四大疾病,是一个世界性的问题。预计到2020年,抑郁症将成为仅次于心脏病的人类第二大疾患,成为21世纪人类的主要杀手[1]。抑郁症的发病机制很复杂,目前存在着单胺类神经递质、下丘脑-垂体-肾上腺轴(Hypothalamic pituitary adrenal,HPA)等多种假说。
单胺类神经递质假说是研究最多且最深入的假说,5-羟色胺(serotonin,5-HT)和去甲肾上腺素(norepinephrine,NE)能系统作为目前多数临床抗抑郁药的基础,现在仍然是评价抗抑郁成分的一种重要系统[2]。临床治疗显示,随着抗抑郁药物的给予及症状的改善,5-HT或NE水平逐步增高[3]。HPA轴失调与抑郁和焦虑症紧密相关,在抑郁症患者和长期慢性应激(CMS)模型鼠中,HPA轴的功能异常会引起血清中皮质酮(corticosterone,CORT)和促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH)等浓度的增加[4-5]。
佐太是藏语“仁青欧曲佐珠钦木”的简称,也叫“甘露精王”,是珍宝类藏成药中最为核心的成分[6],迄今已有2 600年的历史[7]。历代名医2 000多年的临床实践证明:佐太不仅对脑溢血、白脉病、麻风、痞瘤、关节痛风、黄水病、高血压、心脏病以及各种炎症、过敏、中毒、病毒等疑难杂症具有奇特的疗效,而且对健康人也具有滋补强身、增强免疫、滋润皮肤、防止皱纹、延年益寿和抗衰老等特殊功效[8]。然而,其确切的作用机制尚不明确,在一定程度上限制了佐太的使用和推广。
佐太和朱砂主要成分都为硫化汞(HgS),其中朱砂具有清心、镇惊、安神、明目、解毒[9]的功效,同时王琪等[10-11]的动物实验表明,小鼠连续口服朱砂可以抑制全脑5-HT和NE水平的升高,连续口服HgS可以抑制全脑中5-HT水平的升高,且小鼠连续口服朱砂,能够显著增加小鼠进入高架十字迷宫开臂的次数和时间,表明朱砂具有一定的抗焦虑作用,那么主要成分也为HgS的佐太是否也具有相同的作用?为探索佐太的潜在药理作用,本研究通过强迫游泳实验、开场实验和不可预测性慢性温和应激(chronic unpredictable mild stress,CUMS)模型来验证佐太是否具有抗抑郁和抗焦虑作用,同时通过检测血清中5-HT和NE水平、HPA轴探讨其抗抑郁和抗焦虑可能作用机制。
1 材料 1.1 动物SPF级KM小鼠,雄性,购买于甘肃中医药大学实验动物中心,许可证号SYXK(甘)2015-0005。所有实验动物均饲养于SPF级动物房内,恒温恒湿环境,机械通风,人工光照,昼夜循环12 h,食物和饮水自由。
1.2 药品和主要试剂佐太,于2010年7月5日购自西藏自治区藏药厂,用2%淀粉溶液(将2 g食用淀粉和100 mL蒸馏水加入500 mL烧杯中,煮沸冷却即得)促悬,主要成分为HgS和单质硫[12-13];盐酸丙咪嗪,质量分数为98%,购于美国3B Scientific公司,批号3B20141026。
大小鼠生长维持饲料,购买于北京科奥协力饲料有限公司,生产许可证号为SCXK(京)2008-2010;5-HT、NE、促肾上腺皮质激素释放激素(CRH)酶联免疫检测试剂盒(美国Cloud-Clone公司);CORT、ACTH酶联免疫检测试剂盒(南京建成生物工程研究所);氯化钠、磷酸二氢钠、磷酸二氢钾、氯化钾、无水乙醇,(分析纯,天津市富宇精细化工有限公司)。
1.3 仪器MiLi-QReference超纯水仪(美国MiLipore公司);ME204 1/10万电子天平(瑞士Mettler Toledo公司);Enspire 2300多功能酶标仪(美国Perkin Elmer公司);PB10 pH计(德国Sartorious公司);Sigma 3K-15高速冷冻离心机(德国Sigma公司);85-2A恒温磁力搅拌器(金坛市科析仪器有限公司);Scientz-48高通量组织研磨器(宁波新芝生物科技股份有限公司);OFT-100大小鼠开场活动实验系统(成都泰盟软件有限公司);Ver 8.2视频编辑专家(北京锐动天地信息技术有限公司);微量移液器(美国Thermo Electron公司);PC3860计数器(深圳市惠波工贸有限公司)。
2 方法 2.1 初步评价实验 2.1.1 动物分组及给药48只KM雄性小鼠适应环境1周后,随机分为6组:对照组,佐太6.07(临床等效剂量)、60.70、303.49、606.97 mg/kg组,丙咪嗪15 mg/kg组,每组8只。每天ig给药1次,给药体积10 mL/kg,连续给药14 d。第14天进行开场实验,第15天进行小鼠强迫游泳实验,第16天摘眼球取血,于第1和16天称小鼠体质量。
2.1.2 强迫游泳实验[14]实验前60 min将小鼠移至一间安静的测试房,减少动物紧张感。实验时将小鼠置于水深10 cm、直径14 cm、水温(23±2)℃的上方开口的圆柱形玻璃容器之中,持续6 min,全程通过高清数码摄像机记录,双盲方式使用计时器统计后4 min内小鼠一动不动的总时间。不动时间定义为小鼠在水中停止挣扎、漂浮于水面以及为了保持头部浮在水面的轻微的游动。
2.1.3 开场实验采用开场实验来评价小鼠自主活动和焦虑水平[15-16]。实验前60 min将小鼠移到开场实验测试房,提前适应环境。实验时将小鼠从笼中取出置于行为学实验站中的开场实验装置(500 mm×500 mm×415 mm)中央,迅速拉上遮光罩帘。在操作软件中记录小鼠编号、日期、状态后打开记录系统,选取九宫格模式,中心区比例为0.5,通过开场设备上方的摄像机及与其相连的监视器记录5 min内小鼠的活动情况并计算运动时间、中央区停留时间百分率(中央区停留时间/300 s)、中央区水平运动百分率(中央区水平运动距离/水平运动距离)、四边区域水平运动百分率(四边区域水平运动距离/水平运动距离)和四角区域水平运动百分率(四角区域水平运动/水平运动距离)。实验结束后将小鼠放回笼内,70 %乙醇彻底擦拭实验装置并用纸巾擦干。
2.1.4 血清中5-HT和NE水平检测小鼠禁食12 h,于给药第16天摘眼球取血置于促凝管中,室温放置1 h,4 ℃、4 000 r/min离心10 min,取血清置于1.5 mL EP管内,−80 ℃保存。ELISA试剂盒法测定血清中5-HT和NE水平。
2.2 CUMS实验 2.2.1 动物分组和给药方式60只KM雄性小鼠在实验开始前均适应环境1周,随机分为6组,分别为对照组,模型组,佐太6.07、60.70、606.97 mg/kg组,丙咪嗪15 mg/kg组,每组10只。每天ig给药1次,给药体积为10 mL/kg,连续给药42 d。第0、42天进行糖水偏爱实验,第43天进行开场实验,第44天进行埋珠实验,第45天进行小鼠悬尾实验,第46天摘眼球取血随后断颈取组织,每周称小鼠体质量。
2.2.2 CUMS模型制备方法CUMS模型采用Katz、Willner等[14-17]的方法并加以改进。所有小鼠进行单笼饲养,对照组不予任何刺激,其余各组在42 d内给予不同的慢性应激刺激。应激方式包括:①剥夺食物24 h、②剥夺饮水24 h、③倾斜笼子45度角24 h、④群养2 h、⑤束缚应激2 h、⑥夜间照明、⑦夹尾15 min、⑧4~8 ℃冷水游泳5 min、⑨暴露异物24 h、⑩空水瓶。以上应激方式顺序随机但同一应激方式不连续应用。
2.2.3 糖水偏爱实验采用糖水偏爱实验来评价快感缺乏症状。实验进行前72 h进行糖水适应训练,于每笼中同时放置2个水瓶,一瓶中装有1%糖水溶液,另一瓶中装有自来水,每12 h更换一次两个水瓶所在位置。适应糖水后,对小鼠同时剥夺食物和饮水23 h。糖水偏爱实验实施于第42天21:00~第43天9:00,每笼小鼠同时给予一瓶装有1%糖水和一瓶装有自来水的水瓶,让其自由饮水。12 h后测定糖水和自来水消耗量,计算糖水偏爱率。
糖水偏爱率=糖水消耗量/(糖水消耗量+自来水消耗量)
2.2.4 悬尾实验[18]实验前60 min将小鼠移至测试房。实验时将小鼠尾巴用胶带固定起来悬挂在实验架上,实验持续6 min,全程通过高清数码摄像机记录,通过双盲方式使用计时器统计后4 min内小鼠不动的总时间。不动时间为小鼠被悬挂后完全不动的时间。
2.2.5 埋珠实验 [19]实验于19:00~22:00的安静环境下进行。将小鼠置于24 cm×14 cm×14 cm塑料盒内,盒内放置厚度为3 cm的垫料并将24颗直径为1.2 cm玻璃球均匀摆放于垫料表面。30 min后将小鼠取出,观察并记录被垫料包埋的玻璃球个数,观察时以玻璃球被覆盖总体积的1/2及以上为准。
2.2.6 HPA轴检测CUMS小鼠于46 d进行摘眼球取血,随后颈椎脱臼处死,取脑置于冰台上,分离称取下丘脑组织。收集到的血样放入促凝管中室温放置1 h,4 ℃、4 000 r/min离心10 min,取血清置于1.5 mL EP管内,−80 ℃保存。随后采用ELISA法测定CORT、ACTH水平。称取下丘脑组织放入1.5 mL EP管中,加入9倍PBS(pH值为1.0~2.0),在组织匀浆器(频率60 Hz)中匀浆2 min,1 000×g离心20 min,取上清−80 ℃保存,ELISA法测定CRH水平。
2.3 统计分析实验数据以x±s表示,应用SPSS 21.0统计软件,数据分析采用单因素方差(one-way ANOVA)分析,post hoc分析采用LSD法。
3 结果 3.1 初步评价实验结果 3.1.1 对小鼠体质量的影响如表 1所示,与对照组比较,给药前后佐太各剂量组小鼠体质量无显著变化。
| 表 1 佐太对小鼠体质量的影响(x±s,n = 10) Table 1 Effects of Zuotai on weight of mice (x±s,n = 10) |
3.1.2 对小鼠强迫游泳实验的影响
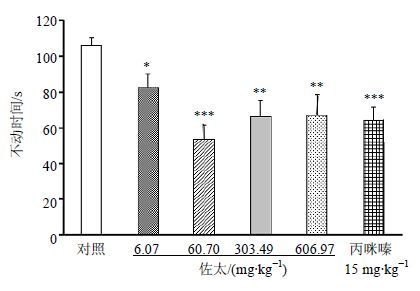
如图 1所示,与对照组比较,佐太6.07、60.70、303.49、606.97 mg/kg组和丙咪嗪15 mg/kg组小鼠强迫游泳实验中不动时间显著减少(P<0.05、0.01、0.001)。
|
图 1 佐太对小鼠强迫游泳实验不动时间的影响(x±s,n = 8) Fig. 1 Effects of Zuotai on immobility time in forced swimming test of mice (x±s,n = 8) |
3.1.3 对小鼠开场实验的影响
如表 2所示,与对照组比较,佐太606.97 mg/kg组小鼠在中央区停留时间、中央区停留时间百分率和中央区水平运动百分率显著增加(P<0.05),而303.49 mg/kg组仅中央区水平运动距离百分率显著增加(P<0.05)。
| 表 2 佐太对开场实验的影响 (x±s,n = 8) Table 2 Effects of Zuotai on open field test in mice (x±s,n = 8) |
3.1.4 对小鼠血清中5-HT和NE水平的影响
如表 3所示,与对照组比较,佐太6.07、606.97 mg/kg组和丙咪嗪15 mg/kg组小鼠血清中5-HT水平显著增加(P<0.05);佐太6.07、303.49、606.97 mg/kg组和丙咪嗪15 mg/kg组小鼠血清中NE水平显著增加(P<0.05、0.01)。
| 表 3 佐太对小鼠血清中5-HT和NE的影响(x±s,n = 8) Table 3 Effects of Zuotai on levels of 5-HT and NE in serum of mice (x±s,n = 8) |
3.2 CUMS实验结果 3.2.1 对CUMS小鼠体质量的影响
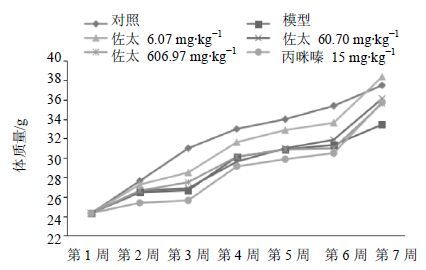
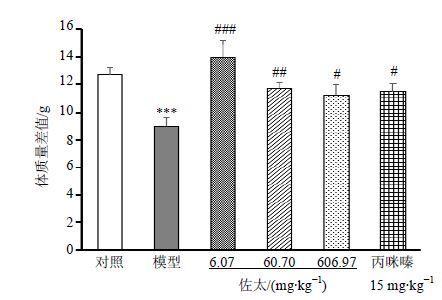
如图 2和3所示,与对照组比较,模型组小鼠体质量增长相对缓慢,体质量差值(第45天体质量-第1天体质量)显著降低(P<0.001);与模型组比较,佐太6.0697、60.6970、606.9700组和丙咪嗪15 mg/kg组小鼠体质量差值显著增加(P<0.05、0.01、0.001)。
|
图 2 佐太对CUMS小鼠体质量的影响(x±s,n = 10) Fig. 2 Effects of Zuotai on weight in CUMS mice (x±s,n = 10) |
|
图 3 佐太对CUMS小鼠实验前后体质量变化的影响(x±s,n = 10) Fig. 3 Effects of Zuotai on weight changes in CUMS mice before and after experiment (x±s,n = 10) |
3.2.2 对CUMS小鼠开场实验活动的影响
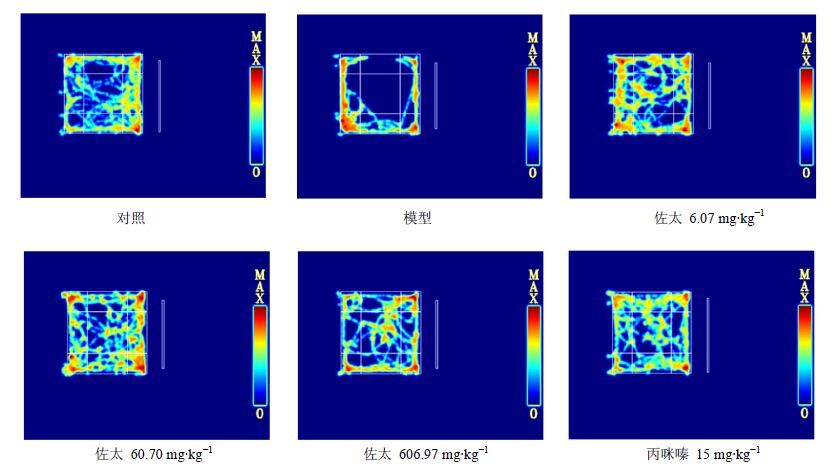
如表 4和图 4所示,与对照组比较,模型组小鼠在开场实验中运动时间(P<0.001)、中央区域停留时间百分率和中央区域水平运动百分率显著减少(P<0.01),在四边区域水平运动百分率(P<0.05)和四角区域水平运动百分率(P<0.001)显著增加;与模型组比较,佐太6.07、60.70、606.97 mg/kg组和丙咪嗪15 mg/kg组小鼠运动时间、中央区停留时间百分率和中央区水平运动百分率显著增加,四边区域水平运动百分率和四角区域水平运动百分率显著降低(P<0.05、0.01、0.001)。
| 表 4 佐太对CUMS小鼠开场实验的影响(x±s,n = 10) Table 4 Effects of Zuotai on open-field test in CUMS mice (x±s,n = 10) |
|
图 4 佐太对CUMS小鼠开场实验中运动轨迹的影响 Fig. 4 Effects of Zuotai on movement locus in open-field test of CUMS mice |
3.2.3 对CUMS小鼠糖水偏爱率的影响
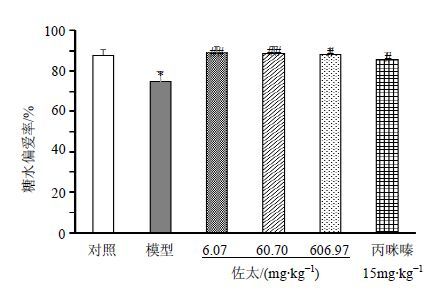
如图 5所示,与对照组比较,模型组小鼠糖水偏爱率显著降低(P<0.05);与模型组比较,佐太6.07、60.70、606.97 mg/kg组和丙咪嗪15 mg/kg组小鼠糖水偏爱率显著增加(P<0.05、0.01)。
|
图 5 佐太对CUMS小鼠糖水偏爱率的影响(x±s,n = 10) Fig. 5 Effects of Zuotai on sucrose preference index in CUMS mice (x±s,n = 10) |
3.2.4 对CUMS小鼠悬尾实验的影响
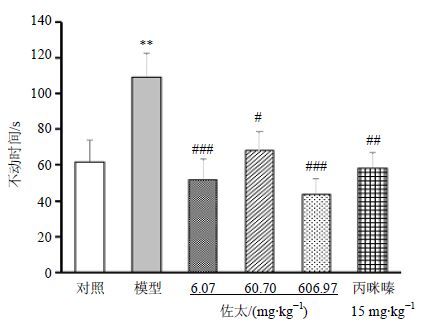
如图 6所示,与对照组比较,模型组小鼠在悬尾实验中不动时间显著增加(P<0.01);与模型组比较,佐太6.07、60.70、606.97组和丙咪嗪15 mg/kg组不动时间显著降低(P<0.05、0.01、0.001)。
|
图 6 佐太对CUMS小鼠悬尾实验不动时间的影响(x±s,n = 10) Fig. 6 Effects of Zuotai on immobility time in tail suspension test of CUMS mice (x±s,n = 10) |
3.2.5 对CUMS小鼠埋珠实验的影响
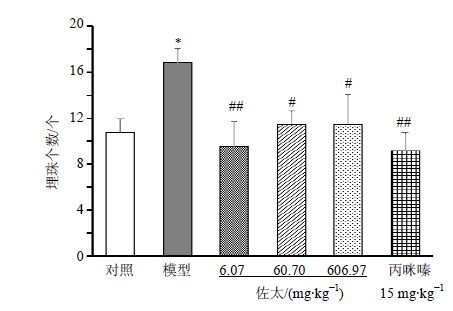
如图 7所示,与对照组比较,模型组小鼠埋珠个数显著增加(P<0.05),其余各组没有显著性差异;与模型组小鼠比较,佐太6.07、60.70、606.97 mg/kg组和丙咪嗪15 mg/kg组小鼠埋珠个数显著减少(P<0.05、0.01)。
|
图 7 佐太对CUMS小鼠埋珠实验的影响(x±s,n = 10) Fig. 7 Effects of Zuotai on marble burying test in CUMS mice (x±s,n = 10) |
3.2.6 对CUMS小鼠HPA轴的影响
如表 5所示,与对照组比较,模型组小鼠血清中CORT、ACTH和下丘脑中CRH水平显著升高(P<0.05、0.01);与模型组比较,佐太6.07、60.70 mg/kg组和丙咪嗪15 mg/kg组小鼠血清中CORT和ACTH、下丘脑中CRH水平显著降低(P<0.05、0.01)。
| 表 5 佐太对CUMS小鼠血清中CORT、ACTH和下丘脑中CRF水平的影响(x±s,n = 10) Table 5 Effects of Zuotai on levels of CORT and ACTH in serum and CRF in hypothalamus of CUMS mice (x±s,n = 10) |
4 讨论
强迫游泳实验为行为绝望模型的一种,是抗抑郁药物评价模型的经典方法也是抗抑郁药评筛常用
的模型之一,广泛用于精神神经药理学的基础研究。动物在恶劣环境下,会出现逃逸行为,当不能逃逸时,便表现出一动不动状态即绝望行为[20-21]。在初步评价实验中,与对照组比较,佐太各剂量组和丙咪嗪组小鼠在强迫游泳实验中不动时间显著降低,表明一定剂量的佐太和丙咪嗪在行为绝望模型中具有一定的抗抑郁作用;在开场实验中,佐太606.97 mg/kg组小鼠在中央区停留时间百分率显著增加,佐太303.49、606.97 mg/kg组小鼠在中央区水平运动百分率显著增加,表明303.49、606.97 mg/kg佐太能够减少小鼠焦虑水平;另外检测小鼠血清中5-HT、NE水平,结果表明,不同剂量的佐太对单胺类神经递质的影响程度可能是不同的,给予14 d 6.07、606.97 mg/kg佐太都能够增加5-HT、NE水平,303.49 mg/kg佐太能够增加NE水平,而佐太60.70 mg/kg组小鼠血清中5-HT和NE水平无显著性变化。
CUMS模型被认为是动物水平研究抑郁症和模拟人类抑郁症状的最有价值和可信度的一类啮齿动物模型[22]。通过给予动物持续数周的、各种不同的温和应激刺激,可以同时诱导动物产生抑郁和焦虑样行为[23-24],使动物产生与临床患者一致的行为学、生物化学和生理学方面的变化[25],能够比较真实的反应动物的内在变化和抗抑郁和焦虑药物的作用。CUMS模型结果表明,经过42 d CUMS慢性应激能够引起小鼠抑郁和焦虑样行为,包括体质量增长减缓、糖水偏爱率降低、开场实验中运动时间的减少、开场实验中央区域停留时间和运动距离的减少、开场实验周边区域运动距离的增加、悬尾实验中不动时间的增加、埋珠实验中埋珠个数的增加,表明造模成功;而给予不同剂量的佐太和丙咪嗪能够缓解CUMS模型引起的上述症状,使抑郁和焦虑小鼠恢复到正常水平,提示佐太具有一定的抗抑郁和抗焦虑作用。其中观察佐太对CUMS小鼠体质量影响结果发现,与模型组比较,6.07 mg/kg佐太组小鼠体质量在第5周开始表现出显著性增长,而在前6周60.70、606.97 mg/kg佐太组和15 mg/kg丙咪嗪组小鼠体质量逐渐增加,但均没有表现出显著性差异,仅在第7周时出现显著性增长,出现这种现象可能是由于以下两点原因:①与对照组比较,给予6周慢性应激后,小鼠体质量显著减轻,表明小鼠经历应激刺激后表现出一定的食欲减退现象,所以在应激结束后模型组小鼠仍然表现出体质量增长减缓,而给药组小鼠由于恢复正常其体质量表现出快速增长;②体质量检测结果表明佐太剂量与体质量变化增长值表现出负相关关系,低剂量佐太更有利于逆转CUMS引起的小鼠体质量增长的异常,而丙咪嗪作为三环类抗抑郁药,可以选择性抑制5-HT和NE的重摄取,在某些情况下能够抑制食欲使得体质量减轻,所以在给药结束后高剂量佐太和丙咪嗪组小鼠在停止服药后体质量得到快速增长。
HPA轴控制着机体对应激的反应并调控体内多种生理过程。近年来的研究显示抑郁和焦虑症与HPA轴功能失调之间存在一定的关系,主要表现为HPA轴功能的亢进,包括中枢CRH分泌增多,外周血ACTH和糖皮质激素(GC,啮齿类动物中为皮质酮CORT)水平升高等[26]。研究表明,有效的抗抑郁和抗焦虑治疗能使亢进的HPA轴恢复到正常水平,治疗后HPA轴活性的高低与病情的复发有很大的关系[27-28]。当前实验结果与其他研究相一致,模型组小鼠血清中CORT和ACTH、下丘脑中CRH水平都显著升高,而给予42 d佐太和丙咪嗪能够降低CORT、ACTH、CRH表达水平,其中6.07、303.49 mg/kg佐太和丙咪嗪具有显著性差异,表明一定剂量的佐太能够抑制由CUMS模型引起的HPA轴亢进,因此佐太对慢性应激模型所致的抑郁和焦虑行为可能是通过调节应激模型小鼠HPA轴亢进程度,从而起到一定的抗抑郁和抗焦虑作用。而606.97 mg/kg佐太产生的抗抑郁和抗焦虑作用可能是通过其他通路进行调节的,可见不同剂量的佐太都能产生一定的抗抑郁和抗焦虑作用,但不同剂量的佐太其具体作用机制很可能是不同的。
综上所述,佐太在强迫游泳模型中具有一定的抗抑郁作用,在开场实验中表现出一定的抗焦虑作用,其作用可能是通过调节5-HT和NE水平发挥作用;同时佐太能够缓解CUMS模型引起的抑郁和焦虑样行为,且可能是通过调节HPA轴功能状态来发挥作用。
| [1] | 徐汉明, 胡晓华. 抑郁症-治疗与研究[M]. 北京: 人民卫生出版社, 2012 : 7 -18. |
| [2] | Elhwuegi A S. Central monoamines and their role in major depression[J]. Prog Neuro-Psychoph, 2004, 28 (3) :435–451. |
| [3] | Krishnan V, Nestler E J. The molecular neurobiology of depression[J]. Nature, 2008, 455 (7215) :894–902. |
| [4] | Pariante C M, Lightman S L. The HPA axis in major depression:classical theories and new developments[J]. Trends Neurosci, 2008, 31 (9) :464–468. |
| [5] | Arborelius L, Owens M J, Plotsky P M, et al. The role of corticotropin-releasing factor in depression and anxiety disorders[J]. J Endocrinol, 1999, 160 (1) :1–12. |
| [6] | Zhao X Y, Sun M, Wang J X, et al. Characterization of tibetan medicine zuota by multiple techniques[J]. Bioinorg Chem Appl, 2013 . doi:10.1155/2013/198545.Epub2013Sep5 |
| [7] | 西藏自治区藏医药管理局编著.西藏藏医药[M]. 拉萨:西藏人民出版社, 2001:212. |
| [8] | 看召本. 透视藏医珍宝类药品中的"佐太"[J]. 中国中药杂志,2013,38 (10) :1621–1623. |
| [9] | 中国药典[S]. 一部. 2015:137. |
| [10] | Wang Q, Yang X, Zhang B, et al. Cinnabar is different from mercuric chloride in mercury absorption and influence on the brain serotonin level[J]. Basic Clin Pharmacol, 2013, 112 (6) :412–417. |
| [11] | Wang Q, Yang X, Zhang B, et al. The anxiolytic effect of cinnabar involves changes of serotonin levels[J]. Eur J Pharmacol, 2007, 565 (1) :132–137. |
| [12] | 李岑, 占堆, 楞本才让, 等. 藏药佐太的化学成分、汞配位结构及微观形貌分析[J]. 光谱学与光谱分析,2015,35 (4) :1072–1078. |
| [13] | 夏振江, 魏立新, 王东平, 等. 藏药炮制品"佐太"的质量标准研究[J]. 中药材,2010,33 (5) :688–690. |
| [14] | 吴俊芳, 刘忞. 现代神经科学研究方法[M]. 北京: 中国协和医科大学出版社, 2006 : 982 -983. |
| [15] | Zhu K Y, Mao Q Q, Ip S P, et al. A standardized Chinese herbal decoction, kai-xin-san, restores decreased levels of neurotransmitters and neurotrophic factors in the brain of chronic stress-induced depressive rats[J]. Evid-Based Compl Alt, 2012 . doi:10.1155/2012/149256 |
| [16] | Choleris E, Thomas A W, Kavaliers M, et al. A detailed ethological analysis of the mouse open field test:effects of diazepam, chlordiazepoxide and an extremely low frequency pulsed magnetic field[J]. Neurosci Biobehavr, 2001, 25 (3) :235–260. |
| [17] | Mao Q Q, Ip S P, Ko K M, et al. Peony glycosides produce antidepressant-like action in mice exposed to chronic unpredictable mild stress:effects on hypothalamic-pituitary-adrenal function and brain-derived neurotrophic factor[J]. Prog Neuro-Psychoph, 2009, 33 (7) :1211–1216. |
| [18] | Crawley J N. What's Wrong with My Mouse?:Behavioral Phenotyping of Transgenic and Knockout Mice[M]. Hoboken, New Jersey: John Wiley &Sons, 2007 : 248 -251. |
| [19] | Gould T D. Mood and Anxiety Related Phenotypes in Mice[M]. New York: Humana Press, 2009 : 37 -45. |
| [20] | Porsolt R D, Bertin A, Jalfre M. Behavioral despair in mice:a primary screening test for antidepressants[J]. Arch Int Pharmacodyn Ther, 1977, 229 (2) :327–336. |
| [21] | Porsolt R D, Le Pichon M, Jalfre M. Depression:a new animal model sensitive to antidepressant treatments[J]. Nature, 1977, 266 (5604) :730–732. |
| [22] | Dang H, Chen Y, Liu X, et al. Antidepressant effects of ginseng total saponins in the forced swimming test and chronic mild stress models of depression[J]. Prog Neuro-Psychoph, 2009, 33 (8) :1417–1424. |
| [23] | Campos A C, Fogaca M V, Aguiar D C, et al. Animal models of anxiety disorders and stress[J]. Rev Bras Psiquiatr, 2013, 35 . |
| [24] | Zhu S, Shi R, Wang J, et al. Unpredictable chronic mild stress not chronic restraint stress induces depressive behaviours in mice[J]. Neuroreport, 2014, 25 (14) :1151–1155. |
| [25] | Katz R J. Animal model of depression:pharmacological sensitivity of a hedonic deficit[J]. Pharmacol Biochemn Behav, 1982, 16 (6) :965–968. |
| [26] | Swaab D F, Bao A M, Lucassen P J. The stress system in the human brain in depression and neurodegeneration[J]. Ageing Res Rev, 2005, 4 (2) :141–194. |
| [27] | Heydendael W, Jacobson L. Glucocorticoid status affects antidepressant regulation of locus coeruleus tyrosine hydroxylase and dorsal raphé tryptophan hydroxylase gene expression[J]. Brain Res, 2009, 1288 :69–78. |
| [28] | Kara S, Yazici K M, Güleç C, et al. Mixed anxiety-depressive disorder and major depressive disorder:comparison of the severity of illness and biological variables[J]. Psychiat Res, 2000, 94 (1) :59–66. |
 2016, Vol. 39
2016, Vol. 39


