2. 天津药物研究院 天津市新药安全评价研究中心, 天津 300193;
3. 天津药物研究院 释药技术与药代动力学国家重点实验室, 天津 300193
2. Tianjin Center for Drug Safety Assessment, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China ;
3. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
代谢组学作为系统生物学的重要组成部分,扮演着揭示生命现象的角色,但目前对血液、尿液等生物样本研究较多[1-3],对体外细胞的代谢组学研究报道相对较少。然而体外细胞模型是新药安全性评价或毒性预测的有力工具[4-5],对药物受试浓度和受试时间的考察与界定是代谢组学研究中重要的前期基础工作。本研究选用盐酸多柔比星(DOX)为体外心肌毒性模型药物,通过对其受试浓度和受试时间的筛选与确定,为进一步的体外心肌毒性代谢组学研究奠定基础,也为此类体外细胞模型的代谢组学研究提供借鉴资料。
1 材料 1.1 药物及主要试剂DOX,每瓶10 mg,批号9QL0093,美国Pfizer公司;DMEM/F12培养基、胎牛血清、青霉素-链霉素混合双抗试液、0.05%胰蛋白酶-0.02% EDTA溶液、II型胶原酶,美国Invirtogen(Gibco)公司;磷酸盐缓冲液(PBS),美国HyClone公司;5-溴脱氧尿嘧啶核苷(BrdU),美国Sigma公司;Cell Titer 96® Aqueous单溶液细胞增殖检测试剂盒(MTS),美国Promega公司。
1.2 仪器Varioskan Flash全自动酶标仪、Sorvall ST16高速冷冻离心机,美国Thermo公司;DKB-501超级恒温水浴槽,上海森信实验仪器有限公司;MCO-18AIC二氧化碳培养箱,日本SANYO公司;FS100-F倒置荧光显微镜,日本NIKON公司。
1.3 动物新生24 h内的SD大鼠,雌雄不限,体质量约12 g,由北京维通利华实验动物技术有限公司提供的雌、雄大鼠合笼饲养生育获得,许可证号SCXK(京)2006-0009。
2 方法 2.1 原代心肌(Primary cardiomyocytes,PC)细胞的分离、培养参照文献方法[6],取新生24 h内的SD大鼠乳鼠数只,75%酒精中浸泡消毒后进行手术取心室细胞,双酶依次消化法充分分离心脏组织中的心肌细胞,缩短差速贴壁时间至20 min,并联合化学抑制法(加入0.1 mmol/L BrdU)进行细胞纯化,制备PC细胞。待心肌细胞于培养72 h后呈现活力良好且均一节律性搏动的细胞簇时即可用于后续实验。
2.2 不同受试浓度DOX培养基的配制1 mL 0.9%氯化钠注射液溶解10 mg DOX,配制成17.20 mol/L(10 g/L)母液。分别吸取该母液进行系列梯度浓度受试药液的配制,最终获得(1)用于筛选受试时间:DOX浓度分别为0.14、0.69、3.44、17.20、86.00、172.00、344.00 μmol/L的受试药物培养基;(2)用于筛选受试浓度:含DOX浓度分别为0.02、0.17、0.86、1.72、2.58、3.44、17.20、43.00、86.00 μmol/L的受试药物培养基。
2.3 实验分组阴性对照组:以不含药物的细胞培养基作为阴性对照,不加入受试细胞;空白对照组:以不含药物的细胞培养基处理细胞;DOX组:以“2.2”项下配制的含有不同浓度DOX的培养基处理细胞。
2.4 体外心肌毒性代谢组学试验的受试时间筛选按照“2.1”项方法分离PC细胞,以1×105/mL的密度接种于96孔板,每孔100 L,接种3块板。培养48 h后,除去BrdU,继续培养1 d后倒置显微镜下可见心肌细胞呈良好的节律性搏动。弃掉原培养基,向孔中依次加入“2.2”项(1)中含不同浓度DOX的培养基,每孔200 L,设阴性对照组和空白对照组,每组设5个复孔。3块96孔板分别于培养24、48、96 h后,采用MTS法测定490 nm处各受试孔的吸光度(A)值,绘制浓度-效应曲线,计算DOX对不同受试时间的PC细胞活力的影响,并求出IC50值及其95%置信区间。
2.5 体外心肌毒性代谢组学试验的受试浓度筛选按照“2.4”项下方法培养细胞及“2.2”项下(2)中的DOX浓度处理细胞,于DOX处理48 h(“2.4”项下实验结果提示的最佳时间)后采用MTS法在490 nm处检测A值,绘制浓度-效应曲线,验证DOX作用48 h对PC细胞的毒性影响,计算IC50值,确定体外心肌毒性代谢组学试验的受试低浓度与高浓度。
2.6 体外心肌毒性代谢组学试验受试浓度和时间的综合确定综合分析“2.4”和“2.5”项下的实验结果,确定体外心肌毒性代谢组学试验的药物处理总周期为48 h,0 h只设空白对照组,6、24和48 h设空白对照、DOX低、高浓度组。显微镜下观察细胞形态的改变。
2.7 数据处理利用GraphPad Prism 5.0软件对心肌毒性检测数据进行四参数希尔方程拟合,绘制浓度-效应曲线,计算相应的IC50值及其95%置信区间,数据均以x±s表示。
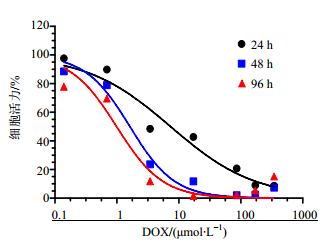
3 结果 3.1 受试时间筛选结果按照“2.4”项下方法考察心肌细胞在DOX处理24、48、96 h后的心肌毒性,浓度-效应曲线见图 1,IC50值见表 1,经分析,加入DOX培养48 h的PC细胞呈现较好的抑制规律曲线,选择48 h为最佳受试总时长。
|
图 1 DOX作用于心肌细胞24、48和96 h的毒性浓度-效应曲线 (n= 5) Fig. 1 Representive concentration-response curves, illustr- ating the toxic effects of DOX on neonatal rat cardiomyocytes for 24, 48 and 96 h, respectively (n = 5) |
| 表 1 DOX作用于心肌细胞24、48和96 h的毒性影响 (n = 5) Table 1 The toxicity effects of DOX on neonatal rat cardiomy- ocytes for 24, 48 and 96 h, respectively (n = 5) |
3.2 受试浓度筛选结果
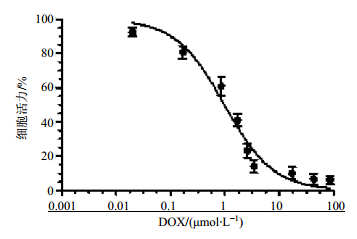
DOX作用48 h后的心肌毒性浓度-效应曲线见图 2,经软件计算,IC50(48 h)为(1.03±0.40)μmol/L。确定体外心肌毒性代谢组学试验的受试低浓度与高浓度分别为0.09和3.44 μmol/L。低浓度为抑制率约10%的浓度,高浓度为抑制率约75%时的浓度。
|
图 2 DOX处理48 h的心肌毒性浓度-效应曲线 (x±s, n = 4) Fig. 2 Representive concentration-response curves, illustr- ating the toxic effects of DOX on neonatal rat cardiomyocytes for 48 h. (x±s, n = 4) |
3.3 对心肌细胞形态学变化的影响
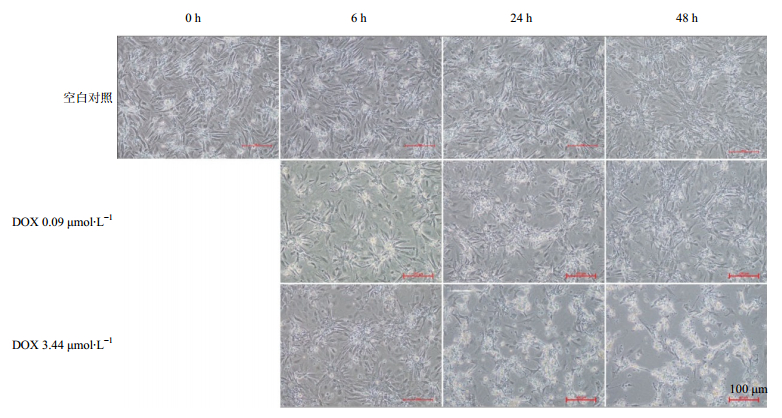
药物处理前(0 h),PC细胞连成一片,呈频率均一的同步化搏动。随着药物浓度的增加,药物处理时间的延长,PC细胞的搏动受到明显影响,细胞形态逐步改变,明显异常于同期空白对照组PC细胞。经高浓度DOX分别处理6、24和48 h后,PC细胞死亡数目逐级增多,大部分死亡细胞附着在活细胞上,形态发生明显改变,胞体由外向内固缩,伪足变得细长枯竭。经低浓度DOX分别处理6、24和48 h后,细胞数目少量减少,未出现高浓度暴露时的急剧细胞死亡增多现象。空白对照组细胞在给药同期随着培养时间增加,48 h组PC细胞表现出与0 h组较明显的形态学差异:细胞发生明显固缩,呈放射状星形聚集,伪足变细变长。结果见图 3。
|
图 3 不同浓度DOX作用不同时间的心肌细胞形态学变化特征 Fig. 3 The characteristic morphological change of the cardiomyocytes treated with different concentrations of DOX for various time points |
4 讨论
代谢组学是系统生物学中生物信息传递的“终端”,能够更灵敏、准确地反映出生物体系的状态及动态变化过程[7],已在毒理学研究、疾病诊断、新药研发及药物安全性评价等多个医药学领域展示了广阔的应用前景[8]。以往的代谢组学研究大多集中于人或动物的生物体液(血液、尿液等),对体外细胞模型的样品研究较少,也未建立统一的标准操作方法。然而体外细胞模型却是新药早期毒性筛选与评价的重要工具,特别是在心脏毒性仍为威胁新药研发获得成功的关键因素的今天[9-10],建立基于体外细胞模型的心脏毒性代谢组学研究方法显得十分必要。
PC细胞是心血管疾病及药物安全性试验等研究的重要体外实验模型。本研究将体外心肌细胞培养技术与代谢组学技术相结合,通过前期的摸索和反复试验已建立改良的原代心肌细胞培养方法,可快速、高效地获取存活率和纯度均高的PC细胞,为体外心肌毒性代谢组学研究提供了良好的物质基础。
DOX是临床治疗多种肿瘤的有效化疗药物,但因严重而明确的心脏毒性为目前较为认可的心脏毒性造模药物[11]。本研究选择DOX作为模型药物以构建符合代谢组学研究要求的体外心肌细胞毒性模型,造成不同药物浓度下的代谢信息差异,以便利用代谢组学研究方法对心脏毒性机制及其作用通路上的关键性生物标志物等进行深入研究并取得较为明确的结果。代谢组学重点关注的内容之一是内源性代谢物组的变化或其随时间的变化规律[12],实验设计中应该体现PC细胞中代谢物随时间点变化的规律。故本实验先对DOX处理24、48和96 h的PC细胞活力进行考察,结果发现加入DOX培养24 h的PC细胞可能由于药物暴露时间过短而未能造成充分的毒性现象,死亡或被抑制的细胞数量较少,不足以达到造成明显毒性差异的要求。而加入DOX培养96 h的心肌细胞一方面可能因PC细胞本身的活力周期较短致衰老、凋亡等(经反复实验表明,PC细胞在7 d内具有良好活力且适宜用于实验目的),另一方面因药物暴露时间过长,毒性呈现时间依赖性增加,导致大部分PC细胞死亡,不宜用于后续的代谢组学研究。只有加入DOX培养48 h的PC细胞呈现较好的抑制规律曲线,其IC50值低于DOX暴露24 h组约4.5倍,高于96 h组约1.6倍,表明药物处理48 h的时间内已能达到预期的毒性效果,而又不至于毒性过强而使细胞过量死亡。因此,选择DOX暴露48 h为代谢组学研究的总时长。在48 h内按照一定规律,逐一设定0、6、24和48 h为期间收集与测定样品的时间点,以探寻PC细胞内代谢物组随时间变化的规律。
本实验设计了低、高2个浓度,以满足代谢组学实验中内源性代谢物信息的差异构建、比较及其后续研究。选中的低浓度需满足对心肌细胞造成的影响与同期空白对照组相比存在较小或不明显的毒性和代谢信息差异,而高浓度则需满足对心肌细胞造成的影响与同期空白对照组和低浓度组相比均存在较大的显著性毒性与代谢信息差异,且不至于使细胞全部死亡。根据DOX对PC细胞毒性影响的MTS试验结果,结合实际的心肌细胞染毒后的形态学变化,并考虑维持心肌细胞最佳生长状态的培养周期(不超过7 d)等因素,综合确定用于代谢组学研究方法建立的模型药物DOX的受试低浓度为0.09 μmol/L,高浓度为3.44 μmol/L。比较“3.1”项中48 h的IC50值和“3.2”项中的IC50值发现,二者表面上存在一定差异,这是由于每次实验的结果不可能完全相同导致的,但经仔细比较可知,选用的低浓度均为二者中抑制率约10%的浓度,高浓度均为抑制率约75%时的浓度。因此,二者获得的IC50值的差异并不影响代谢组学方法建立的受试药物浓度的确定。
本实验考察了不同浓度多柔比星暴露不同时间的心肌细胞形态学变化情况,低、高浓度的DOX在不同的受试时间下可分别导致PC细胞出现与受试浓度和受试时长相符的毒性程度,表现为死亡细胞数量的变化及细胞形态学的变化(逐渐加重),因此可推测本研究所选择的低、高浓度DOX能成功造成细胞中内源性代谢物信息差异。值得注意的是,本研究特别设置了与各受试时间相对应的空白对照组,而不仅仅只有受试0 h的空白对照。这是因为随着培养时间的延长,培养环境中的营养物质逐渐消耗,可能导致PC细胞衰老,进而发生形态学变化。由图 3可见空白对照组培养48 h与培养0 h存在较明显的形态学差异:细胞呈放射状星形聚集性固缩,伪足变细变长。这样设计保证了受试细胞可与同期空白组细胞作比较,排除时间因素引起的误差。
综上,本研究在良好的PC细胞培养技术条件下,通过对选定的模型药物DOX的受试浓度和受试时间的考察,确定了适合体外心肌毒性代谢组学研究方法的低、高浓度与受试时间点,为进一步的体外心肌毒性代谢组学研究奠定基础,也为此类体外细胞模型的代谢组学研究提供借鉴。
| [1] | 黄寅, 许风国, 张伟, 等. 药物代谢组学研究进展[J]. 中国药科大学学报,2013,44 (2) :105–112. |
| [2] | Liu T, Li J, Xu F, et al. Comprehensive analysis of serum metabolites in gestational diabetes mellitus by UPLC/Q-TOF-MS[J]. Anal Bioanal Chem, 2016, 408 (4) :1125–1135. |
| [3] | Jiang T, Lin Y, Yin H, et al. Correlation analysis of urine metabolites and clinical staging in patients with ovarian cancer[J]. Int J Clin Exp Med, 2015, 8 (10) :18165–18171. |
| [4] | 李晓梅, 包馨慧, 杨毅宁, 等. 体外心肌细胞缺血后适应模型的建立及评价[J]. 新疆医科大学学报,2014,37 (1) :24–28. |
| [5] | 郭俊芳, 张赢予, 莫亚宏, 等. 多柔比星诱导体外培养心肌细胞损伤模型的建立[J]. 重庆医学,2009,38 (24) :3132–3134. |
| [6] | Fu J J, Gao J, Pi R B, et al. An Optimized Protocol for Culture of Cardiomyocyte from Neonatal Rat[J]. Cytotechnology, 2005, 49 (2) :109–116. |
| [7] | 林艳萍. 应用基于质谱技术的代谢组学研究肝损伤标志物[D]. 天津:天津大学, 2009. |
| [8] | 吕秋军. 新药研发中毒理学研究方法的进展-非临床安全性评价的新工具[J]. 中国新药杂志,2006,7 (15) :500–504. |
| [9] | Li X, Zhang R, Zhao B, et al. Cardiotoxicity screening:a review of rapid-throughput in vitro approaches[J]. Arch Toxicol, 2015 . |
| [10] | Scott C W, Zhang X, Abi-Gerges N, et al. An impedance-based cellular assay using human iPSCderived cardiomyocytes to quantify modulators of cardiac contractility[J]. Toxicol Sci, 2014, 142 (2) :331–338. |
| [11] | Pecoraro M, Sorrentino R, Franceschelli S, et al. Doxorubicin-mediated cardiotoxicity:role of mitochondrial connexin 43[J]. Cardiovasc Toxicol, 2015, 15 (4) :366–376. |
| [12] | Nicholson J K, Lindon J C, Holmes E. ‘Metabonomics’:understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29 (11) :1181–1189. |
 2016, Vol. 39
2016, Vol. 39


