2. 黑龙江八一农垦大学动物科学技术学院, 黑龙江 大庆 163319;
3. 黑龙江八一农垦大学食品科学技术学院, 黑龙江 大庆 163319
2. College of Animal Science & Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, China ;
3. College of food Science & Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, China
食道癌是发生在食管上皮组织的恶性肿瘤,占所有肿瘤的2%。我国是食道癌的高发国家,也是食道癌死亡率最高的国家,死亡患者仅次于胃癌居第二位,食道癌严重威胁着我国人民的健康和生命[1]。尽管目前有很多种抗癌药物,但由于毒副作用和抗药性等诸多问题,其效果还不太理想[2]。因此,寻找一种疗效好且毒副作用小的抗癌药物显得至关重要。黄芪,又名黄耆,是常用的中草药之一,主要由黄芪皂苷、黄酮类化合物、多糖、氨基酸和一些微量元素组成,具有抗炎、抗衰老、降血压、降血糖、保肝等作用[3-4]。研究报道,黄芪中的主要成分芒柄花素与黄芪甲苷IV还具有抗肿瘤效果[5-6],但是其对食道癌的药效及药理作用机制尚不清楚。本实验通过细胞生物学和分子生物学方法阐明芒柄花素与黄芪甲苷IV对人食道癌HCE-4细胞的杀伤作用,诱导细胞凋亡作用以及相关信号转导途径,为黄芪的有效利用以及治疗食道癌提供理论依据。
1 材料 1.1 细胞人食道癌HCE-4细胞系,购于中国科学院细胞研究所。
1.2 药物与试剂黄芪提取物,批号JZ140081105,主要成分为黄芪甲苷和黄芪多糖,质量分数分别为30%和70%;芒柄花素(批号JZ15072202,质量分数为98%)和黄芪甲苷IV(批号JZ15091604,质量分数为98%),均购自南京景竹生物科技有限公司。
MTT(美国Amresco公司);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司);p-AKT、AKT、pro-caspase-3、cleaved-caspase-3、β-actin等抗体(美国Santa Cruz公司);ECL化学发光试剂(美国Thermo公司),其他试剂均为国产分析纯。
1.3 主要仪器电泳仪及半干转印仪(美国Bio-rad公司);ELX酶标仪(美国伯腾仪器有限公司);倒置显微镜(德国Leica公司);FACSCalibvr型流式细胞仪(美国BD公司);MicroChemi 4.0型化学发光型凝胶成像系统(以色列DNR成像系统有限公司)。
2 方法 2.1 细胞培养人食道癌HCE-4细胞用含有10%胎牛血清(FBS)、100 U/mL青霉素、100 µg/mL链霉素的RPMI 1640培养液培养于37 ℃、5% CO2的培养箱中。细胞贴壁程度达到70%~80%时,进行传代培养。
2.2 MTT法检测细胞存活率将状态良好的HCE-4细胞以每孔1×104个的密度接种至96孔板,培养24 h。用含有1% FBS的培养液饥饿预处理2 h后,加入不同浓度的药物处理24 h,其中芒柄花素与黄芪甲苷IV的浓度为6.3、25、50、100、200 μmol/L,黄芪提取物的浓度为16、25、50、100、200 μmol/L(摩尔浓度以黄芪多糖计,黄芪多糖分子式为C10H7ClN2O2S,分子量为254.69),对照组加入等体积的DMSO。
每孔加入15 µL的MTT溶液(5 mg/mL),在培养箱中避光孵育2~4 h后,磷酸缓冲液(PBS)洗涤1~3次(避免洗去甲瓒)。每孔加入100 μL的DMSO,在摇床上混匀10 min,酶标仪检测590 nm处吸光度(A)值,计算细胞存活率和IC50值。设空白调零组,不接种细胞,加入100 μL的DMSO。每个实验组设定8个复孔,实验重复3次。
| $ 细胞存活率= \left( {实验组{\text{A}}值 - 空白凋零组{\text{A}}值} \right)/\left( {对照组{\text{A}}值 - 空白凋零组{\text{A}}值} \right) $ |
将HCE-4细胞接种至6孔板(每孔1.2×105个),培养过夜。分别用100 μmol/L的芒柄花素、黄芪甲苷IV及阳性药黄芪提取物处理细胞不同时间(0、3、6、12、24 h)。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书进行染色,通过荧光显微镜观察并分析细胞凋亡情况。
2.4 Western blotting法检测凋亡相关蛋白表达变化将HCE-4细胞接种至6孔板(每孔1.2×105个),用终浓度为100 μmol/L的黄芪甲苷IV、芒柄花素及阳性药黄芪提取物处理细胞0、3、6、12、24 h,裂解细胞,提取蛋白,SDS-PAGE分离,转膜,5%脱脂牛奶封闭,一抗封闭过夜,二抗室温孵育2 h,化学发光凝胶成像系统检测,Image J 1.42软件对条带进行灰度分析,实验重复3次。
2.5 统计学方法实验数据以$\bar x \pm s$表示,采用SPSS 11.0软件包分析,各处理组间比较采用t检验。
3 结果 3.1 对人食道癌HCE-4细胞的生长抑制作用芒柄花素与黄芪甲苷IV对人食道癌HCE-4细胞生长具有明显的抑制作用,且呈剂量相关性,IC50分别为91.2、55.0 μmol/L。芒柄花素与黄芪甲苷IV对HCE-4细胞的生长抑制作用明显高于对照药黄芪提取物,差异显著(P<0.01),其中黄芪甲苷IV的抑制作用最为明显。结果见图 1。
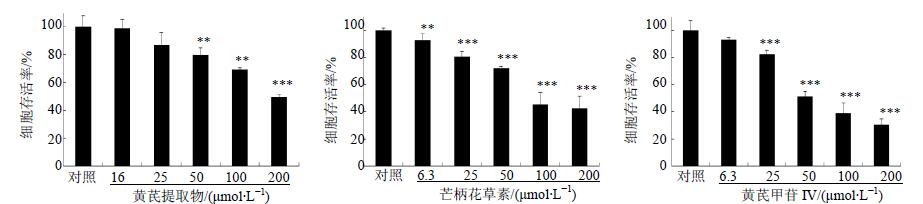
|
图 1 黄芪提取物、芒柄花素及黄芪甲苷IV对HCE-4细胞存活率的影响($\bar x \pm s$,n=3) Fig. 1 Cytotoxic activity of Astragalus root extract, formononetin, and astragaloside IV against HCE-4 cells($\bar x \pm s$,n=3) |
3.2 对人食道癌HCE-4细胞的凋亡作用
对照组细胞生长贴壁较牢固,细胞间紧密相连,细胞边界清晰,细胞膜完整。随着芒柄花素与黄芪甲苷IV处理时间的增加,细胞形态发生明显变化,体积变小,形态逐渐变圆、不规则,细胞间接触松散,表现出细胞凋亡的典型特征。Annexin V-FITC和PI的荧光强度也随着药物处理时间的增加而逐渐增加,说明芒柄花素与黄芪甲苷IV对HCE-4细胞具有良好的诱导凋亡作用,并呈时间相关性,其中黄芪甲苷IV的作用最为明显。结果见图 2、3。
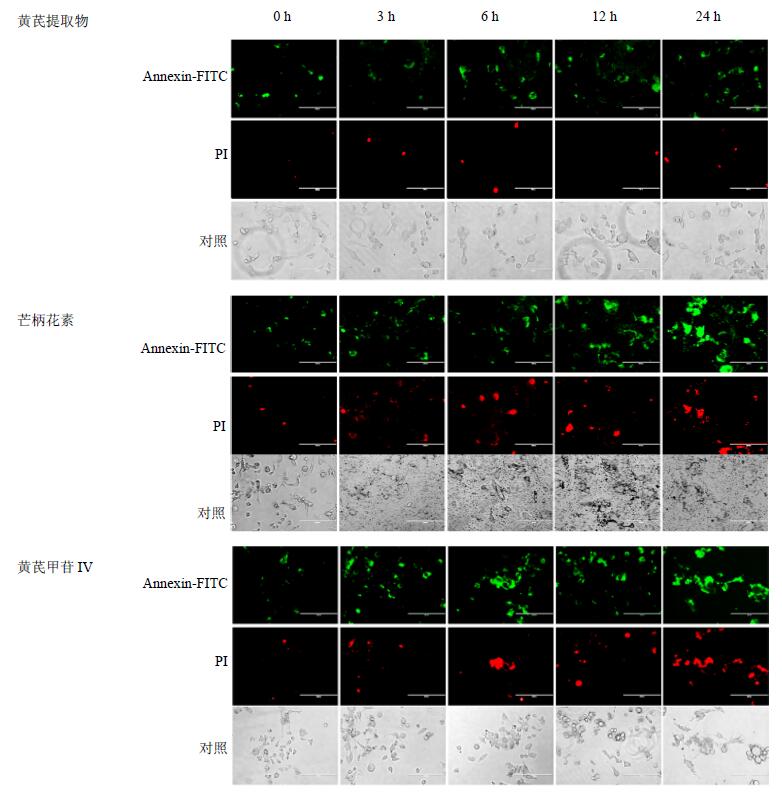
|
图 2 Annexin V-FITC/PI双染检测黄芪有效成分对HCE-4细胞的诱导凋亡作用($\bar x \pm s$,n=3) Fig. 2 Induction on apoptosis of HCE-4 cells by active components from A. membranaceus using Annexin V-FITC/PI double staining($\bar x \pm s$,n=3) |
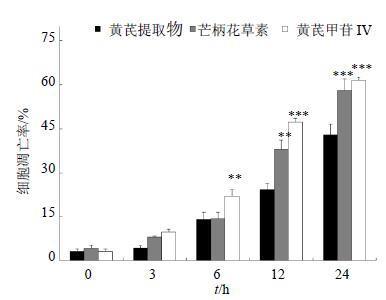
|
图 3 Annexin V-FITC/PI双染定量分析检测黄芪有效成分对HCE-4细胞的诱导凋亡作用($\bar x \pm s$,n=3) Fig. 3 Induction on apoptosis of HCE-4 cells by active components from A. membranaceus using quantify- cation of Annexin V-FITC/PI double staining fluorescence intensity($\bar x \pm s$,n=3) |
3.3 对AKT信号通路相关蛋白表达的影响
随着芒柄花素与黄芪甲苷IV处理时间的增加,抗凋亡因子p-AKT蛋白表达量逐渐降低,促凋亡因子cleaved-caspase-3蛋白表达量逐渐增加。与黄芪提取物组比较,差异显著(P<0.05),结果见图 4。
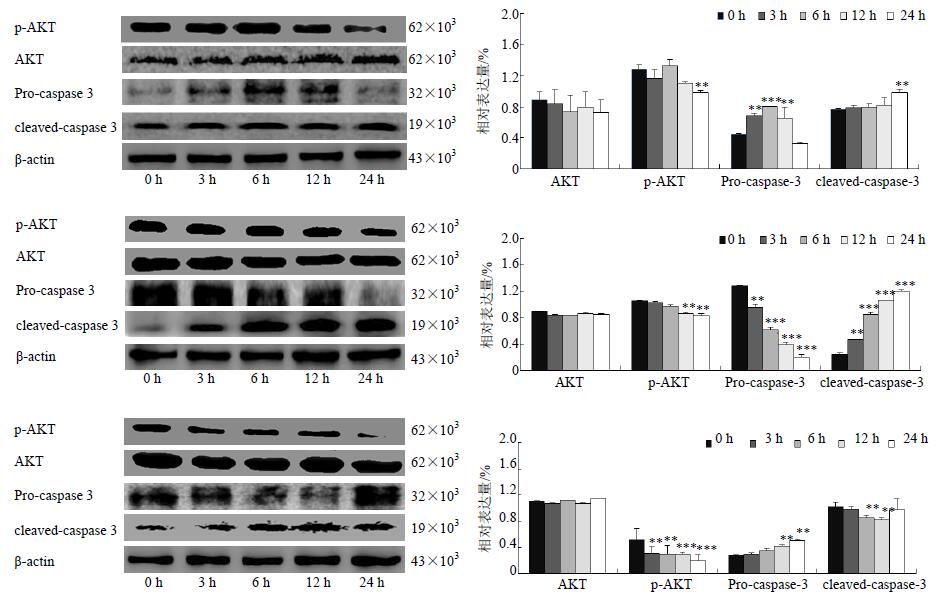
|
图 4 黄芪有效成分黄芪提取物(A)、芒柄花素(B)及黄芪甲苷IV(C)对细胞凋亡相关蛋白表达的影响($\bar x \pm s$,n=3) Fig. 4 Effects of active components from A. membranaceus such as Astragalus root extract (A), formononetin (B), and astragaloside IV (C) against apoptosis related protein expression levels($\bar x \pm s$,n=3) |
4 讨论
食道癌是一种多因素、多阶段、多基因变异积累及相互作用的恶性肿瘤,在分子水平上涉及众多原癌基因、抑癌基因以及蛋白质的改变。黄芪是具有多种功效的我国优良中药材之一,但针对黄芪有效成分的药理研究并不多。本研究结果显示,黄芪有效成分芒柄花素与黄芪甲苷IV对人食道癌HCE-4细胞具有良好的杀伤作用,其中黄芪甲苷IV的杀伤效果尤为突出。有研究报道,肿瘤的发生主要是由于细胞的无限增殖和细胞凋亡受到抑制而引起的[7]。本实验中Annexin V-FITC/PI双染检测结果表明,芒柄花素与黄芪甲苷IV均可诱导HCE-4细胞凋亡,且黄芪甲苷Ⅳ的诱导凋亡效果更显著。肿瘤细胞的凋亡过程是由多种凋亡相关蛋白参与的。如AKT、Caspase家族在凋亡相关的信号通路中起非常重要的作用[8-9]。有研究报道,芒柄花素和黄芪甲苷IV可通过AKT信号通路调节caspase-3的活性进一步诱导一些癌细胞发生凋亡[10-12]。本实验中Western blotting结果表明,芒柄花素与黄芪甲苷IV可下调抗凋亡因子p-AKT蛋白表达,上调促凋亡因子cleaved-caspase-3蛋白表达,进而诱导HCE-4细胞的凋亡,验证了黄芪有效成分是通过调控AKT介导的线粒体凋亡信号转导途径调控细胞凋亡的。
目前,对于黄芪的有效成分、药理作用及其制剂的临床应用方面的研究还尚未完善,今后应对黄芪的有效成分,尤其是单体成分进行深入的研究,进一步使黄芪发挥出更高的药用价值和经济价值。
| [1] | Jemal A, Bray F, Center M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2) :69–90. |
| [2] | 白海鹏, 孙维敏, 康娜. 食道癌及其治疗的研究进展[J]. 包头医学院学报,2014,30 (3) :134–136. |
| [3] | 陈虎虎, 龚苏晓, 王思路, 等. 黄芪茎、叶的化学成分和药理作用研究进展[J]. 药物评价研究,2011,34 (2) :134–137. |
| [4] | 杨珍, 周惠芬, 周鹏, 等. 川芎、黄芪有效成分配伍对缺氧脑微血管内皮细胞的影响[J]. 中草药,2015,46 (9) :1326–1332. |
| [5] | 张幸, 梁梅花, 黄文君, 等. 芒柄花黄素诱导膀胱癌细胞凋亡作用[J]. 中国公共卫生,2015,31 (3) :314–317. |
| [6] | Wang P P, Xu D J, Huang C. Astragaloside IV reduces the expression level of P-glycoprotein in multidrug-resistant human hepatic cancer cell lines[J]. Mol Med Rep, 2014, 9 (6) :2131–2137. |
| [7] | 李娜, 高俊岩, 刘敏. 细胞凋亡和肿瘤的关系研究进展[J]. 当代医学,2009,15 (16) :13–14. |
| [8] | 黄秀兰, 崔国辉, 周克元. PI3K-AKT信号通路与肿瘤细胞凋亡关系的研究进展[J]. 癌症,2008,27 (3) :331–336. |
| [9] | Hensley P, Mishra M, Kyprianou N. Targeting caspases in cancer therapeutics[J]. Biol Chem, 2013, 394 (7) :831–843. |
| [10] | 邓樱, 陈红风. 黄芪注射液及其有效成分对乳腺癌细胞增殖和Akt磷酸化的影响[J]. 中西医结合学报,2009,7 (12) :1174–1180. |
| [11] | Zhang X, Bi L, Ye Y, et al. Formononetin induces apoptosis in PC-3 prostate cancer cells through enhancing the Bax/Bcl-2 ratios and regulating the p38/Akt pathway[J]. Nutr Cancer, 2015, 66 (4) :656–661. |
| [12] | Li T, Zhao X, Mo Z, et al. Formononetin promotes cell cycle arrest via down regulation of Akt/Cyclin D1/CDK4 in human prostate cancer cells[J]. Cell Physiol Biochem, 2015, 34 (4) :1351–1358. |
 2016, Vol. 39
2016, Vol. 39


