2. 黑龙江八一农垦大学 动物科学技术学院, 黑龙江 大庆 163319;
3. 黑龙江八一农垦大学 食品科学技术学院, 黑龙江 大庆 163319
2. College of Animal Science & Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, China ;
3. College of food Science & Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, China
肝癌是世界上最常见且恶性程度最高的肿瘤之一,全球每年新增和死亡肝癌病例50%以上都发生在我国,严重威胁着人们的健康及生命[1-2]。大黄素是从大黄的根茎中提取出的一种天然的蒽醌类化合物,是ATP竞争性CK2抑制剂[3],具有抗炎、镇痛、泻下以及抗癌等作用[4-6]。有研究报道,大黄素能够抑制胆囊癌、胃癌、卵巢癌、胰腺癌细胞增殖,并且能够有效诱导细胞凋亡[7-12],但其对肝癌的药效及药理机制尚不清楚。本实验利用MTT、Annexin V-FITC/PI双染、流式细胞术、Western blotting等方法阐明大黄素对人肝癌Huh7细胞的杀伤作用、诱导凋亡作用及其相关信号传导途径。
1 材料 1.1 细胞人肝癌Huh7细胞,中国科学院细胞研究所。
1.2 药物及主要试剂大黄素(美国Sigma公司,批号E7881);5-氟尿嘧啶(5-FU,上海皓元化学科技有限公司,批号HY-90006);DMEM高糖培养基、青/链霉素、0.25%胰蛋白酶(美国Hyclone公司);胎牛血清(FBS,美国Gibco公司);MTT(美国Amresco公司);DMSO(美国Sigma公司);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司);β-actin、Bcl-2、AKT、p-AKT、cleaved caspase-3、pro-caspases-9抗体、HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG(美国Santa Cruz公司);ECL化学发光试剂(美国Thermo公司)。
1.3 主要仪器390302型倒置显微镜,Leica公司;ELX酶标仪,美国伯腾仪器有限公司;Bio-rad电泳仪、半干转印仪,美国伯乐公司;MicroChemi4.0型化学发光型凝胶成像系统,以色列DNR成像系统有限公司;EVOS FL型全自动智能成像系统,Life Technology公司;FACSCalibvr型流式细胞仪,美国BD公司。
2 方法 2.1 细胞培养肝癌Huh7细胞培养于含有10% FBS、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基中,在5% CO2、37 ℃、饱和湿度的培养箱中培养。每隔2天换培养液,当细胞满度达到70%~80%时进行传代。
2.2 MTT法检测细胞存活率将Huh7细胞以1×104/孔的密度接种至96孔板,5% CO2、37 ℃培养箱里孵育24 h。用含有1% FBS的培养液饥饿2 h,大黄素组加入终浓度为1、3、10、30、100 μmol/L的大黄素;5-FU组加入1 μL 5-FU,浓度与大黄素相同;对照组加入等量DMSO。处理24 h后每孔加入15 μL的MTT溶液(5 g/L),继续培养2~4 h后,磷酸缓冲液(PBS)洗涤3次,每孔加入100 μL DMSO,在摇床上混匀15 min,酶标仪检测570 nm处吸光度(A)值,计算细胞存活率。设空白调零组,不接种细胞,最后只加入100 μL的DMSO;每个实验组设定8个复孔,实验重复3次。
| $ 细胞存活率 = \left( {{A_{大黄素}} - {A_{空白}}} \right)/\left( {{A_{对照}} - {A_{空白}}} \right) $ |
将Huh7细胞以1×105/孔的密度接种至6孔板,第2天细胞数达到70%~80%时,30 μmol/L大黄素分别处理细胞0、3、6、12及24 h,通过倒置显微镜观察细胞形态变化。应用Annexin V-FITC/PI细胞凋亡检测试剂盒进行凋亡细胞染色,通过荧光显微镜观察并分析凋亡情况。
2.4 流式细胞术检测细胞凋亡率将Huh7细胞以1×105/孔的密度接种至6孔板,培养过夜。30 μmol/L大黄素处理细胞0、3、6、24 h,消化离心收集细胞。197 μL Annexin V-FITC结合液重悬细胞,同时加入3 μL Annexin V-FITC,室温避光孵育20 min。300 μL PBS重悬细胞,流式细胞仪检测细胞凋亡情况。
2.5 Western blotting检测凋亡相关蛋白表达将Huh7细胞以1×105/孔的密度接种至6孔板,30 μmol/L大黄素处理细胞0、3、6、12、24 h后将细胞回收至离心管内,应用含PMSF的裂解液在冰上裂解细胞30 min,4 ℃、12 000 r/min离心30 min后去沉淀。测定蛋白质浓度,进行SDS-PAGE电泳分离蛋白质。半干转至硝酸纤维膜上,5%脱脂牛奶封闭1 h,加入1:1 000稀释的一抗(p-AKT、AKT、Bcl-2、cleaved caspase-3),4 ℃缓慢摇动过夜。TBST洗膜,加入辣根过氧化物酶标记的二抗(山羊抗鼠、山羊抗兔),室温摇床上孵育1 h。TBST洗膜,ECL化学发光试剂显色,应用化学发光型凝胶成像系统呈像。用Image J图像分析软件对条带进行分析,内参采用β-actin。
2.6 统计学分析数据均以$\bar x \pm s$表示,采用SPSS 11.0软件进行统计学分析,各组间比较采用t检验。
3 结果 3.1 对肝癌Huh7细胞存活率的影响随着大黄素浓度的升高,细胞存活率明显降低并呈现剂量依赖性,其存活率分别为(98.10±12.43)%、(87.31±7.85)%、(53.68±3.88)%、(35.88±3.69)%及(27.48±2.93)%。与阳性药5-FU比较,大黄素的杀伤效果更好。经计算,大黄素的IC50为11.55 μmol/L。结果见图 1。

|
图 1 大黄素对Huh7细胞的杀伤作用($\bar x \pm s$,n=3) Fig. 1 Cytotoxic effect of emodin on Huh7 cells($\bar x \pm s$,n=3) |
3.2 肝癌Huh7细胞形态学变化
30 μmol/L大黄素处理细胞0、3、6、12、24 h,倒置显微镜观察发现,随着时间的增加,细胞形态发生明显变化,当药物处理24 h时,细胞明显固缩和凝聚,大量细胞脱离培养皿底部。这些变化与细胞发生凋亡和死亡的特征极其相似,说明大黄素可能具有诱导细胞凋亡的作用。结果见图 2。

|
图 2 大黄素对Huh7细胞形态学变化的影响 Fig. 2 Effect of emodin on morphological changes of Huh7 cells |
3.3 Annexin V-FITC/PI双染法检测Huh7细胞凋亡
随着药物处理时间的不断增加,Annexin V-FITC和PI的荧光强度逐渐增强,其细胞凋亡程度也显著增加。与对照组比较均差异显著(P<0.001)。结果见图 3。

|
图 3 Annexin V-FITC/PI双染法检测大黄素对Huh7细胞的凋亡作用($\bar x \pm s$,n=3) Fig. 3 Apoptotic effect of emodin on Huh7 cells by Annexin V-FITC/PI staining($\bar x \pm s$,n=3) |
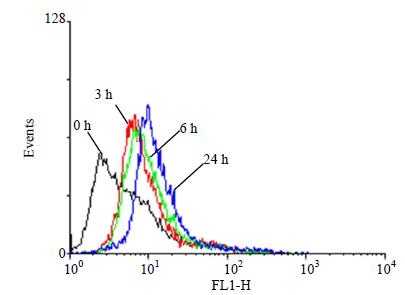
3.4 流式细胞术检测Huh7细胞的凋亡
随着药物处理的时间不断增加,细胞凋亡峰不断右移,当药物处理时间达到24 h时,细胞凋亡峰右移程度十分显著。结果表明,大黄素可以有效诱导Huh7细胞的凋亡,并呈时间相关性。结果见图 4。
|
图 4 流式细胞术检测大黄素对Huh7细胞的凋亡作用 Fig. 4 Apoptotic effect of emodin on Huh7 cells by flow cytometry |
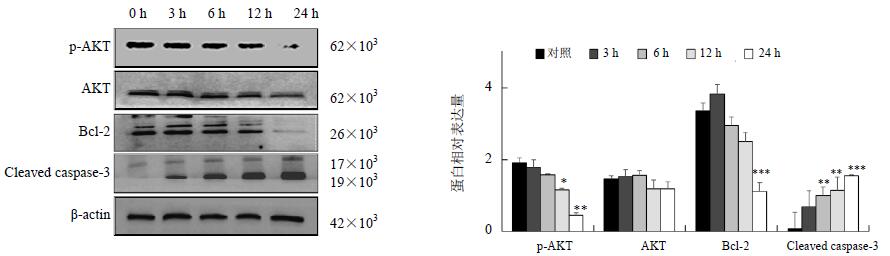
3.5 对细胞凋亡相关蛋白表达量的影响
随着药物处理的时间不断增加,抑制凋亡作用的p-AKT、Bcl-2蛋白表达量逐渐减少,而促进细胞凋亡作用的cleaved caspase-3的蛋白质表达量逐渐增加,说明大黄素通过AKT信号途径诱导细胞凋亡,进而对Huh7细胞发挥良好的杀伤作用。结果见图 5。
|
图 5 Western blotting检测大黄素对细胞凋亡相关蛋白表达的影响($\bar x \pm s$,n=3) Fig. 5 Changes of expression levels of apoptosis related proteins on Huh7 cells by Western blotting($\bar x \pm s$,n=3) |
4 讨论
治疗肝癌困难的主要原因是癌细胞本身的增殖能力和抗凋亡能力都比正常细胞强,这就促使本课题组寻找一种更好的抑制肝癌细胞增殖和促进癌细胞凋亡的药物。本研究从细胞凋亡入手,探究大黄素对肝癌Huh7细胞的作用机制。
结果显示,大黄素在体外对肝癌Huh7细胞的增殖具有明显的抑制作用,并且随着药物浓度的增加和处理时间的延长,抑制作用愈明显,揭示大黄素对Huh7细胞的抑制呈时间和剂量依赖性。
本实验Annexin V/PI双染和流式细胞术检测结果显示,30 μmol/L的大黄素处理细胞不同时间后,随时间的延长荧光强度逐渐增强,凋亡峰逐渐后移,说明凋亡作用越来越明显。
PI3K/AKT信号转导通路是研究最为广泛的信号通路之一,在癌细胞的生长、分化、凋亡等过程中起非常重要的作用。PI3K激活的结果是在质膜上产生PIP3,PIP3与细胞内含有PH结构域的信号蛋白Akt和磷酸化依赖性蛋白1(PDK1)结合,促使PDK1磷酸化Akt蛋白的Ser 308导致Akt的活化。Akt还能通过PDK2对其Thr 473的磷酸化而被激活。活化的Akt激活或抑制其下游靶蛋白Bad、Caspase 9及NF-κB等,进而调节细胞的增殖、分化、以及凋亡等[13]。有研究表明,大黄素负向调节PDK/AKT信号通路,可下调AKT活性,但并不直接影响AKT激酶[14, 15]。Western blotting实验结果显示,大黄素处理Huh7细胞后p-AKT蛋白表达量下降,而且表达水平随着时间的增加而递减,磷酸化的AKT继而调控Bcl-2、cleavedcaspase-3等下游蛋白,促进肝癌Huh7细胞的凋亡,这与之前PI3K/AKT信号途径研究的结果相似。
综上所述,大黄素通过调控AKT信号途径诱导肝癌Huh7细胞的凋亡,从而有效抑制肝癌Huh7细胞的增殖,这为肝癌以及其它癌症的治疗提供理论依据。
| [1] | 於雷, 周俭. 肝癌的诊治进展[J]. 现代实用医学,2013,25 (10) :1081–1082. |
| [2] | 魏矿荣, 彭侠彪, 梁智恒, 等. 全球肝癌流行概况[J]. 中国肿瘤,2015,24 (8) :621–630. |
| [3] | Duncan J S, Litchfield D W. Too much of a good thing:the role of protein kinase CK2 in tumorigenesis and prospects for therapeutic inhibition of CK2[J]. Biochim Biophys Acta, 2008, 1784 (l) :33–47. |
| [4] | 徐立强, 罗汝斌, 于立杰. 大黄对急性胆囊炎患者全身炎症反应的调节作用[J]. 江西中医药,2010,6 (41) :36–37. |
| [5] | 黄伟峰. 大黄素的药理作用研究进展[J]. 柳州医学,2013,26 (4) :241–244. |
| [6] | 刘晗, 高云. 大黄素药理作用的分子机制研究[J]. 中国药理学通报,2009,25 (12) :1552–1555. |
| [7] | 关翠雯, 金晶, 朱少华, 等. 大黄素诱导人肾上皮HK-2细胞凋亡及内质网应激的介导作用[J]. 中草药,2013,44 (12) :1621–1627. |
| [8] | 马云涛, 田宏伟, 王芳. 大黄素对人胃癌细胞MKN45增殖抑制作用及其分子机制的探讨[J]. 中华肿瘤防治杂志,2011,18 (12) :3–9. |
| [9] | Li J, Liu P, Mao H, et al. Emodin sensitizes paclitaxel resistant human ovarian cancer cells to paclitaxel induced apoptosis in vitro[J]. Oncol Rep, 2009, 21 (6) :1605–1610. |
| [10] | 刘岸, 邓姿峰, 胡金喜, 等. 大黄素对人胰腺癌Panc-1细胞增殖和凋亡的影响[J]. 中草药,2011,42 (4) :756–759. |
| [11] | 王春光, 刘北忠, 金丹婷, 等. 大黄素对裸鼠体内K562细胞移植瘤的抑制作用及其与调控Caspase-3和Caspase-9表达的关系[J]. 中草药,2010,41 (5) :751–756. |
| [12] | 保永亮, 龚晓燕, 黄金玲, 等. 大黄素对人胃癌MNK-45和MGC8-03细胞增殖的影响[J]. 药物评价研究,2012,35 (6) :408–411. |
| [13] | Morgan T M, Koreckij T D, Corey E. Targeted therapy for advanced prostate cancer:inhibition of the PI3K/Akt/mTOR pathway[J]. Curr Cancer Drug Targets, 2009, 9 (2) :237–249. |
| [14] | Olsen B B, Bjørling-Poulsen M, Guerra B. Emodin negatively affects the phosphoinositide 3-kinase/AKT signaling pathway:a study on its mechanism of action[J]. Int J Biochem Cell Biol, 2007, 39 (1) :227–237. |
| [15] | 何庆良, 周俊峰, 潘敦, 等. 大黄素对胆管癌QBC939细胞生长及磷酸肌醇3激酶/蛋白激酶B/雷帕霉素靶蛋白信号通路表达的影响[J]. 中华实验外科杂志,2013,30 (8) :42. |
 2016, Vol. 39
2016, Vol. 39


