2. 上海中医药大学附属龙华医院乳腺科, 上海 200032
2. Department of Breast Surgery, Longhua Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai, 200032, China
乳腺癌的诊治已进入分类治疗时代,不同基因表型或分子亚型的乳腺癌患者,其诊治及预后存在很多差异[1]。中医药在乳腺癌综合治疗,尤其是防治术后复发转移方面的作用,日益受到广大学者和患者的重视。本课题组针对扶正类中药对乳腺癌细胞增殖的影响开展了一系列的研究[2-3],前期研究结果表明,黄芪及其提取物能够抑制乳腺癌细胞增殖[4-6],其有效组分芒柄花素可以将乳腺癌细胞阻滞于G1期[7],然而,其具体的分子机制尚不明确。为此,本实验采用实时定量PCR和Western blotting技术,从基因和蛋白水平研究芒柄花素对不同亚型乳腺癌细胞周期阻滞的分子机制,进一步为临床应用芒柄花素防治乳腺癌提供理论依据。
1 材料 1.1 细胞人乳腺癌细胞株MCF-7、SK-BR-3、MDA-MB-231,均购自中国科学院上海细胞库。
1.2 药品及主要试剂芒柄花素(中国食品药品检定研究院,批号111703-200602,质量分数≥98%);二甲基亚砜(DMSO,美国Sigma公司);McCoy’s 5A、EMEM及L-15液体培养基、胎牛血清(FBS)、胰酶、磷酸盐缓冲液(PBS)(美国Gibco公司);逆转录试剂盒、实时定量PCR试剂盒(日本TaKaRa公司);Cyclin D1、Cyclin E、p21、p27抗体(英国Abcam公司);BCA试剂盒(美国Thermo公司)。
1.3 主要仪器3111细胞培养箱,Thermo Fisher Scientific公司;TH4-200倒置相差显微镜,OLYMPUS公司;Mastercycler personal 5332逆转录PCR仪,Eppendorf公司;RG-3000A real-time PCR仪,Rcorbett公司;Multiskan Mk 3酶标仪,Thermo Labsystems公司;1653311 Western blotting制胶装置,041BR66661垂直电泳仪、电转仪,美国BIO-RAD公司;LICOR ODYSSEY CLx Odyssey 双色红外激光成像系统,美国LICOR公司。
2 方法 2.1 细胞培养MCF-7细胞采用含0.01 mg/mL胰岛素和10% FBS的EMEM培养基置于37 ℃、95%空气、5% CO2的无菌培养箱中培养,每2天换液1次;待细胞生长至80%~90%时,采用0.25%胰酶消化,按1:3比例传代。
SK-BR-3细胞采用含10% FBS的McCoy’s 5A培养基置于37 ℃、95%空气、5% CO2的无菌培养箱中培养,每2天换液1次;待细胞生长至80%~90%时,采用0.25%胰酶消化,按1:2比例传代。
MDA-MB-231细胞采用含10% FBS的L-15培养基置于37 ℃、无CO2的无菌培养箱中培养,换液及传代方法同MCF-7细胞。
2.2 实时定量PCR3种乳腺癌细胞MCF-7、SK-BR-3、MDA- MB-231,按2×104/mL、每瓶5 mL的细胞密度,接种于25 mL培养瓶中。培养48 h后,每种细胞各分为3组:芒柄花素0、40、80 μmol/L[8]组,0 μmol/L组加入2 μL DMSO。
经药物作用48 h后[8],PBS清洗2遍,加入1 mL Trizol裂解细胞,将裂解液转移至1.5 mL EP管中。常规提取RNA,经紫外分光光度计测定纯度和浓度,逆转录成cDNA,随后进行实时荧光定量PCR检测Cyclin D1、Cyclin E、P21及P27的基因表达情况,GAPDH作为内参。
采用ΔCt法进行统计分析(Ct为循环阈值),2−ΔΔCt表示各组间各基因的表达差异。根据GenBank检索目的基因序列设计引物,采用primer 5软件设计扩增引物序列,由华大基因公司合成引物序列。各基因名称和序列见表 1。
| 表 1 表 1引物序列及产物长度 Table 1 Primer sequences and product length |
2.3 Western blotting检测细胞周期相关蛋白的表达情况
细胞培养及分组给药同“2.2”项,经药物作用48 h后,去除培养液,PBS清洗2遍,加入500 μL RIPA裂解液裂解细胞,常规提取细胞总蛋白,随后采用BCA试剂盒测定蛋白浓度,并应用Western blotting技术检测Cyclin D1、Cyclin E、P21、P27 及GAPDH的蛋白表达情况。GAPDH作为内参。采用Image-Pro Plus 6.0软件进行灰度值分析。
2.4 统计学方法数据均以$\bar x \pm s$表示,采用SPSS 16.0软件进行统计学分析。对各组数值变量进行正态性分析,不符合正态分布的数据采用非参数检验;符合正态分布的数据,进一步检验方差齐性。方差齐时,多组数据间的比较采用单因素方差分析LSD-t法检验;方差不齐时,两组间数据比较采用非参数检验,多组数据间的比较采用单因素方差分析Dunnett's T3法检验。
3 结果 3.1 对细胞周期G1期相关基因的影响cyclin D1和cyclin E的表达水平随着芒柄花素浓度的增加而降低,与对照组比较,差异显著(P<0.05、0.01);P21和P27的表达水平随着芒柄花素浓度的增加而升高,与对照组比较,差异显著(P<0.05、0.01)。结果见图 1。
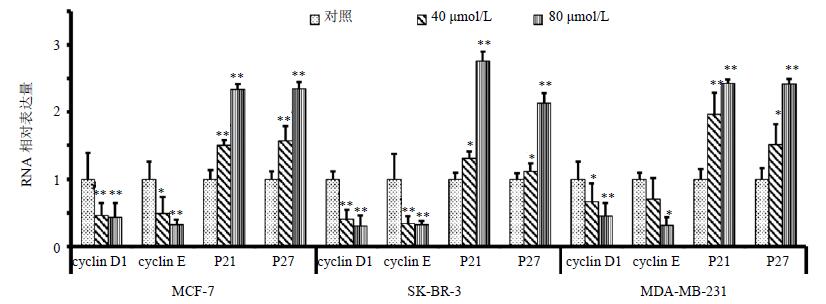
|
图 1 cyclin D1、cyclin E、p21和p27的基因表达情况($\bar x \pm s$,n=3) Fig. 1 Gene expression of cyclin D1, cyclin E, p21, and p27($\bar x \pm s$,n=3) |
3.2 对细胞周期G1期相关蛋白表达的影响
cyclin D1和cyclin E的蛋白表达随着芒柄花素浓度的增加而降低,p21和p27的蛋白表达随着芒柄花素浓度的增加而升高,与对照组比较,差异显著(P<0.05、0.01)。结果见图 2。
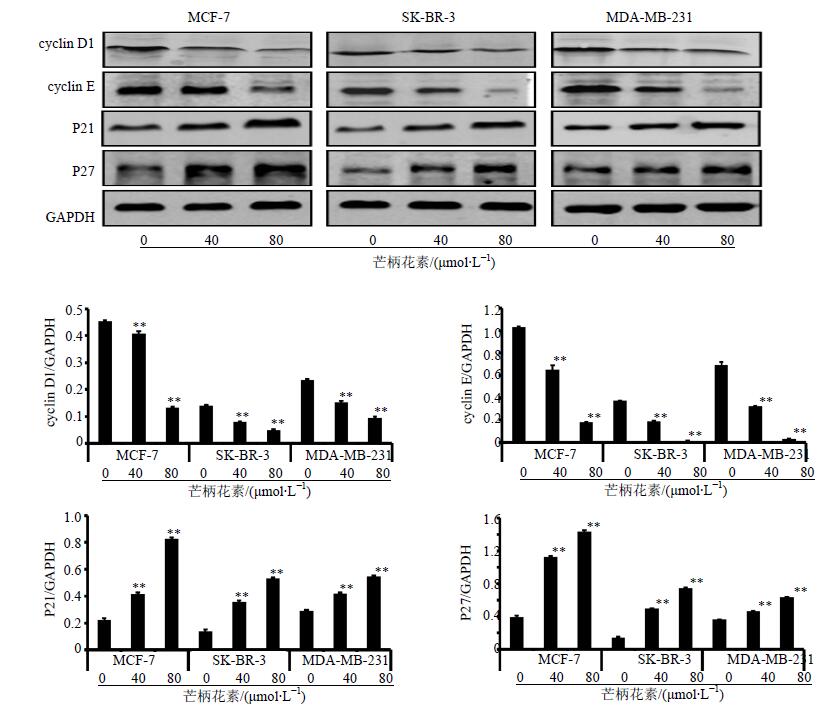
|
图 2 cyclin D1、cyclin E、p21和p27的蛋白表达情况($\bar x \pm s$,n=3) Fig. 2 Protein expression of cyclin D1, cyclin E, p21, and p27($\bar x \pm s$,n=3) |
4 讨论
芒柄花素是黄芪的有效组分之一,具有多种抗癌作用。①诱导肿瘤细胞凋亡,通过上调凋亡基因或蛋白的表达,从而诱导乳腺癌细胞[9-10]、骨肉瘤细胞[11-12]、前列腺癌细胞[13-16]、肺癌细胞[17]发生凋亡;②调控肿瘤细胞周期,通过PI3K/AKT信号通路调控宫颈癌HeLa细胞的有丝分裂[18];还可通过IGF1/PI3K/Akt信号通路调控乳腺癌细胞周期[19],通过Akt/Cyclin D1/CDK4信号通路将前列腺癌细胞阻滞于G0/G1期[20];③抑制肿瘤细胞迁移,可通过PI3K/AKT/MMPs信号通路调控乳腺癌细胞的迁移能力[8]。本课题组的前期实验结果表明,芒柄花素对3种乳腺癌细胞各用药组均出现G1期细胞比例增多。由此证明,芒柄花素可以通过阻滞细胞周期于G1期来达到抑制细胞增殖目的。
乳腺癌的发生、发展与细胞周期调控因子的异常表达密切相关。细胞周期的正常运行依赖于正、负调节因子的共同参与。正调节因子包括细胞周期蛋白(cyclin)和细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK);负调节因子主要是细胞周期蛋白依赖性激酶抑制剂(cyclin dependent kinase inhibitor,CKI)。以上3种调控因子在维持细胞有序的增殖、分裂活动中起重要作用,3者相互作用,共同参与细胞周期调控。细胞周期分为分裂间期和分裂期,其中分裂期又可分为:DNA合成前期(G1期)、DNA合成期(S期)和DNA合成后期(G2期)。有丝分裂期(M期)可分为前、中、后、末4期。在一个完整的细胞周期运行过程中,存在有3个检测点(check point),分别为G1/S检测点、G2/M检测点和纺锤体组装检测点。由于细胞一旦通过G1/S检测点,其可不再依赖外源性信号的刺激就能自主完成细胞周期,所以G1/S检测点被认为是最为重要的细胞限制点[21]。细胞恶性化的核心事件—细胞周期进程破坏也常发生于G1期。而在细胞G1/S转换中起重要作用的调节因子有Cyclin D1、Cyclin E、p21及p27。细胞受到生长因子的刺激,通过活化细胞膜上的酪氨酸激酶受体(receptor tyrosine kinases,RTKs),进一步经Ras/MEK/ERK或PI3K/Akt等多条信号通路将增殖信号传至细胞内部,促使细胞表达cyclin D,从而活化CDK4/6,使pRb蛋白磷酸化[22]。磷酸化后的Rb与转录因子E2F分离,促使细胞表达cyclin E并与CDK2结合,使得细胞进入S期,开始进行DNA复制。p27与p21属于CKI,共同抑制cyclin/CDK形成的异二聚体结构[23],使细胞停滞于G1期,从而实现对细胞周期调控功能[24]。
本实验结果显示,芒柄花素可减少乳腺癌细胞G1/S期正调控因子cyclin D1和cyclin E的基因和蛋白表达;并可促进负调控因子p21和p27的基因和蛋白表达。这可能是芒柄花素调控细胞周期,将乳腺癌细胞阻滞于G1期的分子机制。
| [1] | Goldhirsch A, Wood W C, Coates A S, et al. Strategies for subtypes-dealing with the diversity of breast cancer:highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22 (8) :1736–1747. |
| [2] | 周瑞娟, 陈红风. "扶正固本"防治乳腺癌术后复发转移的意义[J]. 中国肿瘤,2012,21 (1) :60–62. |
| [3] | 周瑞娟, 陈红风. 中药影响乳腺癌细胞周期的研究进展[J]. 肿瘤防治研究,2012,39 (1) :100–104. |
| [4] | 邓樱, 陈红风. 黄芪注射液及其有效成分对乳腺癌细胞增殖和Akt磷酸化的影响[J]. 中西医结合学报,2009,7 (12) :1174–1180. |
| [5] | 叶媚娜, 陈红风. 黄芪注射液对basal-like型乳腺癌细胞MDA-MB-468增殖的影响[J]. 中西医结合学报,2008,6 (4) :399–404. |
| [6] | 叶媚娜, 陈红风, 周瑞娟, 等. 黄芪多糖对基底细胞样乳腺癌细胞增殖和Akt磷酸化的影响[J]. 中西医结合学报,2011,12 (9) :1339–1346. |
| [7] | 周瑞娟, 陈红风, 叶媚娜, 等. 芒柄花素对不同亚型乳腺癌细胞增殖及细胞周期的影响[J]. 肿瘤防治研究,2012,39 (9) :1051–1055. |
| [8] | Zhou R, Xu L, Ye M, et al. Formononetin inhibits migration and invasion of MDA-MB-231 and 4T1 breast cancer cells by suppressing MMP-2 and MMP-9 through PI3K/AKT signaling pathways[J]. Horm Metab Res, 2014, 46 (11) :753–760. |
| [9] | Chen J, Zhao X, Ye Y, et al. Estrogen receptor beta-mediated proliferative inhibition and apoptosis in human breast cancer by calycosin and formononetin[J]. Cell Physiol Biochem, 2013, 32 (6) :1790–1797. |
| [10] | Chen J, Sun L. Formononetin-induced apoptosis by activation of Ras/p38 mitogen-activated protein kinase in estrogen receptor-positive human breast cancer cells[J]. Horm Metab Res, 2012, 44 (13) :943–948. |
| [11] | Hu W, Xiao Z. Formononetin Induces Apoptosis of human osteosarcoma cell line u2os by regulating the expression of Bcl-2, Bax and MiR-375 in vitro and in vivo[J]. Cell Physiol Biochem, 2015, 37 (3) :933–939. |
| [12] | Liu Y, He J, Chen X, et al. The proapoptotic effect of formononetin in human osteosarcoma cells:involvement of inactivation of ERK and Akt pathways[J]. Cell Physiol Biochem, 2014, 34 (3) :637–645. |
| [13] | Huang W J, Bi L Y, Li Z Z, et al. Formononetin induces the mitochondrial apoptosis pathway in prostate cancer cells via downregulation of the IGF-1/IGF-1R signaling pathway[J]. Pharm Biol, 2013, 52 (4) :466–470. |
| [14] | Liu X J, Li Y Q, Chen Q Y, et al. Up-regulating of RASD1 and apoptosis of DU-145 human prostate cancer cells induced by formononetin in vitro[J]. Asian Pac J Cancer Prev, 2014, 15 (6) :2835–2839. |
| [15] | Ye Y, Hou R, Chen J, et al. Formononetin-induced apoptosis of human prostate cancer cells through ERK1/2 mitogen-activated protein kinase inactivation[J]. Horm Metab Res, 2012, 44 (4) :263–267. |
| [16] | Zhang X, Bi L, Ye Y, et al. Formononetin induces apoptosis in PC-3 prostate cancer cells through enhancing the Bax/Bcl-2 ratios and regulating the p38/Akt pathway[J]. Nutr Cancer, 2014, 66 (4) :656–661. |
| [17] | Yang Y, Zhao Y, Ai X, et al. Formononetin suppresses the proliferation of human non-small cell lung cancer through induction of cell cycle arrest and apoptosis[J]. Int J Clin Exp Pathol, 2014, 7 (12) :8453–8461. |
| [18] | Jin Y M, Xu T M, Zhao Y H, et al. In vitro and in vivo anti-cancer activity of formononetin on human cervical cancer cell line HeLa[J]. Tumour Biol, 2014, 35 (3) :2279–2284. |
| [19] | Chen J, Zeng J, Xin M, et al. Formononetin induces cell cycle arrest of human breast cancer cells via IGF1/PI3K/Akt pathways in vitro and in vivo[J]. Horm Metab Res, 2011, 43 (10) :681–686. |
| [20] | Li T, Zhao X, Mo Z, et al. Formononetin promotes cell cycle arrest via downregulation of Akt/Cyclin D1/CDK4 in human prostate cancer cells[J]. Cell Physiol Biochem, 2014, 34 (4) :1351–1358. |
| [21] | Caldon C E, Daly R J, Sutherland R L, et al. Cell cycle control in breast cancer cells[J]. J Cell Biochem, 2006, 97 (2) :261–274. |
| [22] | Massague J. G1 cell-cycle control and cancer[J]. Nature, 2004, 432 (7015) :298–306. |
| [23] | Hernando E, Nahle Z, Juan G, et al. Rb inactivation promotes genomic instability by uncoupling cell cycle progression from mitotic control[J]. Nature, 2004, 430 (7001) :797–802. |
| [24] | Le X F, Claret F X, Lammayot A, et al. The role of cyclin-dependent kinase inhibitor p27 Kip1 in anti-HER2 antibody-induced G1 cell cycle arrest and tumor growth inhibition[J]. J Biol Chem, 2003, 278 (26) :23441–23450. |
 2016, Vol. 39
2016, Vol. 39


