2. 军事医学科学院毒物药物研究所, 抗毒药物与毒理学国家重点实验室, 国家北京药物安全评价研究中心, 北京 100850
2. National Beijing Center for Drug Safety Evaluation and Research, State Key Laboratory of Toxicology and Medical Countermeasures(Academy of Military Medical Sciences), Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing 100850, China
药物肝毒性是新药开发过程中临床实验阶段失败的主要原因,也是药物上市后撤回的原因之一[1]。据统计约有三分之二的进入临床实验的药物因其肝毒性而不得不终止开发,其重要原因之一是临床前药物肝毒性评价模型的局限性。目前较为认可的临床前肝毒性评价模型包括动物模型和体外细胞模型,动物模型存在实验周期较长以及伦理方面的问题,还容易受到体内复杂的神经、激素调节等的影响,存在较大的个体差异;体外评价模型多用正常/肝癌细胞系,以药物作用之后细胞的存活率、形态学变化及酶学变化等指标来指示药物的肝毒性[2, 3]。
体外评价模型较为常用的细胞系,如BRL-3A细胞(Big Rat Liver - 3A cells),是正常大鼠永生化的肝细胞[4],用于临床前早期肝毒性药物的筛选,具有操作相对简单、实验周期短、重现性好等优点,但是由于细胞长期传代生长,丧失了在体细胞的许多关键酶,不能很准确地预测药物的肝毒性。大鼠原代肝细胞用于药物肝毒性评价时能较好地避免动物实验个体差异的影响,新鲜提取的大鼠原代肝细胞含有丰富的肝脏代谢酶,具有与在体肝脏类似的功能,然而体外培养的肝细胞存活时间较短,在用于评价长期反复暴露的药物毒性时具有一定的局限性。对乙酰氨基酚(APAP)是临床常用的解热镇痛药,也是常见的引起肝毒性的药物[5]。本研究应用APAP分别作用于大鼠原代肝细胞和BRL-3A细胞,并以2种细胞的存活率、细胞形态、肝脏酶学分泌为毒性评价指标,研究2种细胞暴露于肝毒性药物的特点,为药物早期肝毒性筛选体外模型的选择提供数据支持。
1 材料 1.1 动物SPF级SD大鼠,体质量150~180 g,雄性,4~6周龄,动物合格证号SCXK(京)2012-0001,购于北京维通利华实验动物技术有限公司,饲养于军事医学科学院国家北京药物安全评价研究中心屏障设施内。动物实验均按照国际实验室动物伦理行为准则要求进行。
1.2 药物及主要试剂APAP(德国DR公司,批号C15846000);DMEM、WME培养基、胎牛血清(FBS)、L-谷氨酰胺,均购自美国Gibco公司;胰岛素(批号I5500)、地塞米松(批号D4902)、乙二胺四乙酸、IV型胶原酶、percoll分离液、D-Hanks’、Hanks’液,均购自美国Sigma公司;表皮细胞生长因子(EGF,美国peprotech公司);台盼蓝试剂盒(上海碧云天生物技术有限公司);CCK 8试剂盒(美国Signalway公司)。
1.3 主要仪器NAPCO 5400型细胞培养箱(美国Napco公司);奥林巴斯CKX41倒置相差显微镜(日本Olympus公司);BT-100B数显恒流泵(上海沪西分析仪器厂有限公司);7180全自动生化分析仪(日本日立公司);VICTOR3 V型多功能酶标仪(美国Perkin Elmer公司);CM-120透射电子显微镜(荷兰Philips公司)。
2 方法 2.1 大鼠原代肝细胞的提取与鉴定采用改良的Seglen胶原酶原位2步灌流法[6]提取大鼠原代肝细胞,灌流液I为含有0.02% EDTA的D-Hanks’溶液,灌流液II为含有0.05% IV型胶原酶的Hanks’溶液。灌流结束分别以50×g离心5 min→percoll分离液(1.06 g/mL)重悬、100×g离心10 min→50×g离心5 min的条件进行离心纯化,最后以台盼蓝拒染法检查细胞存活率[7],取存活率在90%以上的细胞用于下一步实验。
新鲜提取的大鼠原代肝细胞离心收集之后,进行过碘酸雪夫染色(Periodic Acid-Schiff stain,PAS,糖原染色),于光学显微镜下观察并显微照相。
2.2 大鼠原代肝细胞和BRL-3A细胞培养与生长规律的研究 2.2.1 大鼠原代肝细胞的培养获得的肝细胞以WME完全培养基在37 ℃、5% CO2条件下培养,培养基添加10%的FBS、40 μg/L地塞米松、600 U/L胰岛素、10 μg/L的EGF、100 μg/mL链霉素、100 U/mL青霉素、1% L-谷氨酰胺,接种密度为6×104/cm2,液面深度为1.5 mm[8],每天更换培养液。
2.2.2 BRL-3A细胞的培养培养基为DMEM高糖培养基,添加10%的FBS、100 μg/mL链霉素、100 U/mL青霉素,隔天换液,传代比例为1∶6,待细胞融合至80%时,用0.25%胰酶消化后进行实验。
2.2.3 大鼠原代肝细胞生长规律的研究将新鲜提取的大鼠原代肝细胞以每孔50 μL、6×105/mL的密度接种于96孔板中,分别于接种0、4、8、12、24 h和2、3、4、5、6、7、8 d之后进行CCK 8实验,加入含有10% CCK 8的培养基孵育6 h,测定450 nm处吸光度(A)值。接种0 h进行的CCK 8实验用来计算标准曲线,细胞在接种时是经过计数的,数目为y(万个),A值为x,计算标准曲线方程。其他时间点的A值代入标准曲线方程求算细胞数目,绘制生长曲线。
2.2.4 BRL-3A细胞生长规律的研究调整细胞密度为32×104/mL,倍比稀释得0.125×104、0.25×104、0.5×104、1×104、2×104、4×104、8×104、16×104、32×104/mL 9个浓度的细胞悬液,接种到96孔板中,接种4 h待细胞贴壁之后,取其中1块板将原培养液吸出,换成含有10% CCK 8的培养液,每孔100 μL,孵育1 h之后在450 nm处测定A值。细胞在接种4 h之内处于潜伏期,并未增殖,接种体积和密度已知,可计算出细胞数目y,以测得的A值为x,求算标准曲线方程。其他的培养板分别测定培养0.5、1、2、3、4、5、6、7、8、9、10 d后的A值,以A值代入标准曲线方程求算细胞数目,绘制生长曲线。
2.2.5 大鼠原代肝细胞生物学功能检测取新鲜提取的大鼠原代肝细胞以6×105/mL、每孔300 μL的密度接种于24孔板中,分别于培养0、8、24、48、72 h的时间点取细胞上清,3 000 r/min离心5 min后,取上清置于无菌EP管中,−80 ℃冻存,实验结束后将所有细胞上清于4 ℃解冻,用全自动生化分析仪测定上清中天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)、白蛋白(ALB)、尿素氮(BUN)、总蛋白(TP)、葡萄糖(GLU)的水平[9, 10]。
2.3 对2种细胞的毒性作用及半抑制浓度(IC50)的测定以完全培养基溶解APAP,分为空白组、对照组和APAP组,空白组只含培养基,对照组为不加药的细胞;APAP组药物浓度分别为5、10、15、20、25、30 mmol/L。在96孔板中分别培养2种细胞:新鲜提取的大鼠原代肝细胞,调整密度为6×105/mL、每孔50 μL,每天换液,培养3 d后换含药培养基进行给药实验;取对数生长期的BRL-3A细胞,按照2×104/mL、每孔100 μL接种,培养48 h后换含药培养基。每组6个复孔,分别在给药4、8、12、24、48 h后进行CCK 8实验,测定A值,计算抑制率和24 h的IC50,绘制时间-抑制率曲线。
| $ 细胞抑制率 = \left( {{A_{对照}} - {A_{APAP}}} \right)/\left( {{A_{对照}} - {A_{空白}}} \right) $ |
A空白、A对照、AAPAP分别为空白组、对照组、APAP组A值
2.4 对2种细胞形态的影响 2.4.1 对大鼠原代肝细胞形态的影响取新鲜提取的大鼠原代肝细胞,接种条件同“2.2.5”项,培养3 d后换含APAP的培养基,药物浓度设置同“2.3”项,刺激24 h后,在倒置相差显微镜下观察原代肝细胞形态并拍照,取30 mmol/L组的细胞进行透射电子显微镜超微结构观察[7]。
2.4.2 对BRL-3A细胞形态的影响将BRL-3A细胞以2×104/mL、每孔600 μL接种于提前放好爬片的24孔板中,待细胞融合至70%时,分别给予不同浓度的APAP刺激24 h,收集细胞进行苏木素-伊红(hematoxylin eosin,HE)染色、封片[7],于光学显微镜下观察并照相,取30 mmol/L组的细胞进行透射电子显微镜超微结构观察。
2.5 对2种细胞上清生化指标的影响分别取新鲜提取的大鼠原代肝细胞(接种条件同“2.4.1”)和对数生长期的BRL-3A细胞(接种条件同“2.4.2”)接种于24孔板中,培养3 d后换含药培养基,给药24 h之后取细胞上清,按照“2.2.5”项方法测定AST、ALT、LDH、ALP、ALB、BUN、TP、GLU[11]的水平。
2.6 统计学处理数据均以$\bar x \pm s$表示,IC50由Graphpad Prism 6.0软件计算,标准曲线用Excel计算,其他数据应用SPSS 19.0软件进行单因素方差分析(one-way- ANOVA),Dunnett法对数据进行统计学分析。
3 结果 3.1 大鼠原代肝细胞的提取鉴定每只SD大鼠可获得(100~300)×106个细胞,台盼蓝拒染法计算存活率,其存活率在80%以上。原代大鼠肝细胞爬片经PAS糖原染色,胞浆呈紫红色,为PAS阳性,纯度达100%。新鲜提取的肝细胞经石蜡包埋切片、HE染色,在光学显微镜下观察,发现细胞有单核和双核,呈现肝细胞的典型特征,因此鉴定为大鼠肝实质细胞。结果见图 1。
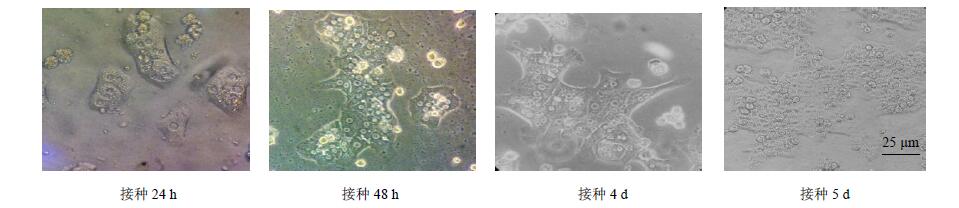
|
图 1 原代大鼠肝细胞不同时期的形态 Fig. 1 Morphology of rat primary hepatocytes in different periods |
3.2 大鼠原代肝细胞培养与生长规律的研究 3.2.1 培养及生长规律的研究
大鼠原代肝细胞最佳接种密度为6×104/cm2,最佳液面深度为1.5 mm,接种12 h之后部分开始贴壁,24 h之后大部分贴壁,48 h完全贴壁,细胞连成岛状结构,第3天开始大量生长,肝细胞自动排列成肝索样结构,肝细胞表现为多角形,呈典型的肝细胞形态。第6天细胞开始收缩、聚成团并脱落。生长曲线结果显示,接种8 h细胞数目急剧下降,10 h之后趋于稳定并渐渐开始上升,3~5 d为对数期,生长迅速,第6天开始下降,进入衰退期。结果见图 2。标准曲线方程为y=2.068 2 x2+5.655 8 x-0.671 7,R2=0.999 3。根据生长曲线,选择接种第3~5天的细胞进行给药实验。
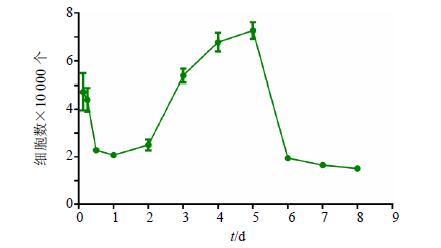
|
图 2 大鼠原代肝细胞生长曲线 Fig. 2 Growth curve of rat primary hepatocytes |
3.2.2 大鼠原代肝细胞泌酶功能
与刚提取的细胞相比,原代细胞培养8 h之后,分泌的LDH、ALT、AST大幅度下降(P<0.05、0.01),表明提取过程中受损的细胞在渐渐恢复;从接种24 h开始,与刚提取时相比,GLU开始下降,TP和BUN升高,此3指标变化均差异显著(P<0.05、0.01),而BUN早在接种8 h即有小幅度上升,提示肝细胞受损之后的恢复期内,最先恢复BUN的分泌功能,到24 h渐渐恢复其他酶的分泌功能。结果见表 1。
| 表 1 大鼠原代肝细胞培养上清液中酶分泌功能检测($ \bar x \pm s $, n = 4) Table 1 Enzyme secretion of primary hepatocytes in supernatant ($ \bar x \pm s$, n = 4) |
3.3 BRL-3A细胞的生长规律的研究
BRL-3A细胞标准曲线方程为y=34.259 x+0.626 3,R2=0.997 6。细胞传代后4 h即全部贴壁伸展,呈梭形或多边形,细胞形态饱满,折光性好,根据接种密度的不同,潜伏期和对数期持续长短各不相同,最佳接种密度为2×104/mL,接种48 h后进入对数生长期,持续3 d。结果见图 3。
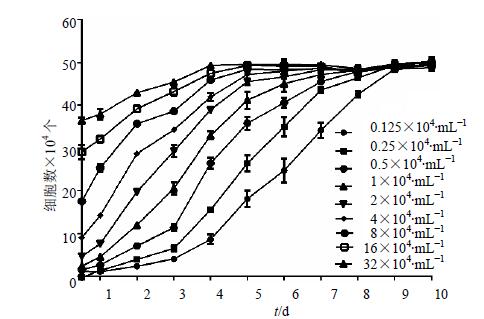
|
图 3 不同接种密度的BRL-3A细胞生长曲线($ \bar x \pm s $, n = 12) Fig. 3 Growth curves of BRL-3A cells with different inoculation concentration($ \bar x \pm s $, n = 12) |
3.4 作用于2种细胞的IC50的测定及毒性作用研究
APAP对2种细胞有毒性作用,随着浓度和作用时间增加,抑制作用逐渐增强。作用4 h,对大鼠原代肝细胞没有抑制作用,对BRL-3A细胞的抑制作用随着浓度升高而增大。作用24 h,当APAP浓度高于15 mmol/L时,对2种细胞的抑制率较为一致,20 mmol/L的APAP对2种细胞的抑制率都达到50%以上;5 mmol/L的APAP对大鼠原代肝细胞抑制率达到18.88%,而对BRL-3A细胞具有促进生长的作用。作用24 h对大鼠原代肝细胞和BRL-3A细胞的IC50分别为18.03 mmol/L(95%置信区间为17.28~18.81 mmol/L)和20.05 mmol/L(95%置信区间为18.99~21.17 mmol/L)。结果见表 2。
| 表 2 APAP对大鼠原代肝细胞和BRL-3A细胞的抑制率 ($ \bar x \pm s $, n = 8) Table 2 Inhibition of APAP on growth of primary hepatocytes and BRL-3A cells ($ \bar x \pm s $, n = 8) |
3.5 对2种细胞形态的影响 3.5.1 对大鼠原代肝细胞形态的影响
对照组细胞贴壁牢固,呈上皮样连成岛状,折光性好,高倍镜下可观察到丰富的细胞器和细胞核,5 mmol/L组细胞形态变化不明显,10~20 mmol/L组随着染毒浓度增加贴壁细胞明显减少,皱缩,悬浮细胞增多,30 mmol/L组细胞折光性差,明显变形,贴壁不牢。结果见图 4。

|
图 4 APAP对细胞形态学的影响 Fig. 4 Toxic effect of APAP on cell morphology |
3.5.2 对BRL-3A细胞形态的影响
对照组细胞胞核呈圆形、卵圆形,核浆比例均匀,可见分裂核,生长状态良好。5 mmol/L组爬片与对照组比较,稍微淡染,但状态相对较好。20 mmol/L组细胞散在,相对稀疏,可见弥漫分布,胞核圆形、卵圆形或不规则性,胞浆宽窄不一,核浆比例多少不一,核分裂不多见,结构不清,与对照组比较,明显淡染。30 mmol/L组可见细胞弥散分布,较其它爬片明显稀疏,部分区域可见多量细胞缩成团,结构不清,细胞核几乎不可见。结果见图 5。
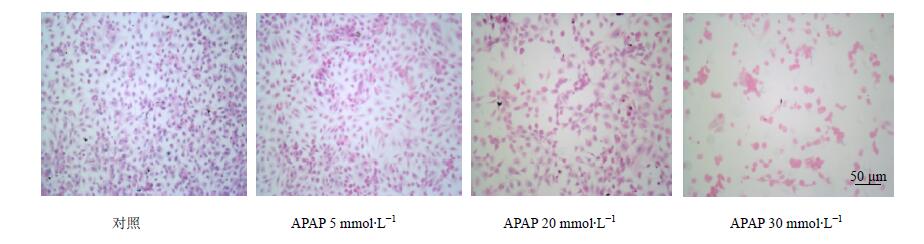
|
图 5 APAP对BRL-3A细胞形态学的影响 Fig. 5 Toxic effect of APAP on BRL-3A cell morphology |
3.5.3 对BRL-3A细胞、大鼠原代肝细胞超微结构的影响
在30 mmol/L APAP的作用下,BRL-3A细胞在透射电子显微镜下观察,出现严重的结构损伤,核膜破裂,细胞边界模糊不清。原代大鼠肝细胞线粒体等细胞器几乎完全破损,依稀可以看到部分糖原和双核结构。结果见图 6。
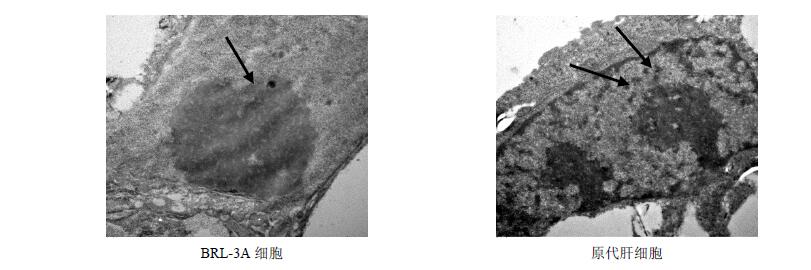
|
图 6 APAP对BRL-3A细胞、大鼠原代肝细胞超微结构的影响 Fig. 6 Toxic effect of APAP on ultrastructure of BRL-3A cells and primary hepatocytes |
3.6 对2种细胞上清生化指标的影响 3.6.1 对大鼠原代肝细胞上清生化指标的影响
作用24 h之后,随着APAP浓度的升高,10、25、30 mmol/L组的AST和所有给药组的BUN、GLU显著升高(P<0.01);ALP、LDH给药组与对照组比较显著降低(P<0.05、0.01);ALB和TP变化差异不显著(P>0.05)。结果见表 4。
| 表 4 APAP对大鼠原代肝细胞的酶学变化的影响($ \bar x \pm s $, n = 4) Table 4 Acetaminophen influence on enzyme secretion of primary hepatocytes ($ \bar x \pm s $, n = 4) |
3.6.2 对BRL-3A细胞上清生化指标的影响
作用24 h之后,随着APAP浓度的升高,BRL-3A细胞分泌的AST有所升高,差异不显著;与对照组比较,ALP、LDH显著降低(P<0.05、0.01);25、30 mmol/L组的ALT显著升高(P<0.05)。结果见表 5。
| 表 5 APAP对BRL-3A细胞的酶学变化的影响 ($ \bar x \pm s $, n = 4) Table 5 Acetaminophen influence on enzyme secretion of BRL-3A cells ($ \bar x \pm s $, n = 4) |
4 讨论
本研究将大鼠原代肝细胞和大鼠正常肝细胞系BRL-3A细胞暴露于同样浓度范围(5~30 mmol/L)的肝毒性药物APAP,测定不同浓度药物对细胞的毒性。细胞存活率是反映细胞受损的重要指标,APAP作用于大鼠原代肝细胞和BRL-3A细胞24 h后,10~30 mmol/L给药组细胞存活率均低于对照组,抑制率随着药物浓度增大而增大,呈现剂量-效应关系,APAP对大鼠原代肝细胞的IC50为18.03 mmol/L,对大鼠BRL-3A细胞的IC50为20.05 mmol/L,2种细胞的95%置信区间没有交叉部分,完全独立,即2个IC50之间有显著性差异,提示BRL-3A细胞对APAP肝毒性的敏感性较原代大鼠肝细胞差。APAP在较低浓度(5 mmol/L)时,对原代大鼠肝细胞的抑制率大于BRL-3A细胞,而在较高浓度(30 mmol/L)时,对BRL-3A细胞的毒性大于大鼠原代肝细胞。在暴露于肝毒性药物APAP时,传代肝细胞系BRL-3A细胞的酶学指标的变化几乎没有显著性,而原代大鼠肝细胞的AST、ALT显著升高,GLU水平升高,即其消耗量下降,提示原代大鼠肝细胞能够以酶学指标变化来指示肝毒性。王雁等[12]进行了APAP的在体动物实验,发现大鼠血清中AST、ALT显著升高,与本研究结果吻合,表明大鼠原代肝细胞具有与在体动物实验模型相似的肝毒性评价能力。同样源自大鼠肝脏,BRL-3A细胞在药物的敏感性和肝脏特有的代谢酶表达水平方面均低于大鼠原肝细胞,可能是由于其长期传代生长,慢慢去分化成为上皮样细胞,逐渐丧失了肝细胞原有的特性。
本实验发现,24孔板每孔300 μL,细胞密度为6×105/mL时为最佳原代细胞培养条件,随着单位培养面积细胞数量的增加,细胞存活率降低,甚至完全不贴壁,这与常规的24孔板每孔600 μL[13, 14]差别较大,推测原因可能与培养液深度有关。BUCK L D报道,原代肝细胞对氧气比较敏感,当培养液深度大于2 mm时,即有缺氧的危险[8],经计算本实验培养液深度为1.5 mm,与文献报道一致。文献报道[15],多用I型胶原包被培养板以促进细胞贴壁,但由于其是天然来源,含有很多不确定成分,用于给药实验时会造成一定的干扰,在原代大鼠肝细胞培养液WME培养基中除了添加常规的FBS和双抗之外,额外添加地塞米松、胰岛素和EGF,为肝细胞提供必要的生长因子,以促进其贴壁和DNA合成,在用于评价药物早期肝毒性时具有更大的优势。
本实验发现,一方面,大鼠原代肝细胞达到半数抑制量所需要的APAP浓度低于BRL-3A细胞,即暴露在较低浓度的药物下即可检测出肝毒性,提示其敏感性较好;同时其分泌的AST、ALT、GLU随着药物暴露量增加而产生相应的变化,与在体动物实验结果一致,而BRL-3A细胞几乎所有的酶学指标变化都没有统计差异,具有一定的局限性;另一方面,原代大鼠肝细胞体外培养存活时间较短,而BRL-3A细胞是永生化细胞,可以无限传代,在进行长期反复给药实验中,BRL-3A细胞则是较为合适的细胞模型。BRL-3A细胞和大鼠原代肝细胞作为2种临床前早期药物肝毒性评价模型,各自有不同的优势。在临床前早期肝毒性药物筛选中,需要根据不同的实验要求选择合适的评价模型,才能更好地开展临床前药物安全性评价工作。另外,与永生化细胞相比,大鼠原代肝细胞更能体现药物的肝脏毒性作用,BRL-3A细胞缺少肝脏重要酶类,增加永生化细胞肝脏酶类是提升永生化细胞作为肝脏毒性筛选模型的更好手段之一。
| [1] | Chalasani N P, Hayashi P H, Bonkovsky H L, et al. ACG Clinical Guideline:the diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2014, 109 (7) :950–966. |
| [2] | Hong K B, Noh D O, Park Y, et al. Hepatoprotective activity of water extracts from chaga medicinal mushroom, inonotus obliquus (higher basidiomycetes) against tert-butyl hydroperoxide-induced oxidative liver injury in primary cultured rat hepatocytes[J]. Int J Med Mushrooms, 2015, 17 (11) :1069–1076. |
| [3] | 孔庆喜, 罗曼, 赵煜, 等. 临床生化指标在新药临床前研究中的毒理学意义[J]. 药物评价研究,2014,37 (5) :472–475. |
| [4] | Hu F Q, Meng P, Dai Y Q, et al. PEGylated chitosan-based polymer micelle as an intracellular delivery carrier for anti-tumor targeting therapy[J]. Eur J Pharm Biopharm, 2008, 70 (3) :749–757. |
| [5] | 张云, 彭维兵, 王希敏, 等. 采用斑马鱼模型评价对乙酰氨基酚的肝脏毒性[J]. 药物评价研究,2013,36 (5) :351–354. |
| [6] | Seglen P O. Preparation of isolated rat liver cells[J]. Methods Cell Biol, 1976, 13 :29–83. |
| [7] | 司徒镇强, 吴军正. 细胞培养[M]. 西安: 世界图书出版社, 2001 . |
| [8] | Buck L D, Inman S W, Rusyn I, et al. Co-regulation of primary mouse hepatocyte viability and function by oxygen and matrix[J]. Biotechnol Bioeng, 2014, 111 (5) :1018–1027. |
| [9] | 滕光菊, 白雪帆, 徐哲, 等. 大鼠原代培养肝细胞的生物学特性研究[J]. 中国现代医学杂志,2003,13 (8) :5–8. |
| [10] | 贾珍容, 邱银生, 王大菊, 等. 齐多夫定对原代大鼠肝细胞毒性作用的研究[J]. 药物不良反应杂志,2009,11 (2) :91–95. |
| [11] | 田丽, 尹玲, 关莉莉, 等. 红景天苷对原代培养脂肪变性大鼠肝细胞细胞色素P4502E1蛋白表达的抑制作用[J]. 实用肝脏病杂志,2015 (3) :270–273. |
| [12] | 王雁, 汤纳平, 富欣, 等. 对乙酰氨基酚诱导的急性肝损伤大鼠血浆miR-122表达的变化[J]. 中国药理学与毒理学杂志,2013,27 (5) :854–859. |
| [13] | Severgnini M, Sherman J, Sehgal A, et al. A rapid two-step method for isolation of functional primary mouse hepatocytes:cell characterization and asialoglycoprotein receptor based assay development[J]. Cytotechnology, 2012, 64 (2) :187–95. |
| [14] | Tolosa L, Bonora-centelles A, Donato M T, et al. Influence of platelet lysate on the recovery and metabolic performance of cryopreserved human hepatocytes upon thawing[J]. Transplantation, 2011, 91 (12) :1340–1346. |
| [15] | 沈冲, 徐小梅, 孟琴, 等. 原代肝细胞体外培养用于利福平和异烟肼肝毒性的研究[J]. 中国药科大学学报,2005,36 (3) :250–253. |
 2016, Vol. 39
2016, Vol. 39


