李树婷, 杨丽, 张黎, 房虹, 程金莲, 赵侠, 阎昭, 严海泓, 陈勇川, 韩志春, 孙彬贤, 王菁菁, 赵丹, 曹彩. 临床研究药物中心化管理现场评估标准[J]. 药物评价与研究, 2016, 39(3): 335-344.

LI Shu-ting, YANG Li, ZHANG Li, FANG Hong, CHNEG Jin-lian, ZHAO Xia, YAN Zhao, YAN Hai-hong, CHEN Yong-chuan, HAN Zhi-chun, SUN Bin-xian, WANG Jing-jing, ZHAO Dan, CAO Cai. The standard of on-site inspection for clinical investigational drug centralized management[J]. Drug Evaluation Research, 2016, 39(3): 335-344.

中关村玖泰药物临床试验技术创新联盟/中国GCP 联盟, 北京 100034
收稿日期: 2015-04-16
作者简介: 李树婷,女,副主任技师。
通信作者: 曹彩,主任药师,教授,硕士生导师。
The standard of on-site inspection for clinical investigational drug centralized management
ZhongguancunJiutai Drug Clinical Trial Technology Innovation Association/Chinese GCP Association, Beijing 100034, China
一、为了促进临床研究药物标准化管理,鼓励药物临床试验机构能够规范临床研究药物管理,提高其管理质量,确保临床试验过程的规范、结果的科学可靠,最大程度保障受试者的权益和健康而设立本标准。本标准依据《药物临床试验质量管理规范》(局令第3号)和《药物临床试验机构资格认定检查细则》以及《药物临床试验数据现场核查要点》,参考ICH-GCP、赫尔辛基宣言、WHO-GCP原则要求制定本检查标准(试行)。
二、本检查标准适用于药物临床试验机构临床研究药物中心化管理的现场评估工作。实施现场评估工作应在机构中心化管理工作正式运行至少2个月后进行。
三、对研究药物中心化管理的检查标准包括8个检查环节,63个检查项目,其中关键项目54项,一般项目9项(标记为▲)。关键项目为要求达标的内容,一般项目为鼓励达标的内容,根据关键项目的达标率决定现场检查结果。
四、检查评估条件、评分标准及结果评定
1、评估条件:中心化管理的试验药物项目数应达到全部在研项目数的60%,或完成5项试验药物项目的全过程管理。
2、评分标准:每个检查项目分为3个等级(不达标、不完善、达标)。
3、结果评定:关键项目和一般项目独立计算。1项不完善,折算为0.5项不达标;2项不完善,折算为1项不达标。
|
$
关键项目达标率=关键项目达标数/\left( {关键项目总数-关键项目中不适用总项数} \right) \times 100\%
$
|
|
$
一般项目达标率=一般项目达标数/\left( {一般项目总数-一般项目中不适用总项数} \right) \times 100\%
$
|
关键项目达标率≥90%,评定等级为优;
关键项目达标率≥80%,评定等级为良;
关键项目达标率≥70%,评定等级为合格;
关键项目达标率<70%,按要求整改后,可以再次进行评估。
五、基于联盟各机构的管理现状和现实条件,为了使临床研究药物中心化管理能够切实可行,并考虑临床试验的多样性和复杂性,鼓励临床研究药物中心化管理,允许建立研究药物卫星药房作为辅助,卫星药房的管理职责属于中心化药房管理的一部分,均由中心药房负责监管,监管标准一致。
六、临床研究药物中心化管理的现场检查内容及评估标准,见表 1。
表 1(Table 1)
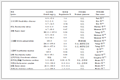
表 1 临床研究药物中心化管理的现场检查内容及评估标准
Table 1 Site inspection content and evaluation criteria of clinical investigational drug centralized management
| 检查环节 |
检查项目 |
重要程度 |
| 1. 空间条件 |
|
|
| 1.1 |
有独立、安全的药物储存房间 |
|
| 1.2 |
有足够摆放药物的场地 |
|
| 1.3 |
空间布局合理,环境整洁卫生 |
|
| 1.4 |
不同功能区域分开,具有明显标示 |
|
| 1.5 |
环境温湿度条件符合药物储存要求 |
|
| 2. 硬件设备及设施 |
|
|
| 2.1 |
药物常温储存柜,专柜专锁专人保管 |
|
| 2.2 |
药物冷藏冰箱(2~8℃),有年检报告 |
|
| 2.3 |
药物阴凉恒温柜/室(20℃以下),有年检报告 |
▲ |
| 2.4 |
空调 |
|
| 2.5 |
除湿机、加湿器 |
▲ |
| 2.6 |
防火、防盗、防潮、防虫等 |
|
| 2.7 |
应急设施,如:双路电/不间断电源(UPS) |
|
| 2.8 |
中央24 h温湿度监测,并具备报警功能 |
|
| 2.9 |
温湿度监控设施有计量部门的校准证书 |
|
| 2.10 |
满足避光条件 |
|
| 3. 人员要求及资质 |
|
|
| 3.1 |
本机构或医院的在职人员,具有药师及以上职称,并有本人签字的人员简历 |
|
| 3.2 |
有年度体检合格报告 |
|
| 3.3 |
熟悉临床研究药物管理流程 |
|
| 3.4 |
接受过GCP方面培训,并有5年内培训证书 |
|
| 3.5 |
根据工作需要,设有辅助人员作为备用药物管理员(可以是护士、医生等) |
▲ |
| 4. 管理制度及标准操作规程 |
|
|
| 4.1 |
临床研究药物管理制度 |
|
| 4.2 |
临床研究药物接收SOP |
|
| 4.3 |
临床研究药物保管SOP及丢失处理SOP |
|
| 4.4 |
临床研究药物发放SOP |
|
| 4.5 |
临床研究药物发放SOP |
|
| 4.6 |
临床研究药物发放SOP |
|
| 4.7 |
临床研究药物发放SOP |
|
| 4.8 |
不合格药物管理SOP |
|
| 4.9 |
临床研究药物抽样和留样SOP |
|
| 4.10 |
临床研究药物拆零使用SOP |
|
| 4.11 |
临床研究特殊药物(毒、麻、精神、放射性药物)管理SOP |
|
| 4.12 |
临床研究药物相关文件保管SOP |
|
| 4.13 |
温湿度记录SOP |
|
| 4.14 |
医疗垃圾处理SOP |
▲ |
| 4.15 |
来访人员登记SOP |
▲ |
| 4.16 |
应急事件处理SOP及严重差错应急预案 |
|
| 5. 研究药物管理流程及总要求 |
|
|
| 5.1 |
临床研究药物仅用于入组该试验的受试者,不得挪作他用,不得在市场上销售 |
|
| 5.2 |
药物剂量与用法严格遵照临床试验方案 |
|
| 5.3 |
药物储存条件符合要求,温湿度记录完整 |
|
| 5.4 |
试验开始前,药物管理员接受项目相关培训,并有培训记录 |
|
| 5.5 |
药物管理员必需经过主要研究者(PI)授权 |
|
| 5.6 |
有完整的临床研究药物接收、发放、回收、退回或销毁等记录 |
|
| 5.7 |
接收 |
|
| 5.7.1 |
有药检报告 |
|
| 5.7.2 |
核对药物名称、规格、数量、批号、编号、有效期的记录 |
|
| 5.7.3 |
临床研究药物有“仅供临床研究使用” 特殊标签,注明以下内容(但不限于):研究方案名称/编号,药名,药物编号,规格(具体到最小包装),用法用量,储存条件,批号、生产日期、有效期,生产厂家、申办方等内容 |
|
| 5.7.4 |
有药物运送单,并签名及日期 |
|
| 5.7.5 |
有药物运输过程的温度记录 |
|
| 5.7.6 |
药物在运送过程超温,药物管理员及时与申办方/PI沟通,有超温报告及处理记录(包括拒收、隔离等) |
|
| 5.8 |
保存 |
|
| 5.8.1 |
每个试验项目设定相对独立的药物存放位置,并有明显的标识 |
|
| 5.8.2 |
出现超出储存温度范围或其他应急事件时,要及时采取调控应急措施,并有超温记录及事件处理记录 |
|
| 5.9 |
发放 |
|
| 5.9.1 |
凭试验项目授权的医师开具的处方/领药单进行试验用药物的发放,内容包括但不限于临床试验名称/方案号,受试者姓名及编号,药物名称,药物编号(如适用),数量、规格,用法用量,签字,日期等信息齐全、清晰 |
|
| 5.9.2 |
发药时核对处方中的内容,并有核对记录,双人核对,核对人可以是药师、护士、医生、CRC等研究相关人员 |
|
| 5.9.3 |
发放药物时应向受试者解释用药方法、储存条件及注意事项等(如适用) |
▲ |
| 5.10 |
回收
清点、核对剩余的药物以及已用药物空包装等,核对无误后进行回收,并有相关记录 |
|
| 5.11 |
退回
有完整的退回药物记录 |
|
| 5.12 |
销毁
如果由机构销毁回收药物,机构需保存销毁公司的资质文件、申办者的销毁授权和完整的销毁记录(如适用) |
▲ |
| 5.1.3 |
留样
根据国家相关标准留样,有完整的留样药物记录(如适用) |
▲ |
| 5.14 |
盘点和补领 |
|
| 5.14.1 |
定期盘点临床研究药物并有记录,药物数量不足或接近有效期时,及时与申办方联系,提醒供应药物 |
|
| 5.14.2 |
药物丢失、破损、变质、失效,隔离放置,有明显标识,有相应记录 |
|
| 5.15 |
稽查与监查
协助配合临床试验项目的稽查、监查等工作,有来访计划或记录 |
|
| 6. 药物记录档案管理 |
|
|
|
当试验结束时要清点所有记录,作为临床试验资料,按项目所规定的时间要求保存 |
|
| 7 |
特殊药物的管理 |
|
|
试验如涉及特殊药物(毒、麻、精神、放射性药物),除上述要求外还应符合国家有关特殊药物管理规定 |
|
| 8 |
管理信息系统 |
|
|
表 1 临床研究药物中心化管理的现场检查内容及评估标准
Table 1 Site inspection content and evaluation criteria of clinical investigational drug centralized management
|
七、研究药物卫星药房管理
1、卫星药房的设立标准:术中用药;放射性治疗药物;特殊试验人群药物(如:疫苗试验、急诊用药);协作医院的临床研究等。
2、卫星药房的设立程序:确定卫星药房药物管理员是否符合要求,并有相关培训记录;确定药物储存地点及设施是否符合要求;制定卫星药房试验药物管理制度;向GCP中心申请卫星药房管理资格。
3、卫星药房的人员授权:卫星药房药物管理员需获得PI授权,并在GCP中心进行登记,可以是药师、医师、护士等,并经过药物管理培训。
4、卫星药房的管理职责:保证卫星药房临床研究药物规范化管理,确保受试者安全有效使用试验用药物。
5、卫星药房的检查标准:根据各个临床试验具体情况,对卫星药房进行分阶段检查,并有检查记录。
6、卫星药房的质量控制:在试验任何阶段发现问题,临床试验药物专职管理员将及时纠正;问题严重时,将通报给研究者及GCP中心。
八、各国药典中温度标准及相关解释,仅供参考。见表 2。
表 2(Table 2)

表 2 各国药典中温度标准及相关解释
Table 2 Temperature standard and related explanation in Pharmacopoeia of each country
| 温度标准 |
美国药典34 |
欧洲药典7.0 |
中国药典2015版 |
| 冷冻储存 |
−25~−10℃ |
深冷 |
低于-15℃ |
|
|
| 冷处 |
不超过8℃ |
|
|
冷处 |
2~10℃ |
| 控制的冷处 |
2~8℃,允许在0~15℃ |
冰箱中储存 |
2~8℃ |
|
|
| 阴凉储存 |
8~15℃ |
阴凉储存 |
8~15℃ |
阴凉处 |
不超过20℃ |
|
|
|
|
凉暗处 |
避光并不超过20℃ |
| 室温 |
工作室的一般温度 |
|
|
|
|
| 控制下的室温储存 |
20~25℃,允许在15~30℃ |
室温储存 |
15~25℃ |
常温(室温) |
10~30℃ |
| 温暖 |
30~40℃ |
|
|
|
|
| 过热 |
40℃以上 |
|
|
|
|
| 干燥储存 |
控制室温下湿度不超过40% |
|
|
|
|
|
表 2 各国药典中温度标准及相关解释
Table 2 Temperature standard and related explanation in Pharmacopoeia of each country
|
九、本标准由中关村玖泰药物临床试验技术创新联盟/中国GCP联盟临床研究药物中心化管理项目组起草,联盟会员大会审议发布,联盟成员单位试行。
本标准的起草及修订记录:
1. 讨论稿1,撰写人:中国医学科学院血液病医院药理机构严海泓,2014年10月17日
2. 讨论稿2,修订人:中国医学科学院肿瘤医院GCP中心房虹、李树婷,2014年11月3日
3. 讨论稿3,修订人:GCP联盟曹彩,2014年11月6日
4. 讨论稿4,修订人:临床研究药物中心化管理项目检查组全体成员,2014年11月25日
5. 修订稿1.0,修订人:临床研究药物中心化管理项目检查组全体成员,2014年12月25日
6. 修订稿2.0,修订人:临床研究药物中心化管理项目检查组全体成员,2015年1月9日
7. 修订稿3.0,修订人:临床研究药物中心化管理项目检查组全体成员,2015年4月16日
8. 修订稿3.1,修订人:临床研究药物中心化管理项目检查组全体成员,2015年4月30日
9. 修订稿3.2,修订人:临床研究药物中心化管理项目检查组全体成员,2015年7月31日
10. 正式版1.0,定稿人:临床研究药物中心化管理项目检查组全体成员,2016年1月15日
临床研究药物中心化管理项目检查组成员:
李树婷 中国医学科学院肿瘤医院 副主任技师组长
杨丽 北京大学第三医院 副主任药师副组长
张黎 上海长海医院 副研究员副组长
赵侠 北京大学第一医院 主任药师成员
阎昭 天津医科大学肿瘤医院 主任药师成员
严海泓 中国医学科学院血液病医院 副主任药师成员
陈勇川 重庆第三军医大学西南医院 副主任药师成员
程金莲 首都医科大学附属北京中医医院 副主任医师成员
韩志春 辉凌医药研究有限公司 临床研究副总监 成员
孙彬贤 勃林格殷格翰制药公司 药物专员成员
王菁菁 赛诺菲制药有限公司 药物专员成员
赵丹 北京诺华制药有限公司 培训经理成员
曹彩 中关村玖泰药物临床试验技术创新联盟 主任药师 特邀顾问
致谢:(排名不分先后)
北京大学第三医院
北京大学第一医院
首都医科大学附属北京中医医院
中国医学科学院肿瘤医院
中国医学科学院血液病医院
天津医科大学肿瘤医院
中国人民解放军第二军医大学长海医院
中国人民解放军307医院
长春中医药大学附属医院
中国医科大学附属第一医院
黑龙江中医药大学附属第一医院
湖南省肿瘤医院
上海市公共卫生临床中心
上海市精神卫生中心
上海中医药大学岳阳医院
辽宁中医药大学附属第二医院
 2016, Vol. 39
2016, Vol. 39

