2. 北京协和医学院药用植物研究所, 中草药物质基础与资源利用教育部实验室, 北京 100193;
3. 哈尔滨商业大学, 生命科学与环境科学研究中心, 黑龙江 哈尔滨 150076
2. Peking Union Medical College, The Lab. of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Institute of Medicinal Plant Development, Beijing 10019, China;
3. Life Sciences and Environmental Sciences Center, Harbin university of commerce, Harbin 150076, China
甘草次酸(glycyrrhetic acid,GA)是甘草酸的水解产物,也是甘草的主要活性成分之一[1],具有多种药理作用,如抗炎、抗溃疡和肾上腺素皮质激素功能[2, 3, 4]。甘草次酸已用于治疗肝脏疾病以及风湿性关节炎、溃疡[5, 6],近年来也发现其具有不错的抗肿瘤效果,如乳腺癌、肝细胞癌、肺癌等[7, 8, 9, 10]。甘草次酸在水中溶解度差[11, 12],迄今为止关于甘草次酸的纳米给药系统,如脂质体[13, 14]、固体脂质纳米粒[15]、聚合物纳米粒[16]等,虽在一定程度上能解决其给药问题,但载药量相对均有限,且体内研究较为缺乏。故本研究尝试将其制备成高载药量、适合iv的纳米混悬剂,并以考察其在大鼠体内的药动学行为。
1 仪器和材料Zetasizer nano ZS 型粒度仪(英国Malvern Instruments公司);PURELAB Classic 综合纯水仪(英国ELGA公司);LGJ-10B冷冻干燥机(北京四环科学仪器厂有限公司);SHA-B水浴恒温振荡器(金坛国旺实验仪器厂);KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司);RJ-TGL-16C型高速台式离心机(无锡市瑞江分析仪器有限公司);Meppler Toledo AL204电子天平(梅特勒-托利多仪器有限公司);S-4800型扫描电子显微镜(日本Hitachi公司);JEM-1400透射电子显微镜(日本株式会社);U3000高效液相色谱仪(戴安有限公司);LGL-10B冷冻干燥机(军事医学科学院实验仪器厂研制,北京四环科学仪器厂有限公司制造)。
甘草次酸对照品(中国食品药品检定研究院,批号110723-200612);甘草次酸纳米混悬剂(自制);乙腈为色谱纯,其余均为分析纯。
健康SD大鼠,雄性,180~200 g,SPF级,北京维通利华实验动物有限公司,动物许可证号:SCXK(京)201-0001,合格证编号11400700006035。
2 方法 2.1 甘草次酸纳米混悬剂(GA-NSPs)的制备和载药量测定将甘草次酸和聚乙二醇-聚己内酯(PEG2000- PCL2000)(5:1)溶于3.00 mL丙酮中,在超声(25 ℃,250 W)条件下,匀速缓慢注入到15.00 mL去离子水中,45 ℃减压旋转蒸发除去丙酮后,高压均质(45 ℃,200 000 kPa)18次,即得GA-NSPs。以Zetasizer nano ZS 型粒度仪测定纳米混悬剂的粒径、粒度分布和表面电位。
精密吸取GA-NSPs 100.00 μL于Eppendorf管中,乙腈破坏,进HPLC检测,计算甘草次酸含量。另取GA-NSPs 3.00 mL于−80 ℃放置3 h后,放入冷冻干燥机中,待完全干燥后称重,平行3份,并按如下公式计算载药量。
载药量=纳米混悬剂中的药物量/纳米混悬剂的总质量
2.2 GA-NSPs的透射电镜观察将GA-NSPs用去离子水稀释到甘草次酸质量浓度为0.10 mg/mL,取6.00 μL滴到300目的铜网上,静置5 min后滤纸吸干,空气中放置10 min后,滴加6.00 μL醋酸铀染色90 s,滤纸吸干,室温晾3 min,透射电镜下观察纳米粒子的形态和大小。
2.3 GA-NSPs不同介质稳定性考察分别配制1.8%的氯化钠溶液、10%葡萄糖溶液,逐滴滴加到1.00 mL GA-NSPs中,最终将纳米混悬剂调到外水相为生理盐水和5%葡萄糖等渗溶液。将1.00 mL PH 7.4 的PBS溶液滴加到1.00 mL纳米混悬剂中混合均匀,分别配置人工胃液、人工肠液,10 000 r/min离心10 min后取上清4.00 mL,逐滴滴加到1.00 mL GA-NSPs中混匀,37.0 ℃恒温孵育5 h,于0、3、5 h以Zetasizer nano ZS 型粒度仪测定粒径并观察粒径变化情况。
2.4 GA-NSPs冻干复溶稳定性考察精取吸取GA-NSPs 1.00 mL于西林瓶中,另取GA-NSPs 1.00 mL分别加入4%麦芽糖和1%麦芽糖,-80 ℃预冻1 h后,迅速放入冷冻干燥机中,冻干12 h,取出后分别加入一定体积去离子水、0.9%氯化钠溶液、5%葡萄糖溶液,超声30 s分散,用动态光散射测定其粒径,并监测其在4 ℃放置过程中的粒径变化。
2.5 甘草次酸的体外释放将GA-NSPs稀释到1.00 mg/mL,取1.00 mL加入1%胎牛血清后置于截留相对分子质量为 8 000~14 000的透析袋内,两端扎紧,以50.00 mL的PBS溶液(含1%胎牛血清)作为释放外液,100 r/min、37 ℃恒温水浴条件下震荡,不同时间点取1.00 mL释放外液冻干,并补加等体积、37 ℃的释放外液,每隔24 h更换1次外液,平行3份。另取1.00 mg GA药物原粉用1.00 mL含1%胎牛血清的水溶液混悬后得甘草次酸原药溶液(GA-CS),同法处理,平行3份。
将不同时间点取出的释放外液冷冻干燥24 h后,加入1.00 mL甲醇沉淀蛋白,10 000 r/min离心10 min取上清,用高效液相外标法测定含量,计算累积释放量。
2.6 甘草次酸体内含量测定的方法学考察 2.6.1 色谱条件色谱柱为 Symmetry shield C18(250 mm×4.6 mm,5 μm),柱温25℃,流动相为乙腈(A)-0.1% 磷酸水(B),梯度洗脱(0~0.05 min,10%B;0.1~1.3 min,100%B;1.35~10 min,10%B),体积流量1.00 mL/min,进样量50.00 μL。
2.6.2 甘草次酸对照溶液的配制用外标法对甘草次酸的含量进行测定。精密称取10.00 mg甘草次酸对照品,置于10.00 mL量瓶中,加甲醇溶解并定容至10.00 mL,得1.00 mg/mL的甘草次酸对照品贮备液。精密量取该贮备液,甲醇分别稀释得浓度0.10、0.01 mg/mL的系列甘草次酸对照品溶液。
2.6.3 血浆样品处理取含药血浆200.00 μL加1.00 mL乙腈沉淀蛋白,涡旋1 min后室温放置10 min,8 000 r/min离心5 min,取上清加入到含50.00 mg氯化钠的Eppendorf管中,涡旋1 min混匀后室温放置10 min使其部分溶解,8 000 r/min离心5 min,取出全部上清于Eppendorf管中,取50.00 μL进HPLC检测分析。
2.6.4 标准曲线的制备分别配制质量浓度为0.005、0.01、0.05、0.10、0.50、1.00 mg/mL的系列标准溶液,各取10.0 μL分别加入空白血浆200 μL,混匀,按照“2.6.3”项下血浆样品处理方法处理,即得质量浓度分别为0.05、0.10、0.50、1.00、5.00、10.00 μg/mL的血浆系列标准溶液,取50.00 μL进HPLC检测,以峰面积对浓度进行线性回归。
2.6.5 精密度实验用空白大鼠血浆配制低、中、高3种浓度(0.10、1.00、10.00 μg/mL)的甘草次酸溶液,按“2.6.3”项下血浆样品处理方法处理后进行色谱分析,记录峰面积,根据标准曲线方程计算浓度。1天内测定5次计算日内精密度,每天测定1次连续测5 d,计算日间精密度。
2.6.6 回收率实验分别取9份大鼠空白血浆,每3份为1个剂量组,分别配制低、中、高(0.10、1.00、10.00 μg/mL)3个质量浓度的含药血浆,按“2.6.3”项下血浆样品处理方法处理,记录色谱峰面积A1,同时按相同处理方法测定相同浓度的甘草次酸纳米混悬剂(自制),记录色谱峰面积A2,按A1/A2计算回收率。
2.7 GA-NSPs药动学研究健康雄性SD大鼠20只,180~200 g,随机分成两组。给药前禁食12 h,自由饮水。分别以50.00 mg/kg的剂量ig和尾iv给予GA-NSPs,于给药前和给药后0.08、0.25、0.50、1、2、4、8、12、24、36、48 h经大鼠眼球后静脉丛采血0.50 mL,置于含肝素钠的Eppendorf管中,8 000 r/min离心5 min,取血浆200.00 μL,按照“2.6.3”项下血浆样品处理方法和“2.6.1”项下色谱条件处理,进样50.00 μL,记录峰面积,计算各时间点的血药浓度。Phoenix WinNonlin(version 6.1)药动学软件处理,计算药动学参数。
3 结果 3.1 GA-NSPs的性质将甘草次酸、PEG2000-PCL2000按质量比5:1成功制备了甘草次酸纳米混悬剂。其平均粒径为298.1 nm,PDI值为0.155,电位−12 mV,粒径分布图见图 1。在透射电镜下观察GA-NSPs接近球形,大小均一,分布均匀,分散度较好(图 2)。制备3份GA-NSPs,测定其载药量分别为77.08%、76.68%和78.45%,平均载药量为77.40%。
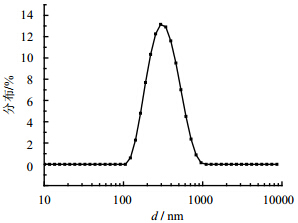 | 图 1 GA-NSPs的粒径分布图Fig. 1 Particle size distribution of GA-NSPs |
 | 图 2 GA-NSPs TEM照片Fig. 2 Transmission electron microscope images of GA-NSPs |
GA-NSPs在生理盐水、pH7.4的PBS、5%葡萄糖溶液和人工胃肠液中孵育5 h粒径变化均在20 nm以内,仍为具有乳光的澄清液体,表现出较好的稳定性,提示制备的GA-NSPs可以满足口服和静脉给药的稳定性要求。GA-NSPs直接冻干后加水不能复溶,而加入4%的麦芽糖做保护剂再冻干,加入去离子水、0.9%氯化钠溶液、5%葡萄糖溶液3种分散介质均能使其完全复溶(即完全分散),复溶后粒径几乎不变。4 ℃条件下放置7 d后粒径无显著变化。
3.2 GA-NSPs体外释放如图 3所示,在有1%胎牛血清存在的条件下,GA-NSPs在6 h时体外累积释放率达到32.11%,至96 h几乎释放完全,达到97.02%。而GA-CS则释放缓慢,24 h的累积释放只有26.91%。相较原药的物理混悬液,纳米混悬剂促进了药物的溶出和释放,这是因为随着粒径的减小,纳米混悬剂的比表面快速增大,药物的表面溶解度、溶出速度和扩散速度都相应增加。
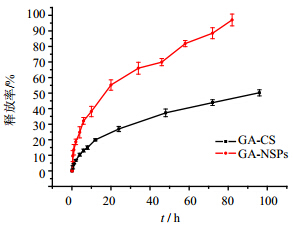 | 图 3 GA-NSPs体外释放Fig. 3 In vitro release profiles of GA-NSPs |
由于甘草次酸的溶解性很差,在纯水或PBS中的释放非常缓慢,加上甘草次酸检测限高,释放外液中药物浓度过低不易准确测量,故在释放介质中加入1%胎牛血清来促进药物的释放。甘草次酸纳米混悬剂在1%的胎牛血清存在下的缓释行为,提示其静脉注射入血后在血液循环中释放慢,利于被动靶向到肝脏而发挥保肝作用。
3.3 甘草次酸含量测定方法学建立空白血浆和含甘草次酸的血浆样品HPLC色谱图见图 4,可知,在项“2.6.1”色谱条件下,血浆中内源性物质不干扰甘草次酸的检测。甘草次酸保留时间为6.7min,峰形良好。
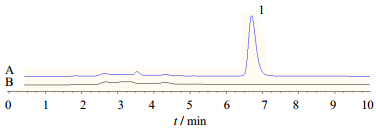 | 图 4 空白血浆(A)及大鼠含药血浆(B)中甘草次酸的HPLC图谱Fig. 4 HPLC of blank plasma (A) and GA in plasma sample of rat (B) |
采用外标法对甘草次酸进行含量测定。甘草次酸在大鼠血浆中标准曲线回归方程为y = 0.000 5 x+ 0.069 1(r=0.999 8),线性范围0.05~10 μg/mL,定量限为0.05 μg/mL。低、中、高3个浓度的提取回收率(n = 5)分别为(116.6±3.8)%、(88.8±1.3)%和(83.0±1.5)%,相应的RSD值分别为3.2%、2.5%和1.8%。日内、日间精密度RSD均小于5%,表明该检测方法的准确度、精密度较高。
3.4 甘草次酸纳米混悬剂药动学研究GA-NSPs ig组与尾iv组在大鼠体内的平均血药浓度-时间曲线见图 5,大鼠体内主要药动学参数见表 1。可以看出GA-NSPs尾iv组血药浓度达峰时间要比ig组快,GA-NSPs尾iv组的Cmax是ig组的8.13倍,GA-NSPs尾iv组的AUC值是ig组的1.28倍。
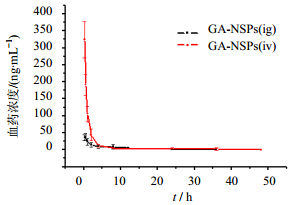 | 图 5 GA-NSPs在大鼠体内的药-时曲线(n=8)Fig. 5 Concentration-time curves of GA-NSPs in rats (n=8) |
| 表 1 GA-NSPs ig和尾iv给药后的药动学参数 Table 1 Pharmacokinetic parameters after iv and ig administration with GA-NSPs |
本研究预试验中曾经尝试过用PLA-PEG、PEG-PLGA、聚山梨酯-80、苄泽78、泊洛沙姆等作稳定剂进行GA-NSPs的制备,但要么无法制备,要么粒径较大,或者只能在药载比较小时才能制备成功。而以PCL-PEG为稳定剂时,制备的纳米混悬剂载药量高(可达到5:1),同时粒径也小,故研究就一直用PCL2000-PEG2000为稳定剂制备。
尝试了不同流动相,如磷酸水、乙酸水[17, 18],最后以乙腈-0.1%磷酸水梯度洗脱,灵敏度高、峰形良好。血浆样品处理方法分别尝试过甲醇沉淀法、乙腈沉淀法、醋酸乙酯萃取法除蛋白,其中以乙腈沉淀法内源性物质干扰少同时回收率也高。该方法在乙腈沉淀后分离上清液,再以氯化钠盐析进一步除去水溶性杂质。加入的50.00 mg氯化钠稍有过量,具体操作时只要混匀即可,氯化钠是否完全溶解不影响血浆处理结果。
由体内药动学初步研究结果可知,GA-NSPs口服吸收比较快,约30 min即可达到血药浓度峰值。这可能由于GA-NSPs粒径小、比表面积大导致药物溶出较快的原因。同时由于肝肠循环的存在,口服吸收的GA-NSPs在约8 h时出现了不太明显的第二个血药浓度峰值。对GA-NSPs来说,本文建立的血样处理方法以及HPLC测定方法检测到的是血浆中游离的甘草次酸和纳米粒中尚未释放的甘草次酸的加和贡献,故Cmax高出口服给药的Cmax很多倍。从其药时曲线推测,GA-NSPs入血后先是快速地向组织器官分布(分布相),然后再缓慢消除(消除相),这一点和口服给药明显不同。
一个奇怪的现象是,同为GA-NSPs,iv给药的AUC仅仅为ig给药的1.28倍。部分原因诚然是因为甘草次酸制备成纳米混悬剂后,吸收加快,生物利用度有所提高,但更重要的原因和纳米粒能改变药物的体内分布有关。即入血的GA-NSPs以更多的比例和更快的速度离开血液,进入到了特定的组织器官。
GA-NSPs平均粒径300 nm,这个尺寸的纳米粒入血后通常会被快速分布到肝、脾等网状内皮系统(RES)丰富的组织器官,尤其是肝脏,类似的情况在文献中也有报道[19]。而ig给药的GA-NSPs则不具备这一特点。所以,尽管iv给药GA-NSPs的AUC较ig给药提高有限,但从对肝脏疾病的治疗目的来看,iv给药GA-NSPs可能会比ig给药有效得多。关于GA-NSPs的组织分布、肝靶向性及对病毒性肝炎的疗效研究正在进行之中。
在已有的关于甘草次酸的纳米给药系统中,如脂质体、固体脂质纳米粒、聚合物纳米粒中,载药量均较有限,药物浓度也很难提高,如iv需要较大体积,应用受到一定的限制。纳米混悬剂是几乎纯药物的纳米粒子,可以达到很高的载药量和药物浓度,尤其是对于剂量较大的中药和天然药物的纳米给药,具有很强的优势。本研究采用的PEG-PCL具有优异的安全性和生物相容性[20],价廉易得,同时超声注入工艺简便,利于工业化生产和临床应用。
| [1] | Chen J, Jiang H, Wu Y. A novel glycyrrhetinic acid-modified oxaliplatin liposome for liver-targeting and in vitro/vivo evaluation[J]. Drug Des Devel Ther, 2015, 9:2265-2275. |
| [2] | 杨锦南,朱明,曹中亮. 甘草次酸及其衍生物药理作用研究进展[J]. 中国药理学通报,1997, 13(2):110-114. |
| [3] | Lin D, Sun W, Wang Z, Chen L G. The effect of glycyrrhetinic acid on pharmacokinetics of cortisone and its metabolite cortisol in rats[J]. J Biomed Biotechnol, 2012(2012):856324. |
| [4] | Hou Y C, Hsiu S L, Ching H. Profound difference of metabolic pharmacokinetics between pure glycyrrhizin and glycyrrhizin in licorice decoction[J]. Life Sci, 2005, 76(10):1167-1176. |
| [5] | Lu Y, Jing J, Ren W. Biliary excretion of glycyrrhetinic acid:glucuronide-conjugate determination following a pharmacokinetic study of rat bile[J]. Phytother Res, 2014, 28(12):1887-1889. |
| [6] | Tian Q, Wang X, Wang W. Understanding the role of the C3-hydroxyl group in glycyrrhetinic acid on liver targeting[J]. J Control Release, 2011, 152(Suppl 1):e237-239. |
| [7] | Wang X F, Zhou Q M, Lu Y Y. Glycyrrhetinic acid potently suppresses breast cancer invasion and metastasis by impairing the p38 MAPK-AP1 signaling axis[J]. Expert Opin Ther Targets, 2015, 19(5):577-587. |
| [8] | 金敏, 吴红金. 甘草次酸药理作用的研究进展[J]. 医学综述, 2009, 15(11):1712. |
| [9] | Zhu J, Chen M, Chen N. Glycyrrhetinic acid induces G1-phase cell cycle arrest in human non-small cell lung cancer cells through endoplasmic reticulum stress pathway[J]. Int J Oncol, 2015, 46(3):981-8. |
| [10] | 黄微, 王平, 王蔚. 甘草次酸修饰PEG-PLGA纳米粒的制备及与肝癌细胞的亲和性[J]. 高等学校化学学报, 2011, 32(2):416-420. |
| [11] | Lallemand B, Ouedraogo M, Wauthoz N. Synthesis and plasma pharmacokinetics in CD-1 mice of a 18β-glycyrrhetinic acid derivative displaying anti-cancer activity[J]. J Pharm Pharmacol, 2013, 65(3):402-410. |
| [12] | Lu Y, Li J, Wang G. In vitro and in vivo evaluation of mPEG-PLA modified liposomes loaded glycyrrhetinic acid[J]. Int J Pharm, 2008, 356(1-2):274-281. |
| [13] | 郭波红, 程怡, 林绿萍. 甘草次酸脂质体的制备及其药剂学性质的研究[J]. 中草药, 2010, 41(3):380-383. |
| [14] | 赵晓娟, 范云鹏,王梦琳. 响应曲面法制备甘草次酸脂质体工艺优化[J]. 南京农业大学学报, 2012, 35(4):99-104. |
| [15] | 王炯, 周小菊, 胡先明. 甘草次酸长循环固体脂质纳米粒的制备与体外性能研究[J]. 中国药房, 2012, 23(15):1364-1367. |
| [16] | 张亚会, 李喜香, 包强, 等. 甘草次酸-壳聚糖纳米粒的制备及其质量评价[J]. 中草药, 2015, 46(15):2232-2237. |
| [17] | Hasler F, Krapf R, Brenneisen R. Determination of 18 beta-glycyrrhetinic acid in biological fluids from humans and rats by solid-phase extraction and high-performance liquid chromatography[J]. J Chromatogr, 1993, 620(1):73-82. |
| [18] | Guo B H, Cheng Y, Wu W. HPLC assay and pharmacokinetics and tissue distribution study of glycyrrhetinic acid liposomes modified with galactosylated lipid[J]. J Liposome Res, 2012, 22(2):120-127. |
| [19] | Guo B H, Cheng Y, Wu W. HPLC assay and pharmacokinetics and tissue distribution study of glycyrrhetinic acid liposomes modified with galactosylated lipid[J]. J Liposome Res, 2012, 22(2):120-127. |
| [20] | Zhong Y, Wang C, Cheng R, et al. cRGD-directed, NIR-responsive and robust AuNR/PEG-PCL hybrid nanoparticles for targeted chemotherapy of glioblastoma in vivo[J]. J Control Release, 2014, 195:63-71. |
 2016, Vol. 39
2016, Vol. 39


