2. 武警后勤学院附属医院, 天津 300162
2. Affiliated Hospital of Armed police Logistics College, Tianjin 300162, China
神经干细胞(neural stem cells,NSCs)是一种特定的干细胞,其基本生物学特性是自我更新能力和向神经细胞多向分化能力,可在多种刺激因素下分化为神经元、星型胶质细胞及少突胶质细胞[1, 2, 3]。根据神经功能受损的恢复机制、神经元的不可再生性、体内内源性神经干细胞数量稀少的原因,当代研究采用干细胞移植治疗以恢复或重建受损的中枢神经系统结构和功能[4]。神经干细胞治疗是一种重要的新型治疗方法,用于治疗神经系统损伤和退行性病变是近期研究热点[5]。本实验简化神经干细胞原代培养的取材及步骤,明确体外定向诱导分化条件,为进一步神经干细胞移植相关实验提供基础条件。
1 材料和方法 1.1 材料 1.1.1 实验动物新生24 h昆明种小鼠由军事医学科学院动物中心提供,动物合格证号:SCXK-(军)2009-003。
1.1.2 主要试剂及耗材DMEM/F12(1:1)培养基(美国Gibco公司),B27复合物(美国Gibco公司),碱性成纤维细胞生长因子bFGF、表皮细胞生长因子EGF(美国Peprotech公司),胎牛血清(FBS)(美国Sigma公司),多聚赖氨酸(美国Sigma公司),PBS溶液(Hyclone公司),0.25% Trypsin/EDTA(Hyclone公司),青霉素-链霉素溶液(Hyclone公司),巢蛋白(nestin)、胶质纤维酸性蛋白(GFAP)、微管相关蛋白2(MAP-2)抗体(美国Millipore公司),FITC山羊抗兔IgG(H+L)抗体、FITC 山羊抗鼠IgG(H+L)抗体(康为世纪公司)。25 cm2细胞培养瓶、24孔板、15 mL离心管(nest公司)。
1.2 方法 1.2.1 神经干细胞分离及培养新生24 h昆明种小鼠断头处死,头部冰冻后PBS溶液中漂洗去血迹,无菌条件下冰上取出双侧大脑,放入盛有PBS溶液培养皿中漂洗,仔细剥离脑膜及血管后将脑组织剪碎至2 mm左右,加入0.25% Trypsin/EDTA 2 mL,37℃消化10 min后用枪头轻柔吹打,加入10% FBS终止消化,200目筛网滤过后成细胞悬液,将细胞悬液1 000 r/min离心5 min,弃上清后加入2 mL PBS清洗细胞,将细胞悬液再次1 000 r/min离心5 min,弃上清,加入神经干细胞完全培养基(DMEM/F12、20 ng/mL bFGF、20 ng/mL EGF、20 ng/mL B27、100 U/mL青霉素、100 μg/mL链霉素),以细胞浓度为2×106/mL接种于25 cm2细胞培养瓶,37℃、5% CO2条件下培养,每2 d补充1次bFGF+EGF,每4 d半量换液,7 d左右传代。
1.2.2 神经干细胞传代培养无菌条件下将细胞悬液转移至离心管中,1 000 r/min离心5 min后弃上清,加入0.05% Trypsin/EDTA复合消化酶 500 μL,37℃消化10 min后用枪头轻柔吹打20次左右,加入2 mL PBS稀释消化酶,1 000 r/min离心5 min后弃上清,加入神经干细胞完全培养基重悬细胞,调整细胞浓度为2×106/mL。
1.2.3 神经干细胞诱导分化事先将24孔板以多聚赖氨酸包被,将细胞浓度调整为1×105/mL接种至24孔板,FBS按0%、1%、3%、5%、7%、10% 6个浓度组,每组4个孔加入并标记,37℃、5% CO2条件下培养2 d后,0%组加入10%FBS,3 h后行免疫荧光法鉴定。
1.2.4 神经干细胞及分化细胞免疫荧光法鉴定:①取出孔板,吸出上清,PBS清洗2次。②4%多聚甲醛固定30 min,后PBS慢速摇床清洗(500 μL/孔×5 min×3次)。③0.1% Triton X-100通透20 min,后PBS慢速摇床清洗(500 μL/孔×5 min×3次)。④用封闭液(PBS含3% BSA)室温封闭1 h,后吸出上清液,给与1:250稀释的一抗(分别包括nestin、GFAP、MAP-2抗体),湿盒中4℃过夜孵育。⑤吸出抗体后 PBS慢速摇床清洗(500 μL/孔×5 min×3次),加入1:80稀释的山羊抗鼠IgG、山羊抗兔IgG的FITC荧光二抗,室温避光孵育1 h。⑥吸出二抗后,避光PBS慢速摇床清洗(500 μL/孔×5 min×3次),加入DAPI进行细胞核染色,室温避光孵育5 min。⑦PBS慢速摇床清洗(500 μL/孔×5 min×3次),加入抗荧光淬灭封片剂,荧光显微镜下观察细胞影像。
2 结果 2.1 神经干细胞原代培养结果分离来自新生24 h小鼠脑组织的细胞培养于无血清神经干细胞完全培养基中(DMEM/F12、20 ng/mL bFGF、20 ng/mL EGF、20 ng/mL B27、100 U/mL青霉素、100 μg/mL链霉素),24 h后可见单个悬浮细胞、不规则悬浮细胞团及部分贴壁细胞(图 1A),2~3 d后可见由不同数目细胞组成的,大小不等的细胞球,形态规则,细胞的折光性强,无突起形成,称之为神经细胞球(neurosphere),呈悬浮生长(图 1B)。7 d后可见大量神经细胞球,部分神经细胞球可见中心变暗并且细胞生长状态不良,如约一半以上神经细胞球出现这种状况需要及时传代,传代使用胰酶消化结合机械吹打的方法,将细胞团吹散为悬浮单细胞,传代48 h后仍可聚集为神经细胞球(图 1)。
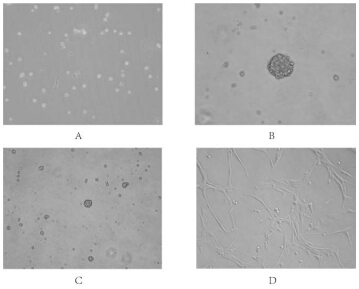 | A-细胞分离培养24 h后;B-细胞培养3 d后;C-细胞传代培养2 d后;D-细胞诱导分化后图 1 培养细胞倒置显微镜观察Fig. 1 Observation of cultured cells under inverted microscope |
神经干细胞接种至24孔板并以此按分组浓度加入FBS,48 h后3%、5%、7%、10% FBS组可见细胞球贴壁并长出突起(图 1),大量细胞迁出神经球并分化,每个浓度组均行nestin、GFAP、MAP-2免疫荧光法鉴定,结果为0%、1%组表达nestin,3%、5%组表达MAP-2,7%、10%组表达GFAP(图 2)。
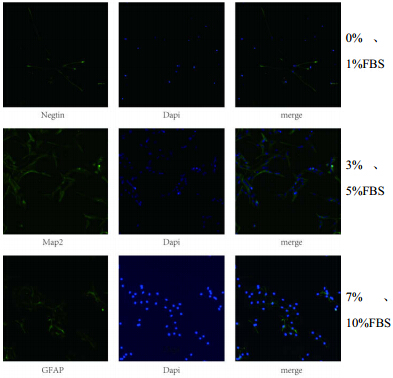 | 图 2 培养细胞及诱导分化细胞鉴定结果Fig. 2 Identification of cultured cells and induced differentiation cells |
神经系统具有组织复杂性和再生困难性,一旦有损伤则形成不可逆性的神经功能破坏,严重影响患者健康及生活[6]。神经系统损伤时会启动自我修复,但成年人内源性NSCs较少,且损伤自我修复多分化为胶质细胞,对促进神经功能恢复的作用有限,在这种情况下,外源性NSCs移植非常重要[7]。神经干细胞移植能通过减轻损伤后的脑水肿、细胞凋亡和炎症反应,以及促进内生性的神经再生等方式刺激其神经功能恢复[8]。
本实验采用新生24 h小鼠,在取材时较胎鼠容易,且全程在冰上进行,可以维持细胞活性,培养基选择DMEM /F12 (1:1),含有丰富营养和维生素,B27、bFGF、EGF可促进细胞有丝分裂及长期生存,添加合适浓度双抗防止细胞污染。因NSCs需一定时间聚集成团,并且细胞受外界温度环境影响较大,所以换液不宜频繁且需半量换液;NSCs传代主要采用胰酶消化或机械吹打方式[9],因神经球结合紧密,单独采用任意一种方法不能使神经球分散,故传代采用胰酶消化结合机械吹打的方式。实验结果可见经此方法培养的NSCs生长状态良好并可连续传代。在诱导NSCs方面采用不同浓度血清诱导,并对诱导后分化细胞行免疫荧光法鉴定,结果表明血清浓度同神经干细胞向星型胶质细胞方向的分化概率呈正相关,免疫荧光法结果表达nestin、GFAP及MAP-2。综上所述,本实验通过改进、优化实验方法,成功体外培养了新生24 h小鼠神经干细胞,并且生长状态和生物学特性良好稳定,为进一步研究神经干细胞移植及临床应用奠定基础。
| [1] | Gage F H. Mammalian neural stem cells[J]. Science, 2000, 287(5457):1433-1438. |
| [2] | Kornack D R, Rakic P. Cell proliferation without neurogenesis in adult primate neocortex[J]. Science, 2001, 294(5549):2127-2130. |
| [3] | Van P H, Schinder A F, Christie B R, et al. Functional neurogenesis in the adult hippocampus[J]. Nature, 2002, 415(6875):1030-1034. |
| [4] | Keep R F, Hua Y, Xi G. Intracerebral haemorrhage:Mechanisms of injury and therapeutic targets[J]. Lancet neurology, 2012, 11:720-731 |
| [5] | Richardson R M, Singh A, Sun D, et al. Stem cell biology in traumatic brain injury:effects of injury and strategies for repair[J]. J Neurosurg, 2010, 112(5):1125-1138. |
| [6] | Andres R H, Guzman R, Ducray A D, et al. Cell replacement therapy for intracerebral hemorrhage[J]. Neurosurgical focus, 2008, 24(3-4):E16. |
| [7] | 秦杰. 诱导多能干细胞来源的神经干细胞移植治疗脑出血的实验研究[D]. 郑州:郑州大学, 2014. |
| [8] | Ding D C, Lin C H, Shyu W C, et al. Neural stem cells and stroke[J]. Cell Transplantation, 2013, 22:619-630. |
| [9] | 胡燕荣, 陈刚, 魏雁, 等. 鼠胚胎神经干细胞的体外培养及诱导分化[J]. 中国组织工程研究与临床康复, 2009, 13(19):3651-3655. |
 2016, Vol. 39
2016, Vol. 39


