2. 天津天士力之骄药业有限公司 天津市中药注射剂安全性评价企业重点实验室, 天津 300402
2. Tianjin Tasly Pride Pharmaceutical Co., Ltd., Tianjin 300402, China
中药是在传统中医药理论指导下应用的药物总称,包括中药材、中药饮片及中药制剂,绝大部分中药都属于天然药物,是世界药物(分为天然药物、化学制品和生物制品)的重要组成部分。随着中药在国际市场的广泛应用,由于其独特的多靶点和整体治疗理念越来越受到青睐。但由于中药产地分散,类同品、代用品不断,加之生长环境、采收期、加工炮制方法不同及制剂生产工艺等因素,造成不同厂家生产的同一品种中药产品及同一厂家不同生产批次产品间,其内在质量即其所含化学成分及临床疗效的差异[1]。有效成分不明,作用机制不清,质量的可控性不够等因素严重制约了中药国际化和现代化的步伐,因此,采用有效合理的方式和技术手段进行中药质量一致性评价,以保证中药产品的安全、有效和质量可控,成为了中药国际化和现代化的重点与难点之一。
中药质量一致性评价可从安全性质量评价和有效性质量评价两个角度进行[2],安全性质量评价主要从如何确保中药的安全性角度出发,如对农药残留、重金属、溶剂残留、微生物限度、黄曲霉素等的监测和控制,上述评价指标均已建立了标准化且得到广泛认可的方法和限度。在中药产品进军国际市场过程中,中药生产企业可以参考人用药物注册技术要求国际协调会(ICH)、美国药典、欧洲药典等相关指南和专论,与相应的质量标准接轨。但是,有效性质量评价,即如何证明中药产品临床疗效的
一致,目前尚无一致的结论。考虑到中药产品的特殊性,借鉴学习化学仿制药与原研药、生物类似物与原研药质量一致性评价方法思路,选择合适的方式评价中药质量一致性,既能确保各项安全性指标符合限度要求,又能确保产品的疗效一致性,从而保证中药产品的安全、有效,成为目前中药行业亟待解决的问题。
1 质量一致性的背景 1.1 化学仿制与原研药质量一致性评价对于化学药品而言,其分子结构清楚,构效关系明确,鉴别、检查、含量测定可以直接作为疗效评价的指标。评价化学仿制药与原研药的质量一致性,只要药学等效性和生物等效性通过验证,就能认为其具有临床疗效的等效性,不需要进行正式的临床有效性和安全性试验,表 1列出了药学等效性和生物学等效性的概念和评价方式[3, 4]。也就是说,在现阶段,仿制药与原研药的质量一致性评价包括3个方面:体外药学一致(即体外多条溶出曲线一致)、体内生物利用度一致(即生物学等效性实验成功)、临床疗效一致。三者关系见图 1。
| 表 1 药学等效性和生物学等效性的概念和技术手段 Table 1 Description and technological means about pharmaceutical equivalence and biological equivalence |
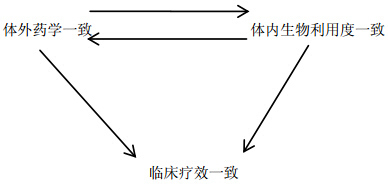 | 图 1 体外药学一致、体内生物利用度一致、临床疗效一致三者关系Fig. 1 Relationship among pharmaceutical consistency,bioavailability consistency,and therapeutic consistency |
国外为了保证仿制药与原研药在安全性、有效性和质量方面的一致性,发布多条指导原则、法规,规范完善仿制药注册审评体系,并对于已上市的仿制药全面开展质量一致性评价工作。1984年美国国会通过的《Hatch Waxman Act》指出,仿制药研发企业可以采取原研药物作为参比制剂,无需重复原研药生产厂家已进行的临床安全性和有效性试验,只需保证二者的药学等效性和生物等效性[6]。
日本于1998年启动了“药品品质再评价工程”,对于已上市的仿制药,评价其安全性和有效性质量一致性,使不同生产厂家生产的仿制药与原研药的临床疗效一致。其评价方法为根据药品的化学性质和剂型的不同,选择不同的一致性评价方法。通常认为,对于口服液体制剂和注射剂,若其药学基础一致,则其疗效和质量会一致,无需再进行体外溶出度研究和人体生物利用度或生物等效性试验;对于口服固体制剂,已上市药品种类繁多、数量巨大,进行生物等效性试验存在时间、经费、人员等方面的困难,国家无法拿出此笔巨资,又无法分摊给企业时,采用简单快捷、科学合理的体外评价手段体外溶出度试验进行质量一致性比对即可[7, 8]。
2012年1月20日,国务院下发的《关于印发国家药品安全“十二五”规划的通知》中要求开展仿制药一致性评价工作,由于一致性评价的对象为已上市药品,对于口服固体制剂主要选择多种介质(溶媒)下的溶出曲线的比较来评价是否与原研药质量一致。
1.2 生物类似物与原创药质量一致性评价生物类似物(biosimilar)是指在质量、安全性和有效性方面与已获准上市的参照药具有相似性的治疗性生物制品。生物类似物具有独特特点:(1)分子特性导致不能采用化学仿制药的生物等效性验证方法,生物制品往往由复杂的蛋白质结构组成,相对分子质量相对庞大、大多具备三维空间结构与较低的稳定性,其分子特性极易受到光、热、温度等环境因素影响。因而在研发过程中,生物类似药的活性成分难以与原研药完全一致,仅能做到高度相似性,不能按照化学仿制药研发中与原研药具有相同化学成分的标准进行研发,目前也没有相应的分析技术能够验证其生物等效性,只有通过临床试验才能验证其等疗效性。(2)采用极为严格精细的药品生产工艺保证最终产品质量属性。在生产方面,与化学药相比,生物药的生产更为精细与复杂,最终产品的属性很大程度取决于生产工艺。为了提高生物制药产品批次间的相似性,所有的生产厂家都必须尽可能的保证生产程序的一致性,进行严格的纯度和活性分析[3, 9]。
2004年,欧盟药品管理局(EMEA)在全球首次起草关于生物类似物指南,并不断更新、完善,其建议生物仿制药在批准进入市场前进行临床前和临床试验,来验证其安全性和有效性,之后还要建立相应的药物监测系统来控制其潜在的免疫原性。
我国于2015年年初出台首版生物类似药研发与评价技术指导原则,全面覆盖了参照药的选择,研发和评价的基本原则,药学研究和评价,非临床研究与评价,临床研究与评价以及药物警戒等多方面内容。
1.3 中药质量一致性评价中药具有多成分、多靶点、多效应的物质内涵与作用特点,其独特的疗效不是一种或一类化学成分的作用,也不是所有有效成分的药效作用的简单加和。中药药效及其毒性的物质基础是中药中组成复杂、相互协同或拮抗的各种化学成分。中药生物效用的发挥及毒性是中药中多组分作用于机体的综合效应。特别是中药复方,是在传统中医药理论“君、臣、佐、使”的指导下按病情需要和药性特点配伍而成,这种配伍将每一味药材视为单一的个体,其药理作用按“性”“味”归结于“寒、热、温、凉;升、降、沉、浮;酸、甘、苦、辛、咸”,而中药复方是多个“个体”的有机组成,各司其职,发挥不可替代的整体作用,这使得中药复方体系具有更加丰富繁杂的特点,如化学组成复杂,药效物质基础不明确等[10]。中药由于其复杂的物质基础和作用机制,目前尚难以通过药学等效性和生物等效性的方法进行质量一致性的评价。
2 中药质量一致性评价模式从临床用药安全来说,药效物质基础一致是指具有临床疗效的中药有效成分一致,是指进入人体药物的物质基础一致[11]。虽然物质基础一致并不能保证药物的有效性一致性,但其是保证临床疗效一致性的基础。鉴于中药的特殊性,采用何种方法对其一致性进行评价,保证质量一致性和有效性一致性,是目前行业内亟须解决的关键问题[12]。
下面简要介绍中国、欧盟、美国等中药质量一致性评价的现状和主要优缺点。
中国的中药和天然药物在美国属于植物药(Botanical drug product)的范畴,在欧盟则被称之为草药(Herbal Medicinal Products)或者传统草药(Traditional Herbal Medicinal Products)。
2.1 中国中药质量一致性评价现状与优缺点[2]中国药典中大部分药材、提取物、制剂其含量测定仅控制了下限,以“不少于…”来表征。而且中国药典中收录的绝大部分制剂品种均为复方,基本上只建立了单一指标性成分的含量测定项。这种评价模式存在较多不足,仅控制中药含量的下限很难保证批间一致性;对于复方制剂仅建立单一指标性成分的含量测定项,难以全面控制中药产品的质量。
2.2 欧盟草药质量一致性评价现状与优缺点[2]欧洲药典收录草药制品均为单味药材的提取物,一般采用对大类组分(如总生物碱、总黄酮等)含量进行含量上下限控制的方式,其优点是可以对含量偏低组分按大类进行控制,增强了质量的可控性,但也存在难以保证含量测定的特异性的不足。而欧盟在复方草药/传统草药质量指南中指出,复方中药若不能对每一活性成分进行含量测定,则应使用综合的方法进行检测,何为综合的方法尚无统一的原则出台。
2.3 美国植物药质量一致性评价现状与优缺点[2]美国食品药品监督管理局(FDA)迄今为止只批准了Veregen和Fulyzaq两例植物药,其中Veregen为单方外用制剂,Fulyzaq为单方口服植物制剂。以Veregen为例,其为绿茶提取物,87.5%~97.5%为已知成分,质量标准中对8个儿茶素类成分进行了单独或加和的控制。对于其他中药而言,很多组分含量很低,甚至与合成或高度纯化的化学药物中的杂质的含量水平相当,对如此低含量的组分进行单独的绝对含量(质量)的控制是不现实的,甚至是不可能的。
对于中医理论指导下的中药,尤其是中药复方制剂,检测任何一种活性成分均不能体现其整体疗效,即通过个别或部分指标性成分的一致性并不等于其制剂的安全性和有效性质量一致性;制剂的安全性和有效性质量一致性并不等于疗效的安全性和有效性,这是中药与化学药品质量标准的根本区别。目前这种质量一致性评价模式既难以有效地监控中药质量,也不能评价中药质量,更难以反映其安全性和有效性[13]
3 中药质量一致性评价技术手段由于中药的特殊性,化学合成药、生物制品质量一致性评价的方法与技术手段并不完全适用于中药质量一致性的评价。基于中药物质基础复杂,且多数中药的化学组成尚未明确的特点,中药指纹图谱从整体的层面综合评价中药内在质量,以保证中药产品的质量一致性;与此同时,生物活性检测方法能够有效评估理化方法无法有效鉴定并具有生物活性的中药,利用药物的特定生物效应,以确定中药的安全性和有效性;近红外光谱分析技术为中药生产过程批次间原料药材差异及制药过程差异引起的质量波动提供了一致性评价的手段。中药指纹图谱、生物活性检测方法、近红外光谱分析技术等多种技术手段的出现与改进,虽然目前尚不能作为标准或统一的途径进行中药质量一致性的评价,但为中药质量一致性的评价提供了切入点。
3.1 指纹图谱中药指纹图谱是基于对中药物质群整体的认识,借助于光谱和色谱等分析技术获得中药化学成分的图谱,是实现鉴别中药真实性、评价质量一致性和产品稳定性的可行模式,具有信息量大、特征性强、整体性和模糊性等特点[14]。指纹图谱包括了对已知成分和未知成分的分析,反映的化学成分信息(具体表现为相对保留时间和相对峰面积)具有高度特异性和选择性,可较充分地反映出中药复杂混合体系中各种化学成分量分布的整体状况,尤其是在现阶段有效成分绝大多数没有明确的情况下,能够结合各种色谱、光谱手段,特征性地鉴定中药的真伪与优劣,成为中药自身的“化学条码”[15]。因此,中药指纹图谱旨在从整体上反映出中药复杂化学成分间的相对关系,与中医药的传统理论“整体性”“模糊性”相适应,能够以现代技术手段科学表征、综合评价及监控有效成分尚不明确或不需完全明确的中药的内在质量。
中药指纹图谱不仅能有效鉴别考察生产原料药材的真伪、不同产地、不同采收时间、不同炮制方法[16],还可通过追踪中药制剂化学成分的变化及产品批次间质量一致性,为中药的质量一致性评价提供有力的评价手段。
目前,中药指纹图谱技术用于草药或中成药的品种和质量的鉴别在国内外已经被广泛认可并成为一种发展趋势。FDA在1996年制定的《关于植物制品的指南(试行)》中,对植物制品及健康补充品和植物药都进行了规范与约束。其中提及到,对植物药品质量控制部分就要求对植物原料材、植物药中间体和植物药的最终产品提供相应指纹图谱。世界卫生组织(WHO)于1996年所公布的关于草药评价的指导原则中规定:如果草药中活性成分无法明确的话,可提供指纹图谱来证明其产品的质量的一致性;FDA于2002年也规定在草药保健品申报时,允许提供色谱指纹图谱的鉴别材料;此外,欧洲共同体关于草药质量指南注释中也提到“草药质量的稳定性若单靠测定一种或者几种已知有效化学成分是不足够的,因草药及制剂是它们整体的作为有效的物质来发挥作用的。因而,可通过色谱指纹图谱等来显示出草药及其制剂中含有的各个成分是稳定的,使其中含量的比例保持恒定;国际上采用指纹图谱来对植物药进行质量控制的还有韩国、日本、德国等国家,利用色谱指纹图谱进行质量控制的技术已经得到了印度草药典、英国草药典、FDA、德国和加拿大药用植物学会等的认可[17]。
中药指纹图谱从所用技术角度不同,可分为3类:化学指纹图谱,包括色谱指纹图谱和光(波)谱指纹图谱;生物指纹图谱;代谢指纹图谱。目前,最常用的是中药化学指纹图谱。色谱指纹图谱在中药领域应用广泛,但指纹图谱的构建需要收集大批量样本的数据,色谱方法耗时较长,工作量较大,光(波)谱指纹图谱由于操作简单、样品处理量大、成本低等特点,不仅能够给出药效物质基础的结构信息,部分信息也可能与特定的化学成分有直接的关联,因此在中药质量一致性评价方面有着很大的应用潜力。各种光(波)谱指纹图谱的应用特点及在中药领域的应用实例见表 2[18, 19, 20, 21, 22, 23]。
| 表 2 光(波)谱指纹图谱的应用特点及在中药领域的应用实例 Table 2 Feature and application case of spectrum fingerprints in CMM field |
克服中药产业技术薄弱造成的出口以原药材和提取物为主,及中成药难以以药品身份进军国际市场的障碍,中药制药工艺应考虑结合指纹图谱技术,全方位立体监控生产原料、中间体和成品,以保证中药产品的质量一致性。
3.2 生物活性检测方法生物活性检测方法(又称生物检定法)是根据药物的生物效应或功能主治,利用整体动物、离体组织、器官、细胞以及微生物和相关生物因子等为实验系统,比较标准品和供试品的特定生物效应,以检测供试品生物活性(含药效和毒性)的一种方法[24]。
生物活性检测方法对于一些有效成分不明确,多组分、结构复杂,理化方法不能有效鉴定并具有生物活性的中药以及有些生物技术药物能很好地评估。生物反应的强度还可以较直观地反映药物总体含量或效价,从而确定它们的质量标准,有效地保证中药的有效性和安全性,有效弥补了化学成分分析法与临床疗效或毒性关联性性小的缺陷,其为中药的有效性一致性评价提供了一个切入口[25]。
王碧松[26]以银杏叶提取物注射液为标准参考物质,建立了舒血宁注射液相对生物效价的测定方法。其对不同生产厂家的多批次舒血宁注射液进行了相对生物效价的测定,将测定结果与舒血宁注射液的现行质量标准和指纹图谱进行相关性分析。结果显示,相对生物效价检测结果可疑的样品,在指标性成分含量测定或安全性检查中大多存在不合格现象;相对生物效价检测结果与标准参考物质相似度好的样品中,在指标性成分含量测定和安全性检查中大多符合规定。张雅铭等[27]使用基于大肠杆菌和金黄色葡萄球菌的明生物热活性特征图谱,关联抑菌活性,作为控制与评价注射用双黄连冻干粉针质量一致性的有效方法。
采用主要基于生物热动力学的多种生物检测方法(含生物效价值和生物热活性特征图谱),为中药的质量一致性评价提供了新的思路与技术参考。
3.3 近红外光谱分析技术中药制剂质量一致性差的部分原因在于制药过程缺乏有效的监测手段,导致中间物料的质量波动,从而最终导致产品批次间质量的差异[28]。因此,采用先进的过程分析与控制技术,对中药生产过程多个关键性环节,如提取、浓缩、醇沉、柱层析等过程的关键质量属性实时在线监控,以保证产品的批间一致性,从而确保产品的安全、有效和质量可控。
美国FDA于2004年发布了《过程分析技术指南》,指南中定义过程分析技术(PAT)为“通过设计、分析和控制生产过程,并通过过程监测原料、中间产品的关键质量属性和性能特征,以确保终产品的质量的体系”并鼓励药企在生产和质量保证中实施PAT[29]。近红外光谱分析技术(NIR)作为PAT的重要工具之一,具有快速、无损、适合在线分析的特点,可快速反馈原料、中间产品及终产品的质量特点,通过即时监测生产中的关键物料质量属性和工艺参数,明确过程参数与产品质控指标间的关系,从而保证生产过程平稳可控,确保终产品质量一致性[30]。
近年来近红外光谱分析技术在我国中药分析方面的应用取得了较快的发展,对上百种中药材的可行性应用研究表明,近红外光谱能够简便、快速、准确地鉴别中药材的种类、产地和真伪,并且能够快速测定中药材中有效成分的含量以及制剂辅料的品质[31]。我国有不少中药企业利用在线近红外光谱分析平台,实时在线监控生产过程的关键环节,如天津天士力现代中药资源有限公司建立了白芍提取过程含量在线近红外检测平台;温州浙康制药科技装备有限公司建立了中药大孔树脂吸附和洗脱过程药液有效成分含量与光谱[32],该技术在中药提取、制剂过程监控中的应用见表 3。近红外光谱分析技术逐渐由小试研究转变为实际生产应用,由基础研究逐步转变为实际应用,实现对中药生产的提取、纯化、浓缩和混合等过程的在线监测,为中药生产过程的质量控制提供有效的分析手段。
| 表 3 在线近红外光谱分析技术在中药生产过程中质量监控应用实例 Table 3 Application cases of in-line near infrared spectroscopy in CMM manufacturing process |
目前,在线近红外光谱分析技术在中药生产过程中的应用研究,主要集中于提取、浓缩、纯化等过程,其趋势为基础向应用的转变,单味药材向中药复方的转变。
4 结语由于中药成分复杂,加上中药制剂客观存在着成分之间、有效成分与分解产物之间的干扰,成分与疗效的对应关系等特殊性,目前尚难以通过化学等效性和生物等效性来进行质量一致性评价,故其质量一致性的评价不能完全套用化学合成药的相关方法。但是,中药与生物制剂存在某种程度的相似性,中药化学成分组成复杂,而生物制剂通常由相对分子质量在一定范围的氨基酸或者多肽组成,且生物制剂的物质内涵与生产工艺密切相关,生产工艺不同,物质内涵就不同,产物的性质和药效就不同,这点二者也极其相似,因此,笔者考虑中药质量一致性评价模式是否可以参考生物制剂的质量评价模式。
此外,必须将新的检测手段和技术应用到中药质量一致性评价中,如近红外光谱分析技术等在线监测中药生产过程,围绕提高中药的质量,从制药工艺品质入手,以量化模型取代传统经验,精准控制工艺参数,显著提升中药各个生产过程单元品质,达到提高药品批间质量一致性的目的,保证制剂产品的安全性和有效性质量一致性[43]。
中药质量一致性的评价,必须结合中药自身的特点,从科学、合理的角度进行。因此,笔者提出了借鉴生物制剂质量一致性评价的理念及合理利用指纹图谱、近红外光谱分析技术等现代技术手段的中药质量一致性评价方法,为中药一致性评价提供参考。
| [1] | 易伦朝, 吴海, 梁逸曾. 色谱指纹图谱与中药质量控制[J]. 色谱, 2008, 26(2):166-171. |
| [2] | 何毅. 中药质量一致性评价模式的建立与应用[D]. 天津:天津大学, 2011. |
| [3] | 蒋舒寒. 欧美生物仿制药的发展现状综述[J]. 中国医药指南, 2010, 8(27):45-48. |
| [4] | 谢沐风. 对""口服固体制剂仿制药质量一致性评价技术手段——多条溶出曲线""的理解[J]. 中国药物评价, 2013, 30(2):65-69. |
| [5] | 张宁, 平其能. 美国仿制药审批管理体系初探[J]. 中国新药与临床杂志, 2010(5):387-393. |
| [6] | 林兰, 牛剑钊, 许明哲,等. 国外仿制药一致性评价比较分析[J]. 中国新药杂志, 2013, 22(21):2470-2474. |
| [7] | 许明哲, 牛剑钊, 陈华, 等. 浅谈仿制药质量一致性评价过程管理的原则及政策依托[J]. 中国新药杂志, 2013, 22(21):2475-2478. |
| [8] | 牛剑钊, 刘佳, 李茂忠, 等. 日本仿制药品质一致性再评价介绍及对我国的启示[J]. 中国药事, 2013, 27(4):429-440. |
| [9] | 陈名, 邵蓉. 生物类似物政策监管指南原则与要求研究综述——基于欧盟版生物类似物指南[J]. 中国卫生政策研究, 2014, 7(10):21-26. |
| [10] | 徐红颖. 板蓝根的指纹图谱研究及其与清肝注射液的相关分析[D]. 长沙:中南大学, 2007. |
| [11] | 刘扬. 中药有效成分分析的新方法新技术研究[D]. 上海:复旦大学, 2012. |
| [12] | 王茹茹, 何祖新. 中药仿制一致性评价的思考[J]. 中国药房, 2014, 25(19):1820-1822. |
| [13] | 肖小河, 金城, 赵中振, 等. 论中药质量控制与评价模式的创新与发展[J]. 中国中药杂志, 2007, 30(17):1377. |
| [14] | 陈林伟, 秦昆明, 徐雪松, 等. 中药指纹图谱数据库的研究现状及展望[J]. 中草药, 2014, 45(21):3041-3047. |
| [15] | 李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药, 2013, 44(22):3095-3104. |
| [16] | Liang Y Z, Yi L Z, Xu Q S. Chemometrics and modernization of traditional Chinesemedicine[J]. Science China (Series B:Chemistry), 2008, 51(8):718-728. |
| [17] | World Health Organization. Guidelines for the assessment of herbal medicines[S]. 1991. |
| [18] | 袁天军, 王元忠, 赵艳丽, 等. 滇龙胆紫外指纹图谱共有峰率和变异峰率双指标序列分析法[J]. 光谱学和光谱分析, 2011, 31(8):2161-2165. |
| [19] | 孙素琴, 汤俊明, 袁子民, 等. 道地山药红外指纹图谱和聚类分析的鉴别研究[J]. 光谱学与光谱分析, 2003, 23(2):258-261. |
| [20] | 雷建刚. 枸杞近红外溯源模型的优化研究[D]. 银川:宁夏大学, 2013. |
| [21] | 王继国, 雍克岚, 陈旭, 等. 基于中药血竭光谱指纹图谱的模式识别研究[J]. 计算机与应用化学, 2005, 22(5):60-64. |
| [22] | 房方, 李祥, 陈建伟, 等. 中药紫石英X-衍射Fourier指纹图谱鉴别研究[J]. 药物分析杂志, 2011, 31(8):1589-1592. |
| [23] | 祁龙凯, 林励, 陈地灵, 等. 荔枝蜜拉曼光谱指纹图谱的研究[J]. 现代食品科技, 2014, 30(3):201-205. |
| [24] | 肖小河, 鄢丹, 王伽伯, 等. 关于中药质量生物检定的几点商榷[J]. 世界科学技术:中医药现代化, 2009, 11(4):504. |
| [25] | 秦谊. 基于生物毒价检测的乌头类""有毒""中药质量评价模式与方法的建立[D]. 昆明:昆明理工大学, 2011. |
| [26] | 王碧松. 生物活性测定法用于活血化瘀类中药注射剂质量控制的研究[D]. 北京:北京中医药大学, 2010. |
| [27] | 张雅铭, 鄢丹, 张萍, 等. 基于化学特征图谱-生物热活性图谱关联检测的注射用双黄冻干粉针质量控制方法的初步研究[J]. 药学学报, 2010, 45(1):93. |
| [28] | 熊皓舒. 中药质量及制药过程质量一致性评价研究[D]. 杭州:浙江大学, 2013. |
| [29] | Jamrógiewicz M. Application of the near-infrared spectroscopy in the pharmaceutical technology[J]. J Pharmac Biomed Anal, 2012, 66:1-10. |
| [30] | De Beer T, Burggraeve A, Fonteyne M, et al. Near infrared and Raman spectroscopy for thein-process monitoring of pharmaceutical production processes[J]. Int J Pharmac, 2011, 417(1):32-47. |
| [31] | 褚小立, 陆婉珍. 近五年我国近红外光谱分析技术研究与应用进展[J]. 光谱学与光谱分析, 2014, 34(10):2595-2605. |
| [32] | 李洋, 吴志生, 潘晓宁, 等. 在线近红外光谱在我国中药研究和生产中应用现状与展望[J]. 光谱学与光谱分析, 2014, 34(10):2632-2638. |
| [33] | 刘全, 瞿海斌, 程翼宇. 用于渗漉提取过程分析的中药有效组分近红外光谱快速测定法[J]. 化工学报, 2003, 54(11):1586-1591. |
| [34] | 陈晨. 近红外光谱技术在复方苦参注射液质量控制中的应用[D]. 杭州:浙江大学, 2012. |
| [35] | 李斌. 近红外光谱技术在中药制药过程在线质量分析中的应用研究[D]. 杭州:浙江大学, 2005. |
| [36] | Li W L, Xing L H. Rapid quantification of phenolic acids in radix Salvia miltiorrhizaextract solutions by FT-NIR spectroscopy in transflectivemode[J]. Pharmac Biomed Anal, 2010, 52(4):425-431. |
| [37] | 柯博克. 近红外光谱在硅胶柱层析过程分析中的应用研究[D]. 杭州:浙江大学, 2006. |
| [38] | 陈雪英. ""血必净""注射液生产过程近红外光谱分析技术的应用研究[D]. 杭州:浙江大学, 2010. |
| [39] | Xiong H S, Gong X C, Qu H B. Monitoring batch-to-batch reproducibility of liquid-liquidextraction process using in-line near-infrared spectroscopy combined with multivariate analysis[J]. J Pharmac Biomed Anal, 2012, 70:178-187. |
| [40] | 徐冰, 史新元, 乔延江. 等. 金银花醇沉多阶段多变量统计过程控制研究. 中华中医药杂志, 2012, 27(4):784-788. |
| [41] | Jin Y, Wu Z Z, Liu X S, et al. Near infrared spectroscopy in combination with chemometrics as a process analytical technology (PAT) tool for on-line quantitative monitoring of alcohol precipitation[J]. J Pharmac Biomed Anal, 2013, 77:32-39. |
| [42] | 瞿海斌, 李斌, 程翼宇, 等. 红参醇提液浓缩过程近红外光谱在线分析方法[J]. 中国中药杂志, 2005, 40(24):1897-1903. |
| [43] | 张伯礼, 程翼宇, 瞿海斌, 等. 中成药二次开发核心技术体系创研及其产业化[J]. 天津中医药, 2015, 32(1):1-3. |
 2016, Vol. 39
2016, Vol. 39


