2. 中国科学院 长春应用化学研究所 长春质谱中心, 吉林 长春 130022
2. Changchun Center of Mass Spectrometry, Changchun institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130022, China
西洋参为五加科人参属植物西洋参Panax quinquefolium L.的干燥根[1]。性寒、味甘、微苦[2],以补益为主,具有滋阴降火的功效[3],现代药理学研究表明西洋参主要具有增强免疫力[4]、提高记忆力[5]、抗肿瘤[6]等作用。西洋参原产于加拿大北部和美国南部[7],其主要有效成分为人参皂苷[8]。随着对西洋参化学成分及药理作用研究的不断深入,西洋参的质量问题越来越受到关注,其质量的优劣主要体现在皂苷单体的种类及含量上,而不同的单体药理作用不同[5, 9],单体皂苷及稀有皂苷的研究对于新药研发及西洋参药理作用的探究具有重要意义。目前分离分析西洋参皂苷的方法主要是紫外分光光度法[10, 11, 12]和高效液相色谱法[13, 14, 15, 16, 17]。本实验应用高效液相色谱法,对不同来源西洋参药材及市售西洋参产品中10种皂苷单体的含量进行测定,并将其中稀有皂苷进行了对比,为西洋参人参皂苷单体的研究和开发提供依据,同时也为西洋参药材的品质评价、临床应用及质量控制提供一定的参考。
1 仪器与材料Agilent Technologies 1200 series高效液相色谱仪;Thermo Scientific Syncronis C18色谱柱(100 mm×2.1 mm,1.7 μm);电子分析天平(赛多利斯科学仪器有限公司);人参皂苷Rg1、人参皂苷Re、人参皂苷Rb2、人参皂苷Rb1、人参皂苷Rc、人参皂苷Rd、人参皂苷R0、人参皂苷F1、人参皂苷F2、人参皂苷Rk1、人参皂苷Rf对照品均购于南京泽朗医药科技有限公司;西洋参药材、饮片及产品为各产地市售,样品具体来源见表 1。乙腈为色谱纯试剂(默克),水为超纯水,其他试剂均为分析纯。
| 表 1 不同来源样品信息 Table 1 Information of samples from different origin |
Thermo Scientific Syncronis C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为乙腈(A)-水(B),二元梯度洗脱(0~10 min,10%~20%B;10~20 min,20%~30% B;20~30 min,30%~38% B;30~40 min,38%~70% B;40~50 min,70%~94% B;50~60 min,94%~96% B;60~70 min,96%~100% B;体积流量为0.2 mL/min,检测波长为203 nm,柱温为35 ℃,进样量为5 μL。液相色谱图见图 1。
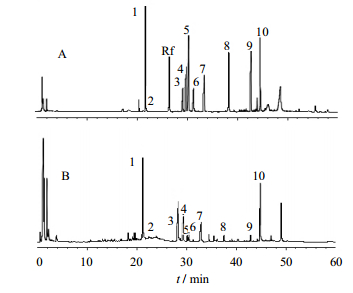 | 1~10分别为人参皂苷Re;Rg1;Rb1;Rc;Rb2;Rd;F1;R0;F2;Rk1 图 1 混合对照品A和西洋参B高效液相色谱图 Fig. 1 HPLCof reference solution (A) andP. quinquefolium extracts (B) |
精密称取人参皂苷Rg1、Rf、Rb2、Rd、F2、Rk1、R0、Rb1、Rc、Re、F1各1 mg分别定容至1 mL,制成质量浓度为1 mg/mL溶液备用。
2.3 供试品溶液制备取样品粉末(过三号筛)约1 g,精密称定,置索氏提取器中,加入石油醚2.5个虹吸量,脱脂2 h,甲醇浸泡过夜,连续回流提取3次,每次2 h,水饱和正丁醇萃取4次,合并正丁醇层,减压浓缩,蒸干,色谱甲醇定容至5 mL,过0.22 μm微孔滤膜,待测。
2.4 线性关系考察制备混合对照溶液含人参皂苷Rg1、Rb2、Rd、Rb1、Rc、Re为0.1 mg/mL,人参皂苷Rf、F1为0.5 mg/mL,人参皂苷F2、Rk1、R0为1 mg/mL。分别精密吸取混合对照品溶液2、4、6、8、10、12 μL,稀释成不同浓度梯度,按“2.1”项色谱条件测定,以峰面积为纵坐标,对照品量为横坐标,进行线性回归,得回归方程及相关系数见表 2。
| 表 2 人参皂苷的线性回归方程及其相关系数 Table 2 Linear regression equations and correlation coefficients of ginsenosides |
精密吸取同一混合对照品溶液5 μL,重复进样5次,重复进样5次,计算各色谱峰峰面积值的RSD,结果人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd、F1、R0、F2、Rk1峰面积的RSD分别为0.61%、1.15%、0.32%、1.51%、1.17%、0.89%、0.66%、1.50%、1.07%、1.41%,表明仪器精密度良好。
2.6 稳定性实验分别精密吸取同一供试品溶液(吉林大药房)5 μL,分别于0、8、16、24、32、48 h进样,测定峰面积,结果人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd、F1、R0、F2、Rk1峰面积的RSD分别为2.52%、2.23%、2.32%、4.25%、4.73%、0.50%、2.29%、3.06%、0.89%、0.66%,表明样品在48 h内稳定性良好。
2.7 重复性试验取同一供试品(吉林大药房)5份,分别按照“2.3”项下方法制备供试品溶液,并按照上述色谱条件进行测定。结果样品中人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd、F1、R0、F2、Rk1,RSD分别为2.38%、2.40%、2.67%、3.09%、1.50%、2.98%、2.55%、2.87%、3.15%、1.07%,表明该方法重复性良好。
2.8 加样回收率测定精密称取6份已知含量的同一西洋参样品(吉林大药房)1.0 g,分别精密加“2.2”项下混合对照溶液0.6、0.8、1.0 mL,加入甲醇定容。按照“2.3”项下色谱条件进样分析,结果人参皂苷Re、Rg1、Rb1、Rc、Rb2、Rd、F1、R0、F2、Rk1的平均回收率分别为97.45%、98.21%、96.06%、97.63%、101.80%、96.45%、97.55%、98.07%、101.2%、99.03%,RSD分别为2.15%、2.18%、2.19%、2.15%、2.21%、2.10%、2.09%、2.17%、2.19%、2.56%。
2.9 含量测定取表 1中12个不同来源的样品,按“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件,依法测定,结果见表 3。
| 表 3 不同来源西洋参样品中皂苷单体含量测定结果 Table 3 Contents of ginsenosides in P. quinquefoliumfromdifferent origins |
西洋参的质量评价主要根据所含的皂苷种类及含量,利用含量较少但具有高效的生物活性[18, 19]的稀有皂苷的种类,对西洋参进行鉴别及质量评价更具有应用价值,本实验测定了10批不同来源西洋参样品中皂苷单体的含量,实验表明仅西洋参饮片(中国吉林长白山人参基地)样品不含有人参皂苷F1,说明样品所含皂苷的种类差异不大。据文献报道,西洋参中的伪人参皂苷F11为其特有成分,可用于鉴别西洋参,由于伪人参皂苷F11没有紫外吸收[20, 21],因此本方法不能对其进行含量测定,徐静等[22]认为人参皂苷Rf可用于识别西洋参,并排除掺假,因此本实验通过人参皂苷Rf标准品与样品的HPLC谱图进行比较,确定了所测西洋参样品中均不含有人参皂苷Rf,对西洋参的真伪进行了鉴别。由于我国西洋参均为人工栽培,其质量受产地和生态环境影响较大[23, 24]。因此不同产地样品含有的皂苷含量存在差异。美国药典西洋参和人参提取物的专论[25]对使用高效液相色谱-紫外法测定样品中皂苷含量,规定西洋参根中人参皂苷的量不低于4%。通过HPLC实验结果比较,表明西洋参饮片(福百草大药房),西洋参须(吉林省靖宇县)中含有的皂苷成分含量大于4%,符合质量标准。对于单体皂苷含量,西洋参(吉林亚泰明星制药有限公司)中人参皂苷Re、Rg1、Rb1、R0含量较高,西洋参(吉林大药房)含有人参皂苷Rc量较高,西洋参须根(吉林省靖宇镇)含有人参皂苷Rb2、Rd、F1、F2含量高于其他样品,西洋参(吉林省抚松县)含有人参皂苷Rk1成分较多,实验结果比较表明不同来源的西洋参中皂苷成分的含量差异较大。该方法用于测定西洋参中人参皂苷含量,准确性高、灵敏度高、重复性好,可用于评价不同来源的西洋参药材的品质。
| [1] | 中国药典 [S].一部. 2010. |
| [2] | 刘伟灿,张美萍,李超生,等.西洋参各部位皂苷成分的HPLC测定 [J].人参研究, 2010, 22(1): 20-23. |
| [3] | 孟凡征,李柏.西洋参 [M].北京:北京科学技术出版社, 2003: 97. |
| [4] | 赵珺彦,周大兴,翟鹏贵.西洋参提取物增强免疫力作用的实验研究 [J].浙江中医药大学学报, 2011, 35(5): 755-757. |
| [5] | 马宝兰,秦绪花,史载祥.西洋参临床药理研究进展 (2004-2010) [J].江西中医学院学报, 2011, 23(5): 88-92. |
| [6] | 王炜明,赵东娇.西洋参中有效成分及其抗肿瘤关系的研究进展 [J].中国民族民间医药杂志, 2013, 22(10): 43-44. |
| [7] | 赵树清,载新荣.西洋参研究进展 [J].广东药学, 2005, 15(6): 63-65. |
| [8] | 曹敏.概述西洋参化学成分研究的近况 [J].江苏药学与临床研究, 2004, 12(2): 25-26. |
| [9] | 刘艳红.西洋参化学成分和药理作用研究进展 [J].医学信息, 2013, 26(20): 663-664. |
| [10] | 苏本正,都波,石典花.蒸发光散射检测器与紫外检测器用于人参中皂苷类成分检测的比较研究 [J].齐鲁药事, 2013, 32(6): 333-335. |
| [11] | 韩婧,冯丽君,闫磊,等.西洋参总皂苷的分离纯化工艺 [J].中国实验方剂学杂志, 2012, 18(10): 66-68. |
| [12] | 许传莲,郭若薇,郑友兰.不同年生西洋参中皂甙的比较研究 [J].吉林农业大学学报, 1991, 13(2): 88-89. |
| [13] | 王桂英. HPLC法测定西洋参中五种皂苷方法研究 [J].光明中医, 2014, 29(4): 890-893. |
| [14] | 李岚,陈华. HPLC法测定不同产地西洋参中人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1含量 [J].中国医药导报, 2011, 8(20): 103-105. |
| [15] | 陈孔荣,潘爱娟,李兆翌. RP-HPLC法测定威斯康辛州产西洋参中人参皂苷Rg1、Rb1的含量 [J].浙江中医药大学学报, 2011, 35(3): 410-412. |
| [16] | Zhang K, Wang X, Ding L, et al. Determination of seven major ginsenosides in different parts of Panax quinquefolius L. (American Ginseng) with different ages[J]. Chem Res Chinese Universes, 2008, 24(6): 707-711. |
| [17] | Lang W S, Lou Z C, But P P H. High-performance liquid chromatographical analysis of ginsenosides in Panax ginseng P. quinquefolium and P. notoginseng [J]. J Chin Pharm Sci, 1993, 2(2): 133-142. |
| [18] | Kim S, Lee Y, Park J, et al. Ginsenoside Rs4a new type of ginseng saponin concurrently induces apoptosis and selectively elevates protein levels of p 53 and p 21 WAF1 in human hepotoma SK-HEP-1 cells [J]. Eur J Cancer, 1999, 35(4): 507-511. |
| [19] | 马晓宁,柴瑞华,赵余庆.西洋参茎叶皂苷水解产物中稀有抗肿瘤成分的化学研究 [J].中草药, 2008, 39(9): 1291-1294. |
| [20] | 黄艳菲,刘永恒,李艳丹,等. HPLC-MSn法测定加拿大原产地西洋参不同入药部位的人参皂苷含量 [J].中国实验方剂学杂志, 2013, 19(11): 86-91. |
| [21] | 郑晓晖,赵新锋,胡震,等.液相色谱-离子阱质谱联用法建立留坝西洋参药材特征图谱研究 [J].中草药, 2005, 36(1): 104-106. |
| [22] | 徐静,贾力,赵余庆.人参的化学成分与人参产品的质量评价 [J].药物评价研究, 2011, 34(3): 199-203. |
| [23] | 许云章,任烨,王静霞,等.响应面法优化加拿大原产地西洋参皂苷的提取工艺研究 [J].现代食品科技, 2013, 29(5): 1040-1044. |
| [24] | 陈军辉,谢明勇,章志明,等. 12种西洋参中总皂苷及人参皂苷Rb1的测定比较 [J].时珍国医国药, 2005, 16(9): 845-847. |
| [25] | United States Pharmacopeial Convention Inc [S]. 2004. |
 2015, Vol. 38
2015, Vol. 38


