2. 上海中医药大学, 上海 201203
2. Shanghai University of TCM, Shanghai 201203, China
纤维化是各种慢性肝病的共同病理过程,是肝脏组织对各种病因所导致的病理损伤的一种修复反应,持续或者反复的肝实质炎症坏死可引起肝脏内肝星状细胞、间充质干细胞等多种细胞转分化为肌成纤维细胞,该细胞增殖并大量合成和分泌细胞外基质,从而导致纤维化的发生,是肝纤维化发生发展的核心细胞[1]。成纤维细胞激活蛋白(fibroblast activation protein,FAP)可表达于成纤维细胞,与成纤维细胞生长以及胚胎发育、组织修复和上皮肿瘤的演进过程密切相关[2],已有研究显示,该蛋白参与肝纤维化的形成[3],本文观察大鼠肝纤维化形成过程中FAP的动态表达变化,从而进一步阐释该蛋白与肝纤维化的关系。
1 材料与方法 1.1 实验动物Wistar雄性大鼠24只,体质量(190±9)g,SPF级,购自上海斯莱克实验动物有限公司,合格证号为SCXK(沪)2007-0005,饲养于上海中医药大学实验动物中心SPF级动物房饲养、造模与观察,自由饮水。
1.2 主要试剂和仪器二甲基亚硝胺(dimethylnitrosamine, DMN),Cat.No.MAL05,为东京化成工业株式会社产品。生化检测试剂盒,上海科华生物产品;预染蛋白标准品为Fermentas公司产品成;cDNA合成试剂盒购自Fermentas公司;PCR特异性引物由上海生工公司合成;Realtime PCR Master Mix试剂盒为TAKARA公司产品;小鼠抗FAP单克隆抗体为美国ABGENT公司产品;单克隆小鼠抗GAPDH抗体购自康成公司;驴抗小鼠红外荧光二抗为Li-Cor公司产品。BCA蛋白定量试剂盒,碧云天生物技术公司产品。二甲苯、甲醛、无水乙醇(分析纯)和中性树胶均购自中国医药集团上海化学试剂公司。苏木素伊红染料、羟脯氨酸测定试剂盒均购自南京建成生物制品研究所。
全自动生化仪AU2700,为Beckman Coulter公司产品。轮转切片机、冰冻切片机、自动脱水机、石蜡包埋机,购自德国Leica公司。Olympus BX40光学显微镜,日本Olympus公司产品;连续波长酶标仪,美国Bio-Tek公司产品;实时定量PCR仪,Eppendorf公司产品;蛋白电泳系统,Bio-Rad公司产品,Odyssey红外扫描系统,为Licor公司产品。
1.3 造模及标本采集大鼠适应性饲养1周后,采用分层随机方法分为正常组8只,模型组16只。模型组ip 0.5% DMN 2 mL/kg,首次注射全剂量的2/3,每天1次,连续注射3 d后休息4 d,共4周。对照组大鼠于相同的时间和部位ip等剂量的生理盐水注射液。于造模1、2、3周末,每次处死3只大鼠,留取肝组织标本,保存于−80℃冰箱备用。至4周末,大鼠禁食12 h后,以20%乌拉坦麻醉,下腔静脉采血,4 ℃下静置2 h后,3 000 r/min离心15 min,取上清分装于1.5 mL离心管,−70℃低温保存用于生化检测。动物取血处死后,取下肝脏和脾脏称质量,然后取约1.0 cm×0.8 cm×0.3 cm大小肝组织2块,于10%中性甲醛溶液中固定,用于组织形态学观察。−80℃保留2管肝组织用于羟脯氨酸测定和肝组织FAP基因和蛋白表达检测。
1.4 肝纤维化相关指标检测全自动生化仪检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、谷氨酰转肽酶(GGT)和白蛋白(ALB)。羟脯氨酸含量测定采用南京建成生物技术公司试剂盒测定,操作步骤参照说明书进行。
中性甲醛溶液固定的肝脏组织修整后于脱水机中逐级脱水,后于自动石蜡包埋机中石蜡包埋,4 ℃保存。切片厚度为4 μm。进行常规HE染色和天狼猩红染色,观察肝组织病理和胶原沉积情况。参照文献《胶原纤维增生程度的半定量标准》评判纤维化分级。
1.5 Western blotting检测肝组织FAP蛋白表达取湿肝100 mg在预冷生理盐水中洗净,RIPA裂解液抽提组织总蛋白,使用BCA蛋白定量试剂盒,在562 nm波长处测定细胞总蛋白浓度。40 μg蛋白经10%聚丙烯酰胺凝胶电泳后,将凝胶中蛋白电转移至硝酸纤维素膜上,以LICOR公司封闭液封闭后,加入Ⅰ抗[GAPDH抗体(1︰10 000)、FAP抗体(1︰1 000)] 4 ℃孵育过夜,洗涤后加入荧光标记Ⅱ抗,室温孵育1 h后,回收Ⅱ抗,膜洗涤后,于Odyssey扫描蛋白条带。目标条带使用图像分析软件进行分析,目标蛋白表达量使用GAPDH进行校正。
1.6 real-time PCR检测肝组织FAP基因表达试剂盒抽提细胞总RNA。在使用紫外分光光度计在260/280 nm处检测总RNA的质量和纯度之后,使用cDNA合成试剂盒逆转录为cDNA。以该cDNA为模板,FAP(126bp)上游引物为5'-TGTCCTGAAATCCAGTTTGG-3,下游引物为5'-GTGCATTGTCTTACGCCCTT-3';GAPDH(70 bp)上游引物为5'-GGCAAATTCAACGGCACA GT-3',下游引物为5'-AGATGG TGATGG GCTTCCC-3'。进行PCR扩增,PCR扩增反应条件为95 ℃预变性5 min,95 ℃ 30 s、60 ℃ 60 s,共40个循环。以22-ΔΔCT方法分析目的基因相对表达量。
1.7 统计方法数据采用$\bar x \pm s$表示,采用SPSS 11.0统计软件进行统计,组间比较采用t检验ANOVA,等级资料采用Ridit检验。
2 结果 2.1 大体情况随着造模时间延长,模型组大鼠体质量增加明显低于对照组,模型组大鼠毛色枯黄,运动减少,精神较差。4周结束时无大鼠死亡,部分模型组大鼠明显可见腹部膨大,有腹水形成,肝脏缩小,质地变硬。表 1可见,与对照组比较,模型组大鼠体质量、肝质量及肝体比明显下降,脾质量和脾体比有所增加。
| 表 1 两组大鼠体质量、肝质量、脾质量比较($\bar x \pm s$) Table 1 Comparison on body mass, liver quality, and spleen quality of rats in two groups($\bar x \pm s$) |
经DMN干预后,模型组大鼠血清TBIL、ALT、AST、GGT水平明显升高(P<0.05),ALB水平明显下降(P<0.05)。(见表 2)。
| 表 2 两组大鼠血清生化学指标比较($\bar x \pm s$) Table 2Comparison on serum biochemical index of rats in two groups ($\bar x \pm s$) |
HE染色可见,正常对照组肝小叶结构清晰,肝细胞由中央静脉向四周呈放射状排列,无变性坏死,肝窦未见狭窄或扩张;模型组大鼠肝脏内有大量炎性细胞浸润,肝窦狭窄,汇管区扩大,肝细胞排列紊乱,出现肿胀、变性坏死,肝组织内有明显出血现象(图 1)。
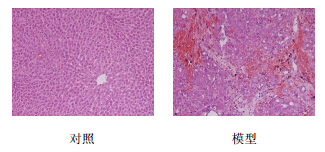 | 图 1 两组大鼠肝组织HE染色Fig. 1 HE Staining of liver tissue of rats in two groups |
肝组织天狼猩红染色可见对照组仅在汇管区和中央静脉壁见少量胶原纤维;模型组大鼠肝脏胶原增生明显,大量的纤维间隔,向肝小叶伸展,分割 包绕肝组织,形成假小叶(图 2)。肝纤维化分级、肝组织羟脯氨酸含量测定均显示模型组较对照组大鼠胶原沉积明显升高(表 3)。
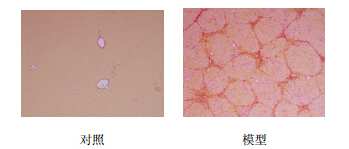 | 图 2 两组大鼠肝组织天狼猩红染色Fig. 2 Sirius red staining of liver tissue of rats in two groups |
| 表 3 两组肝纤维化分级和羟脯氨酸含量($\bar x \pm s$) Table 3 Liver fibrosis and hydroxyproline content in two groups($\bar x \pm s$) |
收集造模1~4周的大鼠肝组织,抽提总RNA和总蛋白,采用实时定量PCR和western blotting分别检测FAP基因和蛋白表达水平,结果见图 3,随造模时间的延长,FAP mRNA和蛋白表达水平逐渐增加,提示FAP参与了大鼠肝纤维化的形成过程。
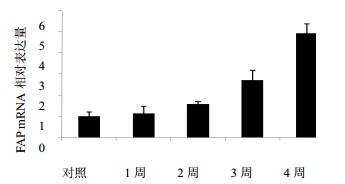 | 图 3 肝组织FAP mRNA表达变化Fig. 3 FAP mRNA expression changes in liver tissues |
FAP是一种膜结合糖蛋白,属于丝氨酸蛋白酶类,由FAP α和β两个亚单位组成相对分子质量为170 000的二聚体[2],具有肽链内切酶活性和较弱的二肽酶活性,能够降解许多二肽和Ⅰ型胶原,研究表明,FAP可表达于胚胎细胞、损伤组织以及90%以上恶性上皮肿瘤的基质成纤维细胞,而很少表达于良性肿瘤和正常组织,与细胞外基质重构,肿瘤增生和新陈代谢密切相关[4, 5]。
FAP作为一个增生性成纤维细胞的表面标志物,在控制成纤维细胞生长及胚胎发育、组织修复起一定的作用[6]。肝纤维化的核心环节是成纤维细胞的大量活化和增殖,因此,FAP与肝纤维化的形成引起了研究者的兴趣。Levy等[7]的研究发现,FAP特异基因可在肝硬化患者肝脏中检测到,而不表达于正常人肝组织,其免疫活性主要集中于肝硬化肝组织的新生结节内的窦周细胞,通过细胞形态学和体外研究显示,FAP蛋白主要表达于肝星状细胞。田华等[8]复制四氯化碳诱导的小鼠肝纤维化模型,发现FAP主要表达于门管区内脉管周围及小叶周围纤维间隔成纤维细胞中。并且随着肝纤维化加重,纤维间隔加宽,表达FAP的细胞也增加,即FAP与小鼠肝纤维化程度呈正相关,并且其表达水平和肝组织转化生长因子β1(TGF-β1)表达水平呈正相关,提示FAP和TGF-β1可能在肝纤维化形成过程中起协同作用。
DMN是具有肝毒性、基因毒性、免疫毒性的化学物质,早在20世纪80年代末、90年代初即被广泛应用于抗肝纤维化的实验研究,本研究以DMN为诱导剂,经组织形态学和羟脯氨酸检测鉴定,成功复制了大鼠肝纤维化模型,收集了造模1~4周的肝组织,经实时定量PCR和western blotting检测,发现FAP的基因和蛋白均随着造模时间的延长表达逐渐增加,与肝纤维化的发展进程一致。在大鼠肝纤维化模型上再一次验证了FAP和肝纤维化发生发展的关系。提示FAP有望作为肝纤维化的新的治疗靶点,有必要进行更为深入的研究。
| [1] | Friedman S L. Liver fibrosis: from mechanisms to treatment [J]. Gastroenterol Clin Biol, 2007, 31(10): 812-814. |
| [2] | Chung K M, Hsu S C, Chu Y R, et al. Fibroblast activation protein (FAP) is essential for the migration of bone marrow mesenchymal stem cells through RhoA activation [J]. PLoS One, 2014, 9(2): e88772. |
| [3] | Wang X M, Yao T W, Nadvi N A, et al. Fibroblast activation protein and chronic liver disease [J]. Front Biosci, 2008, 13: 3168-3180. |
| [4] | Aertgeerts K, Levin I, Shi L, et al. Structural and kinetic analysis of the substrate specificity of human fibroblast activation protein alpha [J]. J Biol Chem, 2005, 280(20): 19441-19444. |
| [5] | Huber M A, Kraut N, Park J E, et al. Fibroblast activation protein: differential expression and serine protease activity in reactive stromal fibroblasts of melanocytic skin tumors [J]. J Invest Dermatol, 2003, 120(2): 182-188. |
| [6] | Lessard J, Pelletier M, Biertho L, et al. Characterization of dedifferentiating human mature adipocytes from the visceral and subcutaneous fat compartments: fibroblast-activation protein alpha and dipeptidyl peptidase 4 as major components of matrix remodeling [J]. PLoS One, 2015, 10(3): e0122065. |
| [7] | Levy M T, McCaughan G W, Abbott C A, et al. Fibroblast activation protein: a cell surface dipeptidyl peptidase and gelatinase expressed by stellate cells at the tissue remodelling interface in human cirrhosis [J]. Hepatology, 1999, 29(6): 1768-1778. |
| [8] | 田华, 黄仁鹏, 靳占峰, 等. 成纤维细胞激活蛋白和转化生长因子-β1在小鼠肝纤维化组织中的表达及相关性 [J]. 肝脏, 2009, (06): 454-457. |
| [9] | 金树根, 王灵台, 任家潍, 等. 二甲基亚硝胺致大鼠肝纤维化的造模研究 [J]. 中西医结合肝病杂志, 1994, 4(1): 28-30 |
 2015, Vol. 38
2015, Vol. 38


