2. 河南中医学院第一附属医院, 河南 郑州 450000;
3. 济源市农业科学院, 河南 济源 459002
2. The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China;
3. Jiyuan Academy of Agricultural Sciences, Jiyuan 459002, China
地黄Rehmannia glutinosa Libosch.为玄参科地黄属植物,其块根为常用中药地黄,为我国四大怀药之一。地黄在我国具有悠久的药用历史,始载于《神农本草经》,列为上品,具有清热养血、养阴生津等功效。地黄悠久的历史和显著的滋补作用使其历史沿革相当丰富,地黄在临床应用上分别出现了鲜地黄、生地黄、熟地黄、生地炭、熟地炭等炮制品,并且许多经方中都用到地黄。近年来,随着研究的不断深入,不但对生地黄的块根进行了化学成分研究[1],同时对其地上部分地黄叶也进行了研究,从中分离得到了大量的化合物,尤其是环烯醚萜类成分,为阐明地黄的药效物质基础提供了科学依据。并且也把地黄叶开发成了中药新药,避免了中药资源的浪费。因此,本文对近5年来有关地黄的化学成分及其药理作用研究进行分类汇总,为下一步研究奠定基础。
1 化学成分地黄中主要含有环烯醚萜类、紫罗兰酮类、苯乙醇苷类、糖类等化合物,环稀醚萜基本骨架主要有7与8位环氧或双键,4、6和10位多取代,8与10位双键等类型,尤以益母草苷为母体者居多,所含配基以葡萄糖居多,糖的数量一般为3个以内;紫罗兰酮类以单萜和倍半萜为主,以1位双甲基取代,5与6位双键为特征,5位可与糖成苷,偶有与环稀醚萜聚合。
1.1 单萜类1.1.1 环烯醚萜及其苷类 从生地黄块根中分离得到11个新的环烯醚萜苷类成分地黄新苷A~E及J~K(rehmaglutosides A~E,J~K,1~7),同时分离得到20个已知环烯醚萜类成分,分别为:桃叶珊瑚苷(8)、myobontioside A(9)、梓醇(10)、益母草苷A(ajugol,11)、京尼平苷(12)、6-O-E-阿魏酰基筋骨草醇(6-O-E-feruloyl ajugol,13)、8-表番木鳖碱(14)、栀子新苷甲酯(gardoside methyl ester,15)、京尼平苷酸(16)、6-O-对-羟基苯甲酰基筋骨草醇(17)、香草酰基筋骨草醇(18)、焦地黄苷B(jioglutoside B,19)、8-表-马钱子苷酸(20)、6-O-E-咖啡酰基筋骨草醇(21)、6-O-(4″-O-α-L-吡喃鼠李糖基)香草酰益母草苷A(22)、monomellittoside(23)、6-O-sec-hydroxyae ginetoyl ajugol(24)、mussaenosidic acid(25)、3′-O-β-D- glucopyranosyl catalpol(26)、栀子苷元-1-O-α-L-吡喃鼠李糖基-(1→6)-β-D-吡喃葡萄糖苷(27)、5-deoxyantir-rhinoside(28)、5-deoxylamiol(29)、去乙酰野芝麻苷(30)、栀子新苷(31)、genipin-gentiobioside(32)、genameside C(33)、6β- hydroxy-2-oxabicyclo [4.3.0] Δ8−9-nonen-1-one(34)、焦地黄素D(35)、焦地黄素E(36)、地黄苷C(rehmaionoside C,37 )、地黄苷A(38)[2, 3, 4, 5]。从地黄叶的50%含水丙酮组织破碎提取物中分离出化合物10、11、14[5]。部分新化合物结构见图 1。
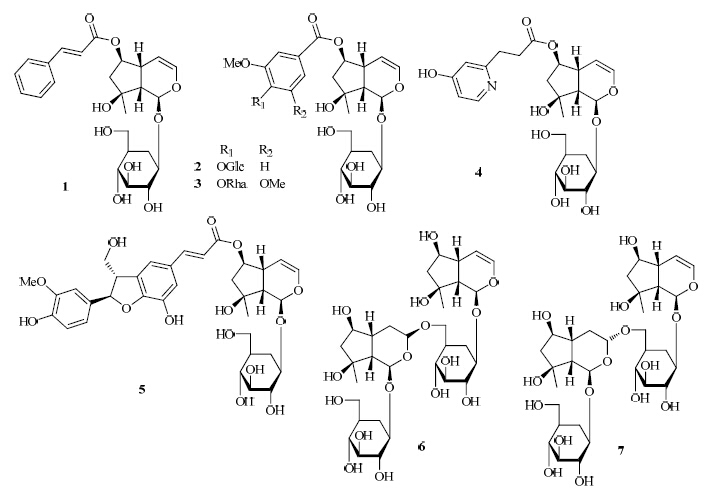 | 图 1 地黄中新的环烯醚萜苷类化合物结构Fig. 1New structures of iridoid glycosides compounds in R. glutinosa |
从地黄的块根中分离得到8个新的紫罗兰型单萜及其苷类frehmaglutin A~D(39~42)、neo-rehmannioside(43)、rehmamegastig- mane(44)、rehmapicrogenin A(45)、aeginetic acid 5-O-β-D-quinovoside(46),同时分离得到aeginetic acid(47)、dihydroxy-β-ionone(48)、rehmapicrogenin(49)、trihydroxy-bionone(50)、sec-hydroxyaeginetic acid(51)、rehmaionoside C(52)、oxyrehmaionoside B(53)、dihydrophaseic acid 4-O-β-D-glucopy- ranoside(54)[6, 7, 8, 9]。新化合物结构见图 2。
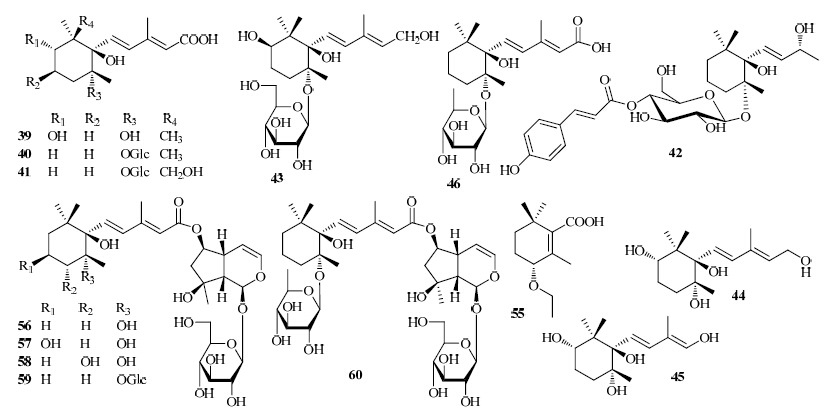 | 图 2 地黄中新的紫罗兰型单萜和其他类单萜化合物结构Fig. 2New structures of ionone and other monoterpenoids in R. glutinosa |
从地黄的块根中分离得到1个新单萜类成分frehmaglutin E(55),5个紫罗兰型单萜与环烯醚萜复合体地黄新苷F~I(rehmaglutosides F~I,56~59)和aeginetoyl ajugol 5″-O-β-D-quinovoside(60),同时分离得到3个已知单萜类成分地黄苦苷(rehmapicroside,61)、rehmapicrogenin(62)、3-methoxy-2,6,6-trimethyl cyclohex-1-enecarboxylic acid(63)[7]。部分新化合物结构见图 2。
1.2 苯乙醇及其苷类从地黄块根乙醇提取物中分离得到11个化合物,分别鉴定为地黄苷(martynoside,64)、sculponiside(65)、2-phenylethyl-O-β-D-xylopy- ranosyl-(1→6)-β-D-glucopyranoside(66)、毛蕊花糖苷(67)、红景天苷(salidroside,68)、leucosceptoside A(69)、焦地黄苯乙醇苷D(70)、deacyl-martynoside(71)、焦地黄苯乙醇苷A1(72)、焦地黄苯乙醇苷B1(jionoside B1,73)、3,4-dihydroxy-β-phenethyl- O-α-Lrhamnopyranosyl-(1→3)-O-β-D-galacopyranosyl-(1→6)-4-O-caffeoyl-β-D-glucopyranoside(74)、天人草苷A(leucosceptoside A,75)、异地黄苷(isomartynoside,76)、purpureaside C(77)、darendoside B(78)、decaffeoylacteoside(79)、氢化阿魏酸(hydroferulic acid,80)、对羟基苯乙醇(p- hydroxyphenylethyl alcohol,81)[3-5, 9]。从地黄叶的50%含水丙酮组织破碎提取物中分离得到化合物67、73、81、3,4-二羟基苯乙醇(82)、β-hydroxyacteoside(83)、松果菊苷(84)、异毛蕊花糖苷(85)得到[5]。
1.3 三萜及其苷类从地黄叶的50%含水丙酮提取物中分离并鉴定了3个新的乌苏烷型三萜类成分,分别为glutinosalactone A~C(86~88),同时得到已知成分2β,3β,19α-三羟基齐墩果-12-烯-13,28-二羧酸(89)、2α,3β-二羟基齐墩果-12-烯-28-酸(90)、glutinolic acid(91)、齐墩果酸(92)、熊果酸(93)、齐墩果酮酸(94)[6, 11]。从地黄块根中分离得到一个新的三萜类成分glutinolic acid(95)[8]。部分新化合物结构见图 3。
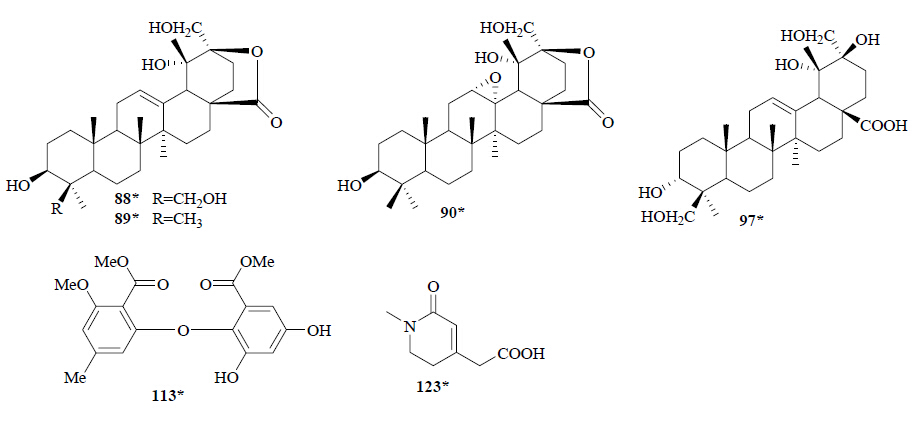 | 图 3 地黄中新的三萜、酚酸类等化合物结构Fig. 3New structures of triterpenoids, phenolic acids, and other compounds in R. glutinosa |
从生地黄中分离得到的含氮化合物有7-羟基异喹啉(96)、5-羟基-2-羟甲基吡啶(97)、6-甲基-3-吡啶醇(98)、腺嘌呤核苷(99)、腺嘌呤(100)、尿嘧啶核苷(101)、5-hydroxymethyl-pyrrole- 2-carbaldehyde(102)[3, 5]。
1.5 黄酮及其苷类从地黄叶的50%含水丙酮提取物中分离出香叶木素(103)、木犀草素-7-O-β-D-葡萄糖醛酸苷(104)、芹菜素(105)、木犀草素(106)[6]。
1.6 酚酸及其苷类从地黄叶的50%含水丙酮提取物中分离出对羟基苯甲酸(107)、龙胆酸(108)、原儿茶酸(109)、 1,2,4-苯三酚(110)[6]。从地黄内生真菌代谢产物中分离得到2,4-dihydroxy-2′,6-diacetoxy-3′-methoxy- 5′-methyldiphenyl ether(111)、paecilospirone(112)、α-axetylorcino(113)、2,4-dihydroxy-3,5,6-trimethyl- methyl-benzoate(114)。111为新的二苯醚类化合物,显示了一定的细胞毒和抗真菌活性[12]。从地黄的块根中分离得到香草酸(115)、苏式-1-(4-羟基-3-甲氧 基苯基)-1,2,3-丙三醇(116)、咖啡酸(117)[8, 11]。
1.7 木脂素类从地黄的块根中分离得到了4木脂素类成分,分别为Hierochin D(118)、yemuoside YM1(119)、落叶松树脂醇(120)、落叶松脂醇-4′-O-β-D-吡喃型葡萄糖苷(121)[9]。新化合物结构见图 3。
1.8 其他类从地黄块根中得到1,2,5,6-四氢-1-甲基-2-氧代-4-吡啶乙酸(122)、1-(4-methy-2-furanyl)-2-(5- methyl-5-ethenyl-2-tetrahydrofuranyl)-propan-1-one(123)、2-methoxy-4-methylphenyl-O-β-D-apiofurano- syl-(1→6)-β-D-glucopyranoside(124)、rhamno- pyranosyl vanilloyl(125)、syringicacid-4-O-α-L-rha- mnopy-ranoside(126& lt; /b>)、(7R,8S,7′R,8′S)-4,9,4′,9′-tetra- hydroxy-3,3′-dimethoxy-7,7′-epoxylignan9-O-β-D-glucopyranoside(127)、1-methyl-1,2,3,4-tetrahydro-β- carboline-3-carboxylic acid(128)、异直蒴苔苷(129)、直蒴苔苷(130)、5-羟甲基糠醛(5-hydroxymethyl furfural,131)、酪醇(132)、6-O-E-麦角甾苷(133)、β-谷甾醇(134)、2,5-二羟基苯乙酮(135),其中化合物122为新化合物,命名为地黄啶[4]。从地黄叶的50%丙酮提取物中分离得到134、6,7-二羟基香豆素(136)、胡萝卜苷(137)[6]。从地黄内生真菌代谢产物中分离得到2-methoxy-1,8-dimethyl-xanthen-9-one(138)、4-hydroxy-α-lapach- one(139)、enalin A(140)、2,3,4-trimethyl-5,7- dihydroxy-2,3-dihydrobenzofuran(&l t;/ b>141)、3-iso- propenyl-(Z)-mono methyl maleate(142)[13]。
2 药理作用地黄的生理活性广泛,对心脑血管系统、中枢神经系统、免疫系统、脏腑系统有显著的作用,并具有细胞毒活性、抗糖尿病及其并发症、抗骨质疏松、抗炎、抗电离辐射等药理作用。对于地黄药效物质基础的研究比较突出的是环烯醚萜类成分,其中以梓醇的研究最为集中,其具有抗炎、抗氧化、抗凋亡等多种生物学效应;目前研究主要集中在抗脑细胞凋亡,改善氧化应激对神经系统损等。同时也发现了具有相关药理活性的其他成分,并研究了这些成分的作用机制。
2.1 对心脑血管系统的药理作用对于成年雄性大鼠心肌缺血模型,术前5 min注射5 mg/kg梓醇进行干预,能显著改善心肌缺血再灌注损伤的心脏功能,降低心肌梗死、心肌细胞凋亡和心肌坏死,显著降低血管中过氧亚硝基阴离子ONOO(−)的形成(P<0.05),增加蛋白激酶(Akt)、内皮型一氧化氮合酶磷酸化和一氧化氮(NO)的生成,提高抗氧化能力,降低一氧化氮合酶表达和超氧阴离子自由基的在心肌缺血再灌注心脏中的产生。表明梓醇增加了生理性NO生成,同时降低ONOO(−)生成,从而对心肌缺血再灌注具有心肌保护作用[14]。
对于过氧化氢(H2O2)诱导的人脐静脉内皮细胞(HUVEC)凋亡模型,0.1、1、10 μg/mL梓醇可以增加H2O2诱导内皮及心肌细胞中B细胞淋巴瘤/白血病-2基因(Bcl-2)、磷酸化蛋白激酶B(p-Akt)和死亡启动子(p-Bad)的表达,抑制促凋亡基因(Bax)的表达,同时激活磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT-B)阿尔茨海默病信号转导通路,还可以减轻H2O2诱导内皮及心肌细胞乳酸脱氢酶(LDH)、丙二醛(MDA)的释放,增加超氧化物歧化酶(SOD)的浓度,增加细胞清除活性氧(ROS),能够改善内皮功能及心肌功能,为心血管疾病的临床防治提供了新的药物治疗[15]。
对于正常Wistar大鼠,每天给予2.5 mg/kg梓醇预处理,用药10 d后能够减轻异丙肾上腺素诱导的大鼠心肌损伤程度,并使肌酸激酶同工酶(CK-MB)与LDH明显降低,明显降低肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)的蛋白表达[16]。地黄中的咖啡酸具有促血管生成作用[12]。
2.2 对中枢神经系统的作用研究显示地黄里的梓醇和地黄多糖对脑缺血、神经衰老和脑损伤均有保护作用。
2.2.1 梓醇和地黄寡糖对脑缺血的保护作用对于开颅电凝法制备的SD大鼠局灶性脑缺血模型,术后6 h注射5 mg/kg梓醇进行干预,4次/d,连续7 d,能显著增加微血管和神经元数目,减少星形胶质细胞数目,使胞体和突起数目以及形态特征趋近于正常,对神经血管单元具有较好的保护作用,且能促进脑缺血后神经功能的恢复[17]。对于慢性脑缺血诱导的大鼠脑白质损伤模型,ip梓醇5 mg/kg,连续10 d,能明显降低少突胶质细胞凋亡和髓鞘损伤,上调p-Akt表达。梓醇可通过上调p-Akt的表达抑制慢性脑缺血诱导的脑白质损伤[18]。对于局灶性脑缺血(MCAT)动物模型,梓醇15~60 mg/kg组可以显著改善神经症状损伤。与对照组相比,梓醇15 mg/kg组可显著降低模型动物梗塞区面积(P<0.05),30、60 mg/kg组可显著降低脑水肿(P<0.05);大鼠永久性大鼠脑缺血(pMCAO),术后7 d 开始,梓醇30 mg/kg或60 mg/kg组开始改善模型动物神经症状损伤;术后14 d,与假手术组比较,缺血侧脑组织IL-10和核转录因子NF-κBp65的含量变化与模型组已经不明显,IL-6水平显著降低(P<0.05),梓醇15 mg/kg灌胃给药14 d可以降低模型动物缺血侧脑组织NF-κBp65的量(P<0.05)。梓醇能改善局灶性脑缺血模型动物急性期及亚急性期神经症状损伤,缩小梗死灶,减轻脑部水肿,其作用可能与抑制脑缺血引起的炎症损伤无关[19]。
对大鼠大脑中动脉永久性局灶性缺血模型,梓醇30、60 mg/kg给药组能明显改善缺血性脑卒中大鼠姿势反射,增强横木行走的能力和抓握力量(P<0.05、0.01);明显增加完整神经细胞的数量(P<0.01);脑皮质神经生长因子(NGF)和脑源性神经营养因子(BDNF)及mRNA的表达比模型组明显上调(P<0.05、0.01)。梓醇可上调缺血性脑卒中大鼠大脑皮质NGF、BDNF及mRNA基因表达,促进神经元存活、修复再生,加速其神经功能恢复[20]。万东等[21]发现,ip梓醇5 mg/kg,1次/d,连续7 d可增强缺血性脑卒中大鼠皮质脊髓束轴突芽生和重塑能力,有助于受累肢体感觉运动功能恢复,可增强局灶脑缺血大鼠大脑皮质(PIC)区锥体神经元树突可塑性,上调突触素p38表达,促进神经缺失功能恢复,下调脑缺血大鼠感觉运动皮质中抑制轴突生长蛋白Nogo-A及其受体NgR蛋白表达,有助于改善轴突再生限制性微环境,上调局灶脑缺血大鼠缺血灶周围大脑皮质脑源性神经营养因子(BDNF)及其受体酪氨酸激酶受体B(TrkB)蛋白表达,有助于模型大鼠神经缺失功能恢复;梓醇可促进局灶脑缺血大鼠PIC区芽生轴突形成突触连接,增强突触新生。还能明显增加PIC区神经毡内突触数密度(Nv)和面密度(Sv),提示梓醇对脑缺血后突触重构有明显促进作用;表明梓醇能促进局灶脑缺血大鼠PIC区神经元芽生轴突形成新的突触连接,增强突触结构可塑性[20]。1、5 mg/kg梓醇可以减轻动物神经功能损伤和缩小脑梗死容积,可能通过降低脑内自由基水平、控制脂质过氧化程度,对缺血再灌注引起的大鼠脑损伤产生神经保护作用[22]。
对于永久性结扎大鼠双侧颈总动脉建立慢性脑缺血模型,5、10 mg/kg梓醇治疗后可显著提高缺血大鼠脑白质髓鞘染色的平均光密度值、提高髓鞘碱性蛋白(MBP)的表达水平、缓解髓鞘的损伤,表明梓醇对脑白质缺血损伤的髓鞘具有保护作用,可明显增加缺血大鼠胼胝体的少突胶质细胞数、抑制少突胶质细胞的调亡,说明梓醇对脑白质的保护作用与其抗调亡效应有关。梓醇治疗组胼胝体增多的成熟少突胶质细胞数又明显多于仅由凋亡减少而增加的成熟少突胶质细胞数,表明部分新增的成熟少突胶质细胞数可能来源于分化的少突胶质前体细胞。梓醇可明显降低脑白质星形胶质细胞和小胶质细胞的增生活化,抑制炎症因子的释放。提示梓醇对脑白质的保护作用与其抗炎症效应有关。可明显提高胼胝体中Bcl-2、p-Akt和p-CREB阳性细胞数和表达水平,增加Bcl-2和p-Akt在少突胶质细胞中的表达。这说明梓醇对少突胶质细胞的保护作用可能与Akt信号通路有关[23]。
地黄寡糖9、45 g/kg能够显著改善缺血再灌注型痴呆大鼠的行为学障碍,降低其行为学评分,减轻海马CA1区神经组织的病理性改变,降低神经元凋亡细胞比例,并显著升高血管性痴呆大鼠海马CA1区神经元细胞中Bcl-2蛋白表达(P<0.01)、降低Bax蛋白表达(P<0.01),Bcl-2/Bax显著升高,从而抑制了该区域神经元细胞的凋亡。此外,地黄寡糖能够显著减少血管性痴呆大鼠血清及海马组织中MDA的积累(P<0.01),提高SOD的活性(P<0.01),降低海马组织中谷氨酸的水平(P<0.01)。地黄寡糖能够显著减少脑缺血再灌注损伤所致的大鼠海马CAl区神经元凋亡,其作用机制可能是通过调控Bcl-2/Bax相关蛋白的表达来实现的。地黄寡糖减少组织中谷氨酸的水平和MDA的含量,提高SOD活性等,也提示其对血管性痴呆有一定的治疗作用[24]。
2.2.2 梓醇和地黄多糖对神经衰老的保护作用梓醇对于D-半乳糖(D-gal)诱导的衰老小鼠模型大脑胆碱能系统及炎性细胞因子具有神经保护作用。模型动物给药2周,梓醇能显著降低衰老小鼠大脑乙酰胆碱酯(AChE)的活性,显著增加其前脑基底胆碱乙酰转移酶(ChAT)阳性神经元表达,增加毒蕈碱乙酰胆碱受体M1(mAChR1)的表达,并且降低衰老小鼠大脑中TNF-α、IL-1β和晚期糖基化终产物(AGEs)的量。表明,梓醇能够对D-半乳糖诱导的衰老小鼠脑具有保护作用,其作用机制可能是对小鼠大脑的胆碱能和免疫损伤具有保护作用[25];对D-半乳糖致亚急性衰老小鼠模型,同时在前2周和后2周分别sc梓醇2.5 mg/kg,预防和治疗后可以改善衰老模型小鼠的学习记忆能力,并显著提高脑中SOD、谷胱甘肽过氧化物酶(GSH-PX)活性,降低丙二醛(MDA)水平,表明梓醇可改善D-gal致衰老小鼠的学习记忆障碍,此作用可能与梓醇的抗氧化作用有关[26];对谷氨酸诱导SD大鼠海马神经元损伤,0.2、1.0、5.0 mg/L梓醇可不同程度地改善谷氨酸损伤引起的神经细胞形态的改变,提高细胞存活力,减少LDH的漏出,降低细胞凋亡率,并呈一定的剂量相关。梓醇对谷氨酸诱导的海马神经细胞损伤有保护作用[27]。
Xia等[28]用淀粉样蛋白β加谷氨酸受体激动剂诱导的神经退行性改变小鼠模型,梓醇治疗2~3个月后,可以大大提高小鼠的学习能力和记忆力,梓醇能够升高动物模型大脑中脑源性神经营养因子(BDNF)水平,其神经保护作用机制与多奈哌齐不同。可见,对于淀粉样蛋白β加谷氨酸受体激动剂诱导的神经退行性改变,梓醇具有一定的治疗作用。对淀粉样前体蛋白(APP)/早老素1(PS1)APP/PS1双转基因小鼠,每天ip梓醇5 mg/kg,连续3周,能显著缓解阿尔茨海默病模型小鼠的焦虑情绪,这种改善作用可能是通过改善神经元及突触的丢失来实现的[29]。地黄多糖具有抗焦虑的作用,其机制可能与抑制大鼠海马区β-突触核蛋白、DJ-1、过氧化物酶-2、过氧化物酶-6、二甲基精氨酸二甲胺水解酶1(DDAH-1)和铁硫蛋白的下调有关[30]。
2.2.3 梓醇和地黄多糖对脑损伤的保护作用梓醇可显著改善1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)引起的小鼠行动能力损害,显著升高帕金森氏病小鼠纹状体内多巴胺浓度,并呈剂量相关,这一作用可能与黑质致密部胶质细胞源性神经营养因子(GDNF)浓度依赖的酪氨酸羟化酶神经元数量和纹状体内多巴胺转运体密度升高有关。在给予GDNF受体抑制剂后,梓醇对1-甲基-4-苯基吡啶(MPP+)诱导的中脑神经细胞损伤的保护作用明显减弱。表明梓醇抗帕金森氏病的作用机制可能与增强纹状体内GDNF的表达有关[31]。对于鱼藤酮所致小鼠脑线粒体损伤模型,每天注射10 mg/kg梓醇,连续7 d,可增加GSH的量,减少膜电位的丢失和活性氧的生成,抑制LDH的释放,对小鼠脑线粒体具有保护作用,通过恢复脑内线粒体复合物酶活性和膜电位水平、减少线粒体内ROS生成的作用而抑制鱼藤酮诱导的脑损伤[32, 33]。由东莨菪 碱所致小鼠空间学习记忆障碍,每天尾iv梓醇9 mg/kg,连续3 d后可改善东莨菪碱诱导的学习和记忆障碍,其机制可能与促进BDNF表达,增加脑乙酰胆碱(ACh)含量有关[34]。
对于脂多糖(LPS)诱导的神经退行性疾病,梓醇能刺激Bcl-2的表达,抑制Bax蛋白的表达。对于LPS诱导的PC12细胞,梓醇能够减少Ca2+浓度增加,下调钙离子/钙调素依赖性蛋白激酶(CaMK)磷酸化,阻断钙离子/钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)依赖的调亡信号调节激酶(ASK1)/-c-Jun氨基端激酶(JNK)/丝裂原活化蛋白激酶p38信号级联,同时减少LPS诱导的PC12神经细胞株凋亡。因此,梓醇对LPS诱导的PC12细胞凋亡的保护作用,其作用机制与CaMKII的依赖ASK-1/JNK/p38信号通路之间有密切联系[35]。
采用脂多糖(LPS)与干扰素y(IFN-y)共同刺激星形胶质细胞诱导炎症反应,梓醇显著抑制NO和ROS的生成,削弱了诱导型一氧化氮合酶(iNOS)的活性,明显下调炎症基因iNOS、环氧化酶2(COX-2)和Toll样受体-4(TLR4)的表达,其抗炎作用是通过调节核转录因子-κB(NF-κB)的激活,控制下游炎症因子的表达与释放,从而抑制星形胶质细胞激活诱发的炎症反应,最终实现神经保护的目的[36]。
对于大鼠骨髓间充质干细胞(BMSCs)诱导分化为神经样细胞,用200 μg/L地黄多糖诱导24 h,连续培养7 d,诱导后的细胞伸出突起交互成复杂网状,细胞神经元蛋白阳性表达率97.9%,在高钾刺激下细胞膜电位迅速升高,细胞内钙离子流增加,细胞突触发生了胞吞胞吐现象,其机制是地黄多糖抑制Notch1蛋白的表达,Notch1 mRNA随时间变化表达下降,Presenilin1表达先降低后略有回升,Hes1表达下降,Mash1表达升高,Jagged1表达先升高后降低,并影响Notch信号通路相关基因的表达[37, 38]。
2.3 降血糖、调血脂给模型动物iv梓醇200 μmol/L可明显增高3T3-L1脂肪细胞的葡萄糖消耗量(P<0.01),抑制过氧化物酶体增长因子活化受体(PPAR-γ)蛋白表达,具有体外调节脂肪细胞糖脂代谢的作用[39]。梓醇能降低链脲佐菌素(STZ)诱导的糖尿病大鼠血糖,并呈剂量相关,其作用机制是通过促进β-内啡肽的释放,提高葡萄糖转运率,抑制糖异生有关[40]。
0.1 mg/kg梓醇能增强STZ-糖尿病大鼠比目鱼肌对葡萄糖的摄取,呈浓度相关;促进肝糖原合成,增加葡萄糖的利用,从而降低血糖[41]。梓醇能显著降低高脂饮食联合STZ建立的糖尿病模型肾重指数,改善肾功能和病理变化,降低血管紧张素Ⅱ、肾皮质转化生长因子-β1(TGF-β1)、结缔组织生长因(CTGF)、纤维连接蛋白(FN)、Ⅳ型胶原的组织水平,下调TGF-β1和结缔组织生长因(CTGF)的mRNA表达,通过抑制TGF-β1、CTGF和血管紧张素Ⅱ(Ang II)的表达,减少细胞外基质累积[42]。给肥胖糖尿病模型大鼠ip地黄多糖,中、高剂量组分别20、30 mg/kg,1次/d,0.2 mL/次,结果可以有效改善的空腹血糖(FBG)、胰岛素水平、总胆固醇(TC)、三酰甘油(TG)等相关生化指标,同时血清中大鼠血清中胰高血糖素样肽-1(GLP-1)、葡萄糖依赖性促胰岛素释放肽(GIP)的水平也有所升高,因此,地黄多糖可以通过促进GLP-1、GIP的分泌对肥胖糖尿病大鼠起到治疗作用[43]。
梓醇能够抑制晚期糖基化终产物(AGEs)诱导的单核细胞THP-1炎症表达,抑制炎症介质表达,显著降低NF-κB的转录活性,抑制AGE诱导的丝裂原活化蛋白激酶(MAP)磷酸化,IκBα和NF-κB核定位的降解,抑制细胞内ROS产生,达到抑制NADPH氧化酶活性的双重作用,从而抑制AGE-介导的炎症[44, 45]。毛蕊花糖苷抑制AGEs生成,浓度为1×10−5 mol/L时的抑制率为17.4%,梓醇和水苏糖对果糖胺抑制作用较强,IC50分别为4.2×10−8、9.4×10−8 mol/L[46]。
高脂饲料诱导的慢性应激大鼠,地黄寡糖能增加胸腺和脾脏的器官质量,降低空腹血糖水平,改善葡萄糖耐量异常,增加肝脏和肌肉中糖原的储量,减少糖异生的能力和血浆游离脂肪酸的水平,以及血浆中三酰甘油和总胆固醇水平;而血浆皮质酮水平下降,血浆瘦蛋白水平增加,机制可能是地黄寡糖通过多途径和多靶点重建神经内分泌免疫调节网络中的葡萄糖稳态所介导[47]。
2.4 细胞毒活性对于体外培养的5种人肿瘤细胞回盲部腺癌HCT-8细胞、肝癌Bel-7402细胞、胃癌BGC-823细胞、肺腺癌A549细胞、卵巢癌A2780细胞,地黄新苷A~E及J~K、frehmaglutin A~D用量≤10 μmol/L时均不显示细胞毒活性;而对D-氨基半乳糖诱导的人肝细胞株HL-7702损伤模型,地黄新苷C、地黄新苷J~K、去乙酰野芝麻苷、frehmaglutin C、2-phenylethyl-O-β-D-xylopyranosyl-(1→6)-β-D-glucopyranoside、红景天苷、落叶松脂醇-4′-O-β-D-吡喃型葡萄糖苷、2-me thoxy-4-methylphenyl-O-β-D- apiofuranosyl-(1→6)-β-D-glucopyranoside、 rhamno- pyranosyl vanilloyl、(7R,8S,7′R,8′S)-4,9,4′,9′-tetra- hydroxy-3,3′-dimethoxy-7,7′-epoxylignan9-O-β-D-glu-copyranoside和1-methyl-1,2,3,4-tetrahydro-β-carbo- line-3-carboxylic acid在浓度为10 μmol/L时,具有肝损伤保护作用,glutinosalactone C表现出细胞毒活性,IC50 8.35~39.25 μmol/L;glutinosalactone A~B对人肿瘤细胞株 < /span>MCF-7、MG63和HepG2不显示细胞毒作用[2-5, 7-11]。梓醇对高糖诱导的人神经瘤细胞系SH-SY5Y 细胞凋亡具有保护作用,1、2、4 mg/mL组细胞存活率均明显升高,其机制可能与梓醇的抗氧化作用有关[48]。
2.5 抗电离辐射人淋巴细胞AHH-1在照射前给与梓醇25~100 mg/mL干预,可显著抑制电离辐射诱导的细胞凋亡,增加细胞活力。同时,梓醇25~100 mg/kg降低了胃肠道的形态学损伤,降低血浆中MDA和肠中8-羟基脱氧鸟苷水平,增加体内血浆中内源性抗氧化剂和外周血白细胞和血小板,放射保护作用可能与减少活性氧有关[49]。
2.6 抗骨质疏松以小鼠成骨细胞株MC3T3-E1作为药物筛选的细胞模型,梓醇1×10-7~1×10-9 mol/L,分别培养24、48 h,促进成骨细胞株MC3T3-E1细胞增殖;梓醇1×10-5~1×10-6 mol/L培养48、72 h可提高成骨细胞株MC3T3-E1细胞内碱性磷酸酶的活性;梓醇1×10-5~1×10-6 mol/L培养8、12 d能明显促进成骨细胞MC3T3-E1骨钙素合成和分泌;梓醇1×10-5& lt; span style='font-family:宋体'>~1×10-6 mol/L培养19 d,能增加成骨细胞株MC3T3-E1细胞的矿化结节(MBNS)数目。因此,梓醇可以提高成骨细胞株MC3T3-E1增殖和分化能力,梓醇可能是地黄治疗骨质疏松作用的活性成分之一[50]。毛蕊花糖苷明显抑制破骨细胞的分化和形成,减少骨质流失[51]。
2.7 对脏器的保护作用地黄寡糖能显著改善四氯化碳产生的肝损伤生理指标,使肝脏中升高的MDA降低,可以防止活性氧相关的肝损害[52]。0.1~0.4 g/L地黄低聚糖体外培养人脂肪组织来源干细胞(hASCs)12 h,可促进分泌血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、胰岛素样生长因子-1(IGF-1)、基质细胞衍生因子-lα(SDF-lα)(P<0.05),而对于碱性成纤维细胞生长因(bFGF)的分泌无明显影响,增强hASCs的旁分泌作用[53];熟地黄寡糖能促进脂肪来源的间充质干细胞(ADMSCs)增殖,减轻H2O2诱导的细胞凋亡,增加细胞活力和增殖能力,这种保护作用与上调血管内皮生长因子和肝细胞生长因子有关[54]。
而对于体外培养的小型猪脂肪组织来源干细胞,地黄低聚糖可以促进表面抗原CD29、CD44、CD90、CD105表达,而对于CD31、CD34、CD45、HLA-DR表达无明显影响。地黄低聚糖浓度在0.01~1 g/L内对体外培养的小型猪ASCs具有促增殖作用(P<0.05),最佳浓度为0.1 g/L[55]。地黄多糖能够促进脾淋巴细胞增殖,改善脾脏组织学变化,提高创伤小鼠脾指数和脾脏免疫功能,进而促进创面愈合[56]。熟地黄多糖具有抗疲劳作用,其机制与增加肝糖原储存,减少血清尿素氮和血乳酸的蓄积有关[57]。
2.8 抗炎对于脂多糖诱导小鼠巨噬细胞RAW264.7炎症反应(LPS),从地黄中提取的2,5-二羟基苯乙酮通过抑制氧化氮合酶(iNOS)的表达,显著抑制NO的产生,通过下调其mRNA的表达,显著降低促炎细胞因子TNF-α和IL-6的水平,有效抑制细胞外信号相关激酶(ERK)1/2的磷酸化和NF-κB p65蛋白的核转位,2,5-二羟基苯乙酮抑制炎症介质释放,通过阻断ERK1/2和NF-κB信号传导途径[58]。
2.9 提高免疫地黄多糖上调小鼠骨髓来源的树突状细胞CD40、CD80、CD83、CD86和MHC II分子的表达,下调由于IL-12和TNF-α生成诱导的胞饮作用和吞噬作用,有效地促进树突状细胞的成熟,增强宿主免疫[59]。地黄多糖显著刺激淋巴细胞增殖和T细胞的生长速度,上调T淋巴细胞中IL-2和IFN-γ的生成,具有免疫增强活性[60]。
2.10 其他作用毛蕊花糖苷抑制黑色素瘤B16F10细胞上的酪氨酸酶活性和黑色素的合成,降低酪氨酸酶、酪氨酸酶相关蛋白-1(TRP-1)和小眼畸形转录因子(MITF)的蛋白质水平,增加细胞外调节激酶(ERK)的磷酸化。此外,毛蕊花糖苷抑制α-促黑素细胞激素诱导和照射紫外吸收导致的黑色素生成。表明毛蕊花糖苷通过激活ERK信号,从而下调MITF、酪氨酸酶和TRP-1的生成,降低B16F10细胞酪氨酸酶活性和黑素的生成[61]。
3 结语随着国内外对地黄研究的不断深入,不但对地黄的常用药用部位块根进行了系统的化学成分研究,同时对地黄叶的研究也取得了显著成效,从地黄叶中分离出了大量的化合物,尤其是三萜类成分的研究,为地黄叶这一中药资源得到合理开发和利用奠定基础。从地黄中分离得到的化学成分进行的体外细胞实验,均不呈现细胞毒活性,相反对细胞损伤具有保护作用,这一研究对阐明地黄具有滋补作用提供了科学依据。地黄中含有大量的环烯醚萜类成分,其中尤以梓醇的研究最为广泛,近年来研究发现毛蕊花糖苷也具有显著的药理活性,值得进一步深入研究。同时,应深入研究地黄的药效物质基础,丰富和完善地黄植物化学内容。
地黄在临床上应用的品种包括鲜地黄、生地黄、熟地黄(清蒸或酒蒸)、生地炭、熟地炭等,对于其药效物质基础及其作用机制还不明确,从而导致了其炮制加工的工艺和质量标准的制定还不完善,因此有必要对其炮制加工品进行研究。
地黄药理作用广泛,对免疫、血液、内分泌、心脑血管及神经系统等方面均有一定的作用。地黄中梓醇的研究一直是热点,尤其是在心脑血管疾病、神经保护、糖尿病及其并发症、骨质疏松等疾病方面显示显著的疗效,应进一步加快其开发,争取早日开发为中药重大创制新药。同时应对从地黄中其他类成分进行相关药理作用研究,尤其是对新发现的新化合物进行相关药理作用研究。值得注意的是地黄中的多糖、寡糖等糖类成分的药理研究越来越广泛和深入,在心脑血管疾病、神经保护、糖尿病及其并发症等方面都显示出较好的疗效,应是今后药理研究的重点。
综上所述,随着植物化学和现代药理学研究的不断深入,同时临床研究不断验证,对加快阐明地黄治疗疾病的药效物质基础及其作用机制提供了科学依据,为早日将这一传统中药研制成重大创制中药新药奠定基础,使之更好地为人类健康服务。
| [1] | 刘彦飞, 梁 东, 罗 桓, 等.地黄的化学成分研究 [J].中草药, 2014, 45(1): 16-22. |
| [2] | Liu Y F, Liang D, Luo H, et al.Hepatoprotective iridoid Glycosides from the Roots of Rehmannia glutinosa [J].J Nat Prod, 2012, 75(9): 1625-1631. |
| [3] | 李行诺, 周盂宇, 沈培强, 等.生地黄化学成分研究 [J].中国中药杂志, 2011, 36(22): 3125-3129. |
| [4] | 刘彦飞, 梁 东, 罗 桓, 等.地黄的化学成分研究 [J].中草药, 2014, 45(1): 16-22. |
| [5] | 郭丽娜, 白 皎, 裴月湖.生地黄化学成分的分离与鉴定 [J].沈阳药科大学学报, 2013, 30(7): 506-508, 542. |
| [6] | 张艳丽, 冯志毅, 郑晓珂, 等.地黄叶的化学成分研究 [J].中国药学杂志, 2014, 49(1): 15-21. |
| [7] | Liu Y F, Liang D, Luo H, et al.Ionone glycosides from the roots of Rehmannia glutinosa [J].J Asian Nat Prod Res, 2014, 16(1): 11-19. |
| [8] | Lee S Y, Kim J S, Choi R J, et al.A new polyoxygenated triterpene and two new aeginetic acid quinovosides from the roots of Rehmannia glutinosa [J].Chem Pharm Bull, 2011, 59(6): 742-746. |
| [9] | Feng W, Lv Y, Zheng K, et al.A new megastigmane from fresh roots of Rehmannia glutinosa [J].Acta Pharm Sinica B, 2013, 3(5): 333-336. |
| [10] | Fu G M, Shi S P, Ip F C, et al.A new carotenoid glycoside from Rehmannia glutinosa [J].Nat Prod Res, 2011, 25(13): 1213-1218. |
| [11] | Zhang Y L, Feng W S, Zheng X K, et al.Three new ursane-type triterpenes from the leaves of Rehmannia glutinosa [J].Fitoterapia, 2013, 89: 15-19. |
| [12] | Liu C L, Cheng L, Kwok H F, et al.Bioassay-guided isolation of norviburtinal from the root of Rehmannia glutinosa, exhibited angiogenesis effect in zebrafish embryo model [J].J Ethnopharmacol, 2011, 137(3): 1323-1327. |
| [13] | Peng W, You F, Li X, et al.A new diphenyl ether from the endophytic fungus Verticillium sp.isolated from Rehmannia glutinosa [J].Chin J Nat Medi, 2013, 11(5): 673-675. |
| [14] | Huang C, Cui Y, Ji L, , et al.Catalpol decreases peroxynitrite formation and consequently exerts cardioprotective effects against ischemia/reperfusion insult [J].Pharm Biol, 2013, 51(4): 463-473. |
| [15] | Hu L, Sun Y, Hu J.Catalpol inhibits apoptosis in hydrogen peroxide-induced endothelium by activating the PI3K/Akt signaling pathway and modulating expression of Bcl-2 and Bax [J].Eur J Pharmacol, 2010, 628(1-3): 155-163. |
| [16] | 毕方杰, 张 虎, 胡 健.梓醇对异丙肾上腺素诱导的大鼠心肌损伤的保护作用及机制研究 [J].中国医科大学学报, 2013, 42(3): 244-247. |
| [17] | 谭灵莉, 崔丹丹, 祝慧凤, 等.梓醇对脑缺血后神经血管单元构筑的影响 [J].中国药理学通报, 2014, 30(1): 44-48. |
| [18] | 蔡其燕, 姚忠祥.梓醇通过上调p-Akt表达抑制慢性脑缺血诱导的大鼠脑白质损伤 [J].局解手术学杂志, 2013, 22(3): 237-240. |
| [19] | 张胜威, 董世芬, 李俊青, 等.梓醇对脑缺血急性期及亚急性期的神经保护作用及作用机制 [J].世界科学技术—中医药现代化, 2013, 15(8): 162-167. |
| [20] | 刘 明, 刘 洋, 张 易, 等.梓醇上调NGF、BDNF及mRNA表达伴随缺血性脑卒中大鼠神经功能恢复 [J].中华中医药杂志, 2011, 26(5): 977-981. |
| [21] | 万 东, 祝慧凤, 吕发金, 等.梓醇促进局灶脑缺血大鼠皮质脊髓束芽生和重塑 [J].中国药理学通报, 2013, 29(8): 1057-63. |
| [22] | 闵昱源, 冯彩华, 高子军, 等.梓醇对大鼠脑缺血再灌注损伤的保护作用研究 [J].现代生物医学进展, 2012, 12(20): 3805-3809. |
| [23] | Cai Q Y, Chen X S, Zhan X L, et al.Protective effects of catalpol on oligodendrocyte death and myelin breakdown in a rat model of chronic cerebral hypoperfusion [J].Neurosci Lett, 2011, 497(1): 22-26. |
| [24] | 蒋 青, 沈明勤, 石 磊, 等.地黄寡糖对血管性痴呆大鼠海马区神经细胞凋亡及相关蛋白表达的影响 [J].中国实验方剂学杂志, 2013, 19(3): 192-196. |
| [25] | Zhang X, Jin C, Li Y, et al.Catalpol improves cholinergic function and reduces inflammatory cytokines in the senescent mice induced by D-galactose [J].Food Chem Toxicol, 2013, 58: 50-55. |
| [26] | 张秀丽, 刘秀珍.梓醇对D-半乳糖致亚急性衰老小鼠学习记忆及脑中相关抗氧化酶活性的影响 [J].中国生化药物杂志, 2011, 32(2): 103-106. |
| [27] | 王佐周, 岳春丽, 杨 菁.梓醇对谷氨酸诱导SD大鼠海马神经元损伤的保护作用 [J].解剖科学进展, 2011, 17(2): 113-115. |
| [28] | Xia Z, Zhang R, Wu P, et al.Memory defect induced by β-amyloid plus glutamate receptor agonist is alleviated by catalpol and donepezil through different mechanisms [J].Brain Res, 2012, 1441: 27-37. |
| [29] | 宋 冲, 楚亚楠, 贺桂琼, 等.梓醇对APP/PS1双转基因小鼠焦虑行为和脑内神经元的影响 [J].重庆医科大学学报, 2013, 38(6): 598-601. |
| [30] | Cui Y, Rong C, Wang J, et al.Mechanism-based anti-anxiety effects of polysaccharides extracted from shudihuang(Radix Rehmanniae Preparata) by two-dimensional electrophoresis analysis in rat hippocampus proteins [J].J Tradit Chin Med, 2013, 33(4): 524-530. |
| [31] | Xu G, Xiong Z, Yong Y, et al.Catalpol attenuates MPTP induced neuronal degeneration of nigral-striatal dopaminergic pathway in mice through elevating glial cell derived neurotrophic factor in striatum [J].Neurosci, 2010, 167(1): 174-184. |
| [32] | 张秀丽, 于德红, 刘德胜, 等.梓醇对鱼藤酮致小鼠中脑和纹状体线粒体酶活性改变的改善作用 [J].中国药理学与毒理学杂志, 2012, 26(5): 618-623. |
| [33] | 石桂芳, 王贺双, 毛玉荣, 等.梓醇对鱼藤酮所致小鼠脑线粒体损伤的保护作用 [J].现代生物医学进展, 2012, 12(29): 5661-5664. |
| [34] | 王红利, 薛莉君, 万 东, 等.梓醇改善东莨菪碱诱导的学习记忆障碍及机制研究 [J].中国药理学通报, 2011, 27(9): 1272-1275. |
| [35] | Chen W, Li X, Jia LQ, et al.Neuroprotective activities of catalpol against CaMKII-dependent apoptosis induced by LPS in PC12 cells [J].Br J Pharmacol, 2013, 169(5): 1140-1152. |
| [36] | Bi J, Jiang B, Zorn A, et al.Catalpol inhibits LPS plus IFN-γ-induced inflammatory response in astrocytes primary cultures [J].Toxicol in Vitro, 2013, 27(2): 543-550. |
| [37] | 杜红阳, 李东宁, 付海燕, 等.地黄多糖诱导大鼠BMSCs向神经样细胞分化中对Notch信号通路的影响 [J].山东大学学报, 2013, 51(12): 1-6. |
| [38] | 刘宇卓, 王 霞, 杜红阳, 等.地黄多糖诱导骨髓间充质干细胞为神经样细胞后的突触功能 [J].解剖学杂志, 2013, 36(3): 285-288. |
| [39] | 陈 立, 程 瑾, 杨明炜, 等.梓醇对3T3-L1脂肪细胞糖脂代谢的影响及其机制研究 [J].中药新药与临床药理, 2013, 24(2): 111-115.. |
| [40] | Shieh J P, Cheng K C, Chung H H, et al.Plasma glucose lowering mechanisms of catalpol, an active principle from roots of Rehmannia glutinosa, in streptozotocin-induced diabetic rats [J].J Agric Food Chem, 2011, 59(8): 3747-3753. |
| [41] | Huang W J, Niu H S, Lin M H, et al.Antihyperglycemic effect of catalpol in streptozotocin-induced diabetic rats [J].J Nat Prod, 2010, 73(6): 1170-1172. |
| [42] | Dong Z, Chen C X.Effect of catalpol on diabetic nephropathy in rats [J].Phytomedicine, 2013, 20(11): 1023-1029. |
| [43] | 蔡春沉, 王洪玺, 王 肃.地黄多糖对肥胖糖尿病大鼠模型的治疗作用及对血清中GLP-1、GIP水平的影响 [J].中国老年学杂志, 2013, 33(1): 4506-4507. |
| [44] | Zhang X, Jin C, Li Y, et al.Catalpol improves cholinergic function and reduces inflammatory cytokines in the senescent mice induced by D-galactose[J].Food Chem Toxicol, 2013, 58:50-55. |
| [45] | Choi H J, Jang H J, Chung T W, et al.Catalpol suppresses advanced glycation end-products-induced inflammatory responses through inhibition of reactive oxygen species in human monocytic THP-1 cells [J].Fitoterapia, 2013, 86: 19-28. |
| [46] | 陶玉菡, 许惠琴, 李 莉, 等.生地、山茱萸抑制和清除糖基化产物的效应成分研究 [J].中药药理与临床, 2013, 29(4): 30-33. |
| [47] | Zhang R, Zhou J, Li M, et al.Ameliorating effect and potential mechanism of Rehmannia glutinosa oligosaccharides on the impaired glucose metabolism in chronic stress rats fed with high-fat diet [J].Phytomedicine, 2014, 21(5): 607-614. |
| [48] | 杨清俊, 李宗泽, 朱艳凌, 等.梓醇对高糖诱导SH-SY5Y 细胞凋亡的保护作用 [J].中药药理与临床, 2013, 29(3): 43-46. |
| [49] | Chen C, Chen Z, Xu F, et al.Radio-protective effect of catalpol in cultured cells and mice [J].J Radiat Res, 2013, 54(1): 76-82. |
| [50] | 武密山, 赵素芝, 李 恩, 等.地黄活性成分梓醇对小鼠成骨细胞MC3T3-E1增殖、分化和矿化的影响 [J].中国药理学通报, 2010, 26(4): 509-513. |
| [51] | Lee S Y, Lee K S, Yi S H, et al.Acteoside suppresses RANKL-mediated osteoclastogenesis by inhibiting c-Fos induction and NF-κB pathway and attenuating ROS production [J].PLoS One, 2013, 8(12): e80873. |
| [52] | Zhang R, Zhao Y, Sun Y, et al.Isolation, characterization, and hepatoprotective effects of the raffinose family oligosaccharides from Rehmannia glutinosa Libosch [J].J Agric Food Chem, 2013, 61(32): 7786-7793. |
| [53] | 裴志勇, 赵玉生, 高 伟, 等.地黄低聚糖对人脂肪组织来源干细胞旁分泌作用的影响 [J].中国临床保健杂志, 2012, 15(4): 388-391. |
| [54] | Zhang Y, Wang Y, Wang L, et al.Effects of Rehmannia glutinosa oligosaccharide on human adipose-derived mesenchymal stem cells in vitro [J].Life Sci, 2012, 91(25-26): 1323-1327. |
| [55] | 裴志勇, 赵玉生, 高 伟, 等.地黄低聚糖对体外培养的小型猪脂肪组织来源干细胞增殖的影响 [J].中国临床保健杂志, 2012, 15(6): 615-619. |
| [56] | 刘 华, 王 晶, 颜进项, 等.地黄多糖的超临界CO2萃取及其对创伤小鼠脾脏的影响 [J].河南农业科学, 2013, 42(6): 140-142, 148. |
| [57] | Tan W, Yu K Q, Liu Y Y, et al.Anti-fatigue activity of polysaccharides extract from Radix Rehmanniae Preparata [J].Int J Biol Macromol, 2012, 50(1): 59-62. |
| [58] | Han Y, Jung H W, Lee J Y, et al.2, 5-Dihydroxyacetophenone isolated from Rehmanniae Radix Preparata inhibits inflammatory responses in lipopolysaccharide-stimulated RAW264.7 macrophages [J].J Med Food, 2012, 15(6): 505-510. |
| [59] | Zhang Z, Meng Y, Guo Y, et al.Rehmannia glutinosa polysaccharide induces maturation of murine bone marrow derived Dendritic cells (BMDCs) [J].Int J Biol Macromol, 2013, 54: 136-43. |
| [60] | Huang Y, Jiang C, Hu Y, et al.Immunoenhancement effect of Rehmannia glutinosa polysaccharide on lymphocyte proliferation and dendritic cell [J].Carbohydr Polym, 2013, 96(2): 516-521. |
| [61] | Son Y O, Lee S A, Kim S S, et al.Acteoside inhibits melanogenesis in B16F10 cells through ERK activation and tyrosinase down-regulation [J].J Pharm Pharmacol, 2011, 63(10): 1309-1319. |
 2015, Vol. 38
2015, Vol. 38


