2. 中国医科大学药学院, 辽宁 沈阳 110001;
3. 大连医科大学药学院, 辽宁 大连 116044
2. School of Pharmacy, China Medical University, Shenyang 110001, China;
3. College of Pharmacy, Dalian Medical University, Dalian 116044, China
头孢克洛(cefaclor)是二代口服头孢菌素,与一代相比具有更强的杀菌能力及更小的毒副作用,对革兰阴性菌作用较强,尤其是流感嗜血杆菌[1, 2, 3]。蒲地蓝消炎口服液是由蒲公英、苦地丁、板蓝根、黄芩4味中药组成的复方制剂。具有清热解毒,抗炎消肿之功效,对金黄色葡萄球菌、溶血性链球菌 等有较强的抑制作用[4, 5]。目前,临床治疗中将头孢克洛与蒲地蓝消炎口服液联合应用,用于治疗敏感菌所致的呼吸道感染,已成为常见的治疗方案。蒲地蓝消炎口服液中含有的多种成分能否对头孢克洛的吸收产生影响,现有处方是否合理,在药动学方面尚且没有相关研究,亦无两药吸收之间影响的相关报道。本实验运用单向肠灌流法考察蒲地蓝消炎口服液对头孢克洛吸收的影响,为临床中二者联合应用是否产生影响提供实验依据。
1 材料 1.1 仪器Agilent1100高效液相色谱仪(美国安捷伦公司);BSA124S型电子分析天平(德国赛多利斯集团);BT100-1F蠕动泵(保定兰格恒流泵有限公司);DHW-420电热恒温水箱(北京国华医疗器械厂);TGL-16B型高速离心机(中国上海菲恰尔分析仪器有限公司)。
1.2 药品试剂头孢克洛对照品(中国食品药品检定研究院,质量分数95.3%,产品批号200903);头孢克洛干混悬剂(礼来苏州制药有限公司,产品批号C295382);蒲地蓝消炎口服液(济川药业集团有限公司,产品批号1402403);头孢唑林钠内标物质(多伦多研究化学品有限公司,质量分数98%,产品批号25-SSR-120-1);Krebs-Ringer试液(K-R试液,自制);氨基甲酸乙酯(天津市光复精细化工研究所);甲醇(色谱纯,山东禹王实业有限公司,20140612083);磷酸二氢钾(分析纯,国药集团化学试剂有限公司,产品批号F20051215)。
1.3 动物SPF级雄性Wistar大鼠12只,体质量(220±20)g,购自辽宁长生生物科技有限公司,合格证号SCXK(辽)2010-0001。
2 方法与结果 2.1 试液的配制2.1.1 K-R试液[6] 称取氯化钙0.37 g、葡萄糖1.40 g溶解于200 mL纯化水中。另称取氯化钠7.80 g、氯化钾0.35 g、氯化镁0.02 g、碳酸氢钠1.37 g、磷酸二氢钠0.32 g溶解于800 mL纯化水中,待完全溶解后与上述氯化钙、葡萄糖溶液200 mL混合,用1.0 mol/L盐酸调节pH值至5.0。
2.1.2 空白肠灌流液大鼠禁食12 h后,根据“2.4.1”项下操作,用K-R试液进行小肠灌流,收集2 h内灌流液,即得空白肠灌流液。
2.1.3 头孢克洛标准储备液精密称取头孢克洛对照品12.5 mg,置25 mL量瓶中,用K-R试液溶解并稀释至刻度,即得浓度为500 μg/mL的头孢克洛标准贮备液,4 ℃冰箱内保存备用。
2.1.4 内标溶液精密称定头孢唑林钠12.5 mg,置于25 mL容量瓶中,用纯化水溶解并稀释至刻度,摇匀,制备成500 μg/mL的内标溶液。
2.1.5 供试液头孢克洛供试液 精密称取头孢克洛干混悬剂适量(约相当于头孢克洛30 mg)置100 mL量瓶中,加37 ℃水浴预热好的K-R试液溶解并稀释至刻度,混合均匀,即得头孢克洛浓度为300 μg/mL的供试液,现用现配。
头孢克洛+蒲地蓝供试液 精密称取头孢克洛干混悬剂适量(约相当于头孢克洛30 mg)置100 mL量瓶中,加入1.6 mL蒲地蓝消炎口服液,再加入37 ℃水浴预热好的K-R试液溶解并稀释至刻度,混合均匀即得,现用现配。
2.2 灌流液样品处理方法量取待测灌流液1 mL于1.5 mL EP管中, 10 000 r/min离心5 min,精密吸取90 μL上层离心后灌流液加入10 μL内标液,涡旋混匀30 s。
2.3 HPLC分析方法确定 2.3.1 色谱条件色谱柱为依利特Hypersil C4(4.6 mm×150 mm,5 μm);流动相为甲醇-0.05 mol/L磷酸二氢钾水溶液(15∶85);体积流量1.0 mL/min;检测波长265 nm;柱温室温;进样量20 μL。
2.3.2 专属性考察分别取空白肠灌流液、含头孢克洛和蒲地蓝的空白肠灌流液、头孢克洛和蒲地蓝小肠灌流45 min溶液,按照“2.3.1”项下色谱条件进行测定,考察空白肠灌流液及蒲地蓝对头孢克洛测定的干扰。头孢克洛的保留时间为5.504 min,内标物的保留时间为6.819 min,头孢克洛与内标物、蒲地蓝中各成分分离良好,分离度R>1.5,不受其干扰,符合测定要求。见图 1。
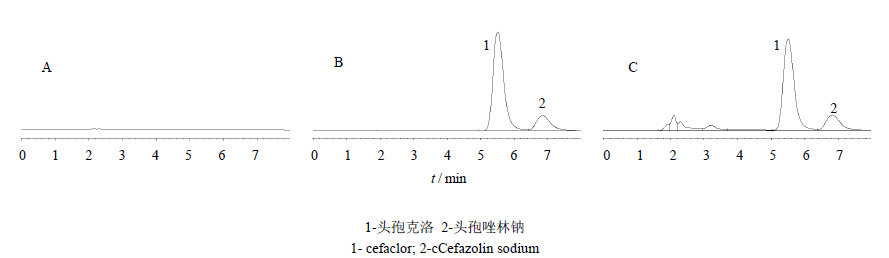 | 图 1 空白肠灌流液(A)、头孢克洛和蒲地蓝的空白肠灌流液(B)、头孢克洛和蒲地蓝小肠灌流45 min溶液(C)高效液相色谱图Fig. 1 HPLC of blank intestinal perfusate (A), cefaclor and Pudilan in blank intestinal perfusate (B), intestinal perfusate of cefaclor and Pudilan in 45 min (C) |
精密移取头孢克洛标准储备液或肠灌流液储备液适量,分别用K-R试液、空白肠灌流液配制成质量浓度为10、20、50、100、200、400、500 μg/mL的标准系列溶液。得到K-R试液中头孢克洛的标准曲线为:Y=0.017 3X-0.009 5(r=0.999),空白肠灌流液中头孢克洛的标准曲线为:Y=0.014 7X+0.029 5(r=0.996),结果表明头孢克洛在10~500 μg∙mL−1线性关系良好,最低检测限为10 μg/mL,满足准确度的要求以及测定的需要。
2.3.4 头孢克洛在K-R试液中稳定性考察用K-R试液配制头孢克洛质量浓度为300 μg/mL的溶液,置于37 ℃恒温水浴中,分别于0、1、2、3 h取样1 mL,将待测溶液与内标按9∶1的比例进行涡旋混匀,按照“2.3.1”项下方法进行测定,RSD值小于2%。说明头孢克洛在K-R试液中3 h内稳定性良好。
2.3.5 日内、日间精密度取头孢克洛标准储备液稀释成低、中、高(20、100、400 μg/mL)3个质量浓度的溶液,按照“2.3.1”项下方法进行测定,于1 d内不同时间测定5次,计算日内精密度;同法,每日1次,连续测定5 d,计算日间精密度。结果显示,各质量浓度下精密度RSD值均小于15%。
2.3.6 头孢克洛在肠灌流液中稳定性考察取头孢克洛标准储备液用空白肠灌流液配制成低、中、高(20、100、400 μg/mL)3个浓度的溶液,置于37 ℃恒温水浴中,分别于2、4 h取样1 mL,按“2.2”项下方法处理并按照“2.3.1”项下方法进行测定;同法测定头孢克洛肠灌流液样品在4、−20 ℃条件下的稳定性。结果显示RSD值均小于15%,说明头孢克洛在以上条件下稳定性良好。
2.3.7 管路的物理吸附性考察取供试液10 mL,连接蠕动泵及管路,调整体积流量为0.2 mL/min,考察30 min管路对头孢克洛的吸附情况,分别于0、10、20、30 min取样,按照“2.3.1”项下方法进行测定。在30 min内经管路损失的头孢克洛小于2%,结果显示蠕动泵管路对头孢克洛几乎无吸附作用。
2.4 大鼠在体肠吸收实验 2.4.1 实验方法取健康SPF级雄性Wistar大鼠,隔夜禁食12 h(期间可自由饮水),ip乌拉坦(1 g/kg即5 mL/kg)进行麻醉后,将其固定于鼠板上。沿腹中线打开腹腔约4 cm,充分暴露手术视野,结扎胆管。分离待考察肠段,十二指肠自幽门下1 cm开始,空肠段自幽门下15 cm起,回肠自盲肠上行20 cm开始。各肠段分别取长度约10 cm,对需要考察的肠段上下两端分别切口,并用37 ℃生理盐水清洗各肠段。试验肠段上下两端进行插管并结扎,入口处的插管与蠕动泵相连,出口处的插管接液体收集管。手术完成后,用浸有37 ℃生理盐水的脱脂棉覆盖于伤口上,并采用灯照进行保温。
手术完成后,先用待考察的灌流液平衡30 min,再改用已知质量装有供试液的小管进行灌流,出口处用已知质量的小管收集灌流液。灌流速度控制在0.2 mL/min,从第一滴供试液滴下时开始计时,每隔15 min迅速更换一次装有试液的小管和用来收集灌流液的小管,并称质量。计算泵入的供试液质量以及每15 min内收集得到的流出液的质量,直至105 min结束实验。将考察的肠段剪下,测量其长度(l)和内径(r)。
2.4.2 数据处理采用重量校正法用下式计算头孢克洛的Ka及Peff。
| ${C_{out\left( {corrected} \right)}} = \frac{{{C_{out}}{Q_{out}}}}{{{Q_{in}}}}$ |
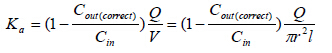

Qin和Qout分别为肠道进出口灌流液的体积(mL),Cin和Cout分别为肠道进出口灌流液的质量浓度(mg/L),Cout (Correct)为灌流液校正浓度(mg/L),A为小肠表面积,l和r和为被灌流肠段的长度(cm)和横截面半径(cm),Q为灌流速度(mL/min),V为灌流肠段的体积。采用t-test进行数据分析。
2.4.3 头孢克洛单独及联合应用时在大鼠各肠段吸收的考察分别用300 μg/mL的头孢克洛供试液和含有头孢克洛(300 μg/mL)和蒲地蓝的供试液,按照“2.4.1”项下的方法对大鼠进行各肠段的灌流,分别计算每15 min的Ka及Peff,取平均值,结果见图 2。
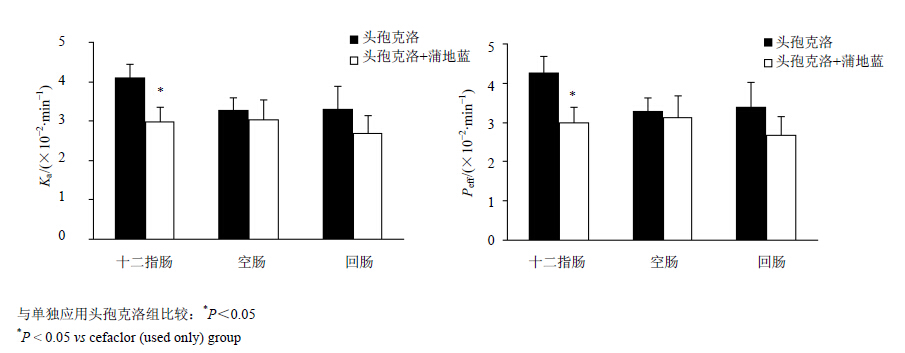 | 图 2 头孢克洛在不同肠段的吸收参数及蒲地蓝对头孢克洛吸收的影响(x±s,n=6)Fig. 2Absorption parameters of cefaclor in different intestinal segments and effects of Pudilan on absorption of cefaclor(x±s,n=6) |
本实验采用的定量方法为内标法,与外标法相比,内标法可以大大降低由于进样量改变或色谱条件改变所引起的误差。在本实验设定的色谱条件下,头孢克洛与内标物获得良好分离效果,该法能够得到更为精确的结果。
在评价药物吸收时,由于肠道不仅吸收药物,同时也会吸收或分泌水分,因此直接测得的药物浓度与实际药物浓度相比有偏差,需进行校正。校正方法主要有重量法和酚红法等其他标示物法。在实际的操作过程中,传统认为酚红不被吸收的观点已被实验证实是错误的[7, 8]。酚红不仅会有一定程度的吸收,在某些情况下也与药物发生反应。若要减少酚红的吸收,需用含Ca2+的KB缓冲液来抑制酚红的吸收[9],操作较为复杂,基于以上原因,近年来的实验多以重量法进行评价。采用重量法评价,方法准确可靠,操作简便。
根据文献[10]报道,头孢克洛在结肠处几乎无吸收,故本实验仅对十二指肠、空肠、回肠三个肠段进行考察。在大鼠手术过程中进行胆管结扎,可以排除胆汁对吸收的影响。为更好模拟人体环境,实验中灌流速度的选择应与肠蠕动速度相契合。在健康志愿者体内的灌流实验中[11],流速选定在2~3 mL/min,更接近人在空腹状态的情况。大鼠肠道约为人的十分之一,因此,在进行大鼠肠灌流过程中设置流速在0.2~0.3 mL/min更为合理。
K-R试液pH值的选择是基于头孢克洛在不同pH值的溶剂中降解速度不同决定的。根据文献报道[12],头孢克洛在pH<5的环境中稳定。当pH>6时,48 h后的含量降至40%以下。考虑到正常情况下的十二指肠pH 4~6,空肠pH6~7,回肠pH 6.5~7.5[13],故K-R试液pH值选择5.0。
头孢克洛在大鼠各肠段处均有吸收,吸收程度为十二指肠>空肠≈回肠。对各肠段参数进行统计学分析,均无显著性影响(P>0.05)。有文献[14]报道,头孢克洛在肠道吸收方式分为主动转运与被动扩散,其中被动扩散所起的作用并不明显,主要通过肠道寡肽转运蛋白Pept1介导吸收。另有文献[15]报道,Pept1转运体在肠管纵轴方向的表达量,小肠近端大于在小肠远端,这与本实验所测得结果基本相符。
在大鼠小肠处,药物吸收的程度可根据Peff值进行分类,Peff >0.2×10−4 cm/min可认为药物易于吸收,Peff<0.03×10−4 cm/min可认为药物难吸 收[16]。头孢克洛的Peff值远远大于0.2×10−4 cm/min,因此判定头孢克洛在大鼠小肠全肠段吸收良好。
联合应用蒲地蓝消炎口服液后,各肠段吸收均有所降低。联合应用与单独使用时对比,在空肠与回肠处,Ka、Peff值无统计学差异(P>0.05),在十二指肠处有显著性影响(P<0.05)。Pept1转运体是质子依赖型转运蛋白,以H+梯度为动力,因此pH对Pept1转运有较大影响[17]。蒲地蓝消炎口服液可能改变了肠道pH值,由于十二指肠环境为弱酸性,而空肠、回肠环境为中性偏弱碱性,因此对十二指肠处pH影响较大,使之H+浓度下调进而导致Pept1转运驱动能量不足,致使头孢克洛在十二指肠处吸收减少程度最大。此外,药物在吸收过程中是否存在其他转运体参与还需要进一步开展更深入的研究。
| [1] | 余俊先, 罗建平, 史丽敏, 等.基于PK/PD模型的头孢克洛给药方案 [J].中国临床药理学杂志, 2009, 25(6): 530-533. |
| [2] | Alanis A, Longest K A, Senetsr J E.A multi-center trial of cefaclor advanced formulation versus cefaclor in the treatment of acute bronchitis [J].Postgrad Med J, 1992, 68(suppl3): S24-29. |
| [3] | MacKenzie F M, Milne K E, Gould I M.Reassessment of cefaclor breakpoints for Haemophilus influenzae [J].J Chemother, 2004, 16(4): 329-333. |
| [4] | 中国药典[S].一部.2010. |
| [5] | 陈新谦, 金有豫, 汤 光, 等.新编药物学 [M].16版, 北京, 人民卫生出版社, 2007: 60. |
| [6] | 邹丽娟, 陈 颖, 杨 庆, 等.吴茱萸对黄连生物碱在大鼠肠道吸收中的影响研究 [J].中国实验方剂学杂志, 2012, 18(8): 147-151. |
| [7] | 黄嗣航, 龙晓英, 袁 飞, 等.酚红法和改良重量法分别研究葛根素的大鼠在体肠吸收机制 [J].广东药学院学报, 2012, 28(6): 603-607. |
| [8] | 林旭升, 蒋海松, 周建平.缬沙坦大鼠在体肠吸收动力学 [J].中国药科大学学报, 2012, 43(2): 130-136. |
| [9] | 胡熙曦, 金桂兰, 陈进兵, 等.三七总皂苷中人参皂苷Rg1大鼠在体肠吸收特征 [J].中国医院药学杂志, 2014, 34(12): 998-1001, 1023. |
| [10] | Sinko P J, Amidon G L.Characterization of the oral absorption of beta-lactam antibiotics.I.Cephalosporins: determination of intrinsic membrane absorption parameters in the rat intestine in situ [J].Pharm Res, 1988, 5(10): 645-650. |
| [11] | Dahan A, West B T, Amidon G L.Segmental-dependentmembrane permeability along the intestine following oraldrug administration: Evaluation of a triple single-pass intestinal perfusion(TSPIP) approach in the rat [J].Eur J Pharm Sci, 2009, 36(2-3): 320-329. |
| [12] | 张哲峰, 梁贵键, 鹿 颐, 等.反相高效液相色谱法分析测定头孢克洛 [J].中国抗生素杂志, 1996, 21(3): 188-190, 209. |
| [13] | 李 高.口服药物的吸收 [B].梁文权.生物药剂学与药物动力学 (第3版).北京, 人民卫生出版社, 2006. |
| [14] | 张秀红.β-内酰胺抗生素的肠道及肾脏转运机制 [J].中国临床药理学与治疗学, 2003, 8(3): 252-254. |
| [15] | 孙 筱.药用辅料对福辛普利钠肠道吸收影响的研究 [D].武汉: 华中科技大学, 2013. |
| [16] | Fagerholm U, Johansson M, Lennernas H.Comparison between permeability coefficients in rat and human jejunum [J].Pharm Res, 1996, 13(9): 1336-1342. |
| [17] | 王 威, 刘克辛.病理状态对肠寡肽转运体PEPT1活性的调节 [J].药物评价研究, 2011, 34(1): 39-43. |
 2015, Vol. 38
2015, Vol. 38


