Nintedanib(BIBF-1120、BIBF-1120 ES、Vargatef)是一种三联血管激酶抑制剂,可以阻止前血管生成受体酪氨酸激酶,在临床前研究中表现出独特的药理作用和药动特性[1]。2014年10月,美国FDA批准了该药用于治疗特发性肺纤维化(IPF),并于10月底在美国上市。该药在一系列临床研究中显示出良好的治疗前景,且安全性及耐受性均较好。就nintedanib的基础药学及临床评价做一简述,包括药理学研究、临床研究、安全性等。
1 药物概况通用名:nintedanib
商品名:OFEV®
化学名:methyl(3Z)-3-{[(4-{methyl[(4-methyl- piperazin-1-yl)acetyl]amino}phenyl)amino](phenyl) methylidene}-2-oxo-2,3-dihydro-1H-indole-6-carboxylate
分子式:C31H33N5O4,结构式:见图 1
CAS:656247-17-5(nintedanib)、656247-18-6 (nintedanib 乙烷磺酸盐)
相对分子质量:539.62
适应症:特发性肺纤维化(IPF)、非小细胞肺癌、肝细胞癌(HCC)、胰腺癌等
给药途径:口服
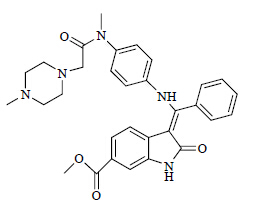 | 图 1 Nintedanib的结构Fig.1 Structure of nintedanib |
血管生成一直以来都被认为是癌症治疗的潜在靶向机制,被认为是肿瘤血管生成中的主要信号通路。血管内皮生长因子(VEGF)是一种多能生长因子,其功能包括提高内皮细胞的生存、繁殖和迁移。由于血管生成是许多癌症发展过程中的重要因素,一些抗VEGF治疗方法已经经过临床试验验证疗效后上市。因此近几十年以来制药公司已将VEGF作为治疗靶标。
其他与血管生成相关的多能生长因子还包括血小板源生长因子(PDGF)和纤维母细胞生长因子(FGF)。PDGF通过补充血管构建细胞来使新形成的血管成熟,FGF能够刺激内皮细胞的增殖。与VEGF一样,这些生长因子也作为小分子多酪氨酸激酶抑制剂的治疗靶标。该类抑制剂现在包括大量还在开发中的治疗各种适应症的化合物,以及已经授权使用的化合物。
尽管拥有良好的生物原理,针对VEGF的抗血管生成治疗仅显示出中等临床疗效,并且在多种疾病中表现出抗性[2]。在肺癌和胰腺癌等肿瘤中,通过交替的血管生成途径(PDGF、FGF等)[3,4,5]参与从抗VEGF治疗中的肿瘤逃逸。
IPF目前原因不明,主要表现为弥漫性肺泡炎和肺泡结构紊乱,并导致肺间质性纤维化进行性发展的一种致死性疾病,其发病率及死亡率日趋增高。至今尚无有效的治疗策略来阻止其自然进程和致死性。IPF的治疗方法主要有氧疗、肺康复疗法、肺移植等。传统药物如皮质激素、硫唑嘌呤或环磷酰胺治疗IPF的优点在随机对照试验中未得到肯定[6]。
勃林格殷格翰公司开发出nintedanib,作为一种作用于VEGFR、PDGFR、FGFR的小分子血管激酶抑制剂,用于治疗IPF,并且为一种潜在的肝衰竭和癌症治疗药物,包括转移性非小细胞肺癌(NSCLC)、卵巢癌、前列腺癌、结肠癌和肾细胞癌等。2013年10月,该药用于治疗NSCLC的申请在欧洲提交,于2014年6月被欧洲药品管理局(EMA)批准用于治疗IPF。
Nintedanib是一种三联血管激酶抑制剂,可以阻止前血管生成受体酪氨酸激酶(包括PDGFR、FGFR和VEGFR1/2/3),在临床前模型中表现出独特的药动学和药效特性[7,8]。这种三联血管激酶抑制剂目前处于Ⅲ期临床试验阶段,用于治疗NSCLC,以及与卡铂和紫杉醇联用治疗晚期卵巢癌。除了肿瘤生长抑制作用,nintedanib还可减少肺功能下降的趋势,从而降低IPF患者的急性发作[9]。
3 合成路线[10]N-甲基-4-硝基苯胺加入醋酸乙酯中并加热至70 ℃,在90 min内向上述溶液中加入氯乙酰氯,回流1 h,后处理得到化合物1。化合物1加入甲苯中并加热至40 ℃,在90 min内向上述溶液中逐滴加入1-甲基哌嗪。混合物在55 ℃下反应2 h,冷却至室温后用水洗,有机层用异丙醇萃取,然后加入Pd/C,H2还原得化合物2。
4-氯-3-硝基苯甲酸溶解于甲醇中,15 min内加入SOCl2,并且回流3 h,后处理得到化合物3。丙二酸、二甲基乙酯加入到热的叔戊醇钠的1-甲基-2-吡咯烷酮中,然后在75 ℃下加入化合物3,反应1.5 h得到化合物4。化合物4在Pd/C存在下,于115 ℃下通过H2还原2 h得化合物5。化合物5于室温下溶于甲苯中,然后加入氯乙酸酐,混合物加热回流3 h,后处理得到化合物6。化合物6于室温下溶于甲苯中,然后加入乙酸酐并且控制混合物的温度不能高于104 ℃,然后再60 min内加入原苯甲酸三甲酯,保持同一温度减半3 h,后处理得到化合物7。将KOH加入甲醇中并加热至63 ℃,然后将上述溶液加入到化合物7的甲醇溶液中,搅拌30 min,后处理得到化合物8。
化合物2、8在甲醇和DMF的混合溶液中加热至回流,反应7 h,后处理得到化合物9。将化合物9加入甲醇和水的混合溶液中并加热至60 ℃,然后加入乙基磺酸溶液,后处理得到目标化合物nintedanib。Nintedanib的合成路线见图 2。
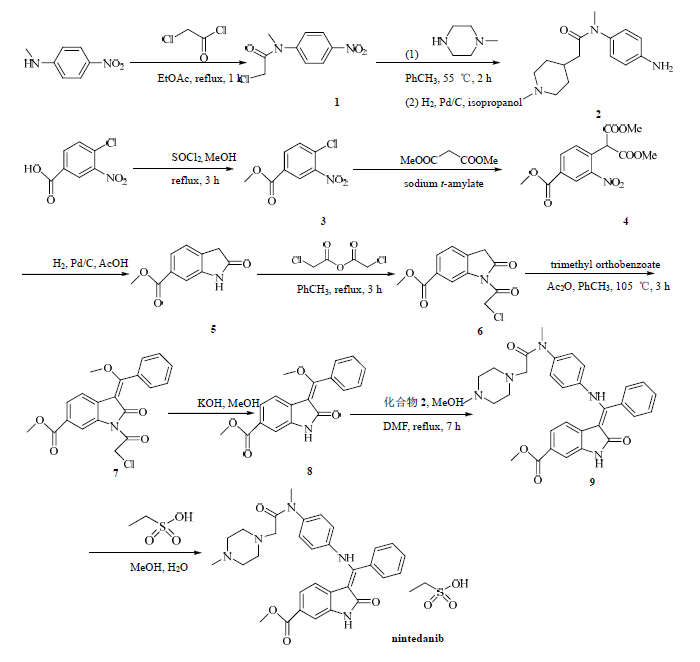 | 图 2 Nintedanib的合成路线Fig.2 Synthetic route of nintedanib |
最初的临床前测试主要集中于nintedanib对VEGFR、PDGGFR和FGFR的三联激酶选择性。在啮齿类动物激酶活性测试中,nintedanib能抑制人体特定的激酶,包括VEGFR的三种亚型,半数抑制量(IC50)为13~34 nmol/L,PDGFR的α和β亚型IC50分别为59、65 nmol/L,FGFR-1,-2,-3亚型的IC50分别为69、37、108 nmol/L。Nintedanib也能抑制Flt3,IC50为26 nmol/L,其突变能够导致急性髓系白血病的发展。Src家族成员(Src、Lyn、Lck)也被抑制,而受体酪氨酸激酶EGF,HER2,Ins,IGF-1或细胞周期激酶CDK1、2、4在低于1 000 nmol/L浓度下不被抑制[11]。
Nintedanib在与VEGF一同培养时,对HUVECs和人微血管内皮细胞的增殖和凋亡均表现出显著的抑制作用。对VEGFR的抑制作用能持续至少32 h,且首先抑制MAPK和Akt细胞信号通路的磷酸化。nintedanib也能将HUVECs的凋亡率从2%(对照组)提高到28%。另外nintedanib抑制牛视网膜周细胞的增殖,半数有效浓度(EC50)为79 nmol/L,牛视网膜周细胞对血管成熟和稳定表达PDGFRs,以及PDGF刺激的人脐动脉平滑肌细胞(HUASMCs)增殖具有重要作用(EC50=69 nmol/L)。另外,裂解的caspase 3水平也在FGF刺激的给予nintedanib的HUASMCs中被上调,在FGF和PDGF诱导的HUASMC增殖中,MAPK活性在nintedanib浓度为100~300 nmol/L时被抑制。当用不表达VEGFR、FGFR或PDGFR的人上皮癌细胞系(如FaDu、Calu6、HeLa)作为对照时,浓度为3 500 nmol/L的nintedanib不表现出抑制作用[10]。
Nintedanib与紫杉醇联用在VEGF刺激的HUVEC中对肿瘤增殖和诱导细胞凋亡具有叠加作用(抑制率与单独治疗相比提高3~5倍,细胞凋亡率与单独治疗相比提高2倍)。这种次优剂量下的联用治疗也在HUVEC和人大细胞肺癌细胞(NCI-H460)中表现出对细胞增殖的协同作用[11]。在将nintedanib(25 mg/kg,ig,2次/d)与多烯紫杉醇(7.5 mg/kg,iv,每周1次)和培美曲塞(100或150 mg/kg,ip给药5 d)联用应用于小鼠NCI-H460和人肺退行性癌细胞(Calu6)异种移植模型的研究中,也观察到联用治疗较单独治疗对降低肿瘤血管密度和促进细胞凋亡有叠加效应[12,13]。
Nintedanib在肝细胞癌中的体外抗肿瘤作用在集中肝癌细胞系(HLE、HLF、HepG2、Huh7)中被检测,体内抗肿瘤作用使用小鼠模型。Nintedanib显示出较差的体外生长抑制活性,IC50值为2~10 mmol/L,但在ig 50 mg/(kg·d),用药2周对HepG2肿瘤体内生长表现出显著抑制作用。
Nintedanib的抗血管生成和抗增殖作用在动物移植瘤模型中被评价,在荷人头颈鳞状细胞癌(FaDu)小鼠体内,ig给药nintedanib 50或100 mg/kg,1次/d,给药超过20 d,与对照组相比能显著抑制肿瘤生长。类似的抑制作用还表现在其他的人移植瘤体内模型,如肾细胞癌Caki1、结肠直肠癌HT29、卵巢SKOV3、非小细胞肺癌Calu6和前列腺癌 PAC120[11, 14]。
4.2 药动学Nintedanib的药动学性质在健康受试志愿者、IPF患者以及癌症患者中类似,呈线性。剂量比例由nintedanib的暴露剂量升高来显示(剂量范围为50~450 mg 1次/d和150~300 mg 2次/d)。多次给药在IPF患者中的药物积累浓度为药时曲线下面积(AUC)的1.76倍。给药1周之内得到稳态血药浓度。1年以上的nintedanib谷浓度仍稳定。Nintedanib的药动学个体差异为中到高级(标准药动学参数的变动系数为30%~70%),或低到中级(标准药动学参数的变动系数低于40%)。
5 临床评价 5.1 Ⅰ期临床Ⅰ期临床试验表明,在61名晚期实体肿瘤患者中,25名接受nintedanib给药1次/d,36名接受2次/d,28 d为1疗程结束后,停止给药1周。在疾病无进展情况下可进行后续疗程。Nintedanib引起1例肾细胞癌患者完全应答,1例肾细胞癌和1例结肠癌患者部分应答。对42名患者进行DCE-MRI检查,其中55%的目标病变肿瘤血流量减少。在30名晚期结肠癌患者的亚组分析中,50%的患者经过2个疗程治疗,1次/d和2次/d给药的平均进展时间分别为65、107 d。DCE-MRI分析表明在21名患者中有15名的目标病变肿瘤的血流和渗透性下降了40%。
Ⅰ期临床试验表明,在22名晚期妇科恶性肿瘤患者中,口服给予nintedanib(100、150、200或250 mg,2次/d)联合口服多烯紫杉醇(100、150、200或250 mg,2次/d)和iv卡铂(AUC 5 min·mg/mL,每3周给药1次)治疗,7名患者发生响应,其中1名卵巢癌患者完全响应,4名卵巢癌患者(2名150 mg,2名200 mg)部分响应。对生物标志物癌抗原CA125的检测表明10名被评价卵巢癌患者具有响应,其中9名持续到试验结束。在5名疾病进展患者中,无进展时间为177~182 d[15,16]。
5.2 Ⅱ期临床在随机双盲多中心Ⅱ期临床试验中,nintedanib治疗74名接受过一或二线化疗的晚期或转移性NSCLC患者。主要测试指标为无进展生存率和实体瘤的疗效评价标准(RECIST),每6周检测1次。次要测试指标包括整体生存率。在73名患者的数据中,中位无进展生存率为1.6个月,各治疗组之间无显著差别,总生存率为5.5个月,无目标肿瘤响应的稳定疾病率为48%。在57例ECOG表现为0(活动能力完全正常,与起病前活动能力无任何差异)或1(能自由走动及从事轻体力活动,包括一般家务或办公室工作,但不能从事较重的体力活动)的患者中,无进展生存率为2.9个月,总生存率为9.5个月,稳定疾病率为59%[17]。
一项Ⅱ期随机双盲安慰剂对照平行临床试验用来评价口服nintedanib 250 mg、2次/d治疗84例复发卵巢癌化疗后病人连续9个月的效果。合格的患者必须对化疗有部分或完整响应(根据RECIST标准),或表现出CA125确认下降至少50%。Nintedanib和安慰剂的9个月的无进展生存率分别为15.6%和2.9%。给予nintedanib患者的进展中位时间为4.8个月,安慰剂组患者进展中位时间为2.8个月[18]。
5.3 Ⅲ期临床两项Ⅲ期随机双盲安慰剂对照平行临床试验(预期n=1 300)用来评价nintedanib与标准化疗联用对晚期NSCLC患者(ⅢB/IV期、ECOG为0或1)的疗效。第一项(NCT00805194)研究比较了nintedanib与多烯紫杉醇联用和安慰剂与多烯紫杉醇联用的疗效。第二项(NCT00806819)研究比较了nintedanib与培美曲塞联用和等剂量安慰剂与培美曲塞联用的疗效。两项试验的主要测试指标均为超过6个月的无进展生存率,次要测试指标为12个月以上的总生存率、肿瘤响应、生存质量、安全性以及药动学。
另外一项随机双盲安慰剂对照平行Ⅲ期临床试验(NCT01015118)用来评价nintedanib与多烯紫杉醇和卡铂联用治疗卵巢癌的疗效,预期招募到1 300名患者。主要测试超过41个月的无进展生存率,以及总生存率、肿瘤标志物进展时间、目标响应等,预计于2016年6月完成。
6 安全性在一项对30名结肠癌患者的临床试验中,14名患者1次/d,16名患者2次/d给予nintedanib,最常见的药物相关不良反应是恶心、呕吐和腹泻,大部分药物相关不良反应(包括全部的胃肠道反应)在强度上为CTC 1级(轻度)或2级(中度),大多数不良反应发生在第一个治疗阶段。大于CTC 3级(重度)的不良反应在3例患者中出现,均为接受2次/d给药。2名患者表现为CTC1级的高血压反应,没有相关死亡报道。
在14名1次/d给药患者中,有4名丙氨酸氨基转移酶(ALT)和/或天门冬氨酸氨基转移酶(AST)升高,≥CTC 3级,而在16名2次/d给药患者中没有>CTC 2级的ALT/AST升高。在2次/d给药患者中,肝酶的升高主要表现在第一个给药阶段。两组给药组均未观察到胆红素和碱性磷酸酶的升高[19]。
7 结语包括抗VEGF单克隆抗体在内的抗血管生成治疗方法目前已被FDA批准用于治疗肺癌、结肠癌、肾癌、甲状腺癌、脑癌以及其他实体瘤等。然而在许多情况下这类药物的临床使用由于各种原因受到限制,如药物毒性较大、缺乏预测生物标志物、临床收益有限等。这些因素可能与内在或逃避抗性相关。逃避抗性可能由缺氧造成的上皮细胞-间充质转化(EMT)驱使表型变化引起,成为有效的抗血管治疗的结果之一。一种三联血管生成抑制剂nintedanib可抑制VEGFR、PDGFR、FGFR,减缓原发性肿瘤生长和转移,降低微血管密度和成纤维细胞活化,诱导缺氧。这些效果可能与其多靶点性质有关。同时现有数据表明,nintedanib能够被良好耐受,安全性较好,针对疾病包括癌症以及其他难以治疗的慢性病,目前仍在进行中的广泛的临床试验预期取得较好的治疗效果。目前该药已被FDA、EMA批准在美国及欧洲上市,用于治疗特发性肺纤维化、非小细胞肺癌等疾病,具有广泛的市场前景。
| [1] | Cenik B K, Ostapoff K T, Gerber D E, et al. BIBF 1120 (Nintedanib), a triple angiokinase inhibitor, induces hypoxia but not EMT and blocks progression of preclinical models of lung and pancreatic cancer[J]. Mol Cancer Ther, 2013, 12(6): 992-1001. |
| [2] | Bergers G, Hanahan D. Modes of resistance to anti-angiogenic therapy[J]. Nat Rev Cancer, 2008, 8: 592-603. |
| [3] | Bergers G, Song S, Meyer-Morse N, et al. Benefits of targeting both pericytes and endothelial cells in the tumor vasculature with kinase inhibitors[J]. J Clin Invest, 2003, 111: 1287-1295. |
| [4] | Erber R, Thurnher A, Katsen A D, et al. Combined inhibition of VEGF and PDGF signaling enforces tumor vessel regression by interfering with pericyte-mediated endothelial cell survival mechanisms[J]. FASEB J, 2004, 18: 338-340. |
| [5] | Casanovas O, Hicklin D J, Bergers G, et al. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors[J]. Cancer Cell, 2005, 8: 299-309. |
| [6] | Joseph M, Pilewski M J, Liu L X, et al. Insulin-like growth factor binding proteins 3 and 5 are overexpressed in idiopathic pulmonary fibrosis and contribute to extracellular matrix deposition[J]. Am J Pathol, 2005, 166(2): 399-407 |
| [7] | Hilberg F, Roth G J, Krssak M, et al. BIBF 1120: triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy[J]. Cancer Res, 2008, 68: 4774-4782. |
| [8] | Roth G J, Heckel A, Colbatzky F, et al. Design, synthesis, and evaluation of indolinones as triple angiokinase inhibitors and the discovery of a highly specific 6-methoxycarbonylsubstituted indolinone (BIBF 1120)[J]. J Med Chem, 2009, 52: 4466-4480. |
| [9] | Richeldi L, Costabel U, Selman M, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis[J]. N Engl J Med, 2011, 365: 1079-1087. |
| [10] | Merten J, Linz G, Schnaubelt J, et al. Process for the preparation of (Z)-3-[1-[4-[N-[(4-methylpiperazin-1-yl) methylcarbonyl]-N-methylamino]anilino]-1-phenylmethylene]-6-methoxycarbonyl-2-indolinone[P]. WO: 2009071523, 2008-12-02. |
| [11] | Hilberg F, Roth G J, Krssak M, et al. BIBF 1120: Triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy[J]. Cancer Res, 2008, 68(12): 4774-4782. |
| [12] | Hilberg F, Brandstetter I. Efficacy of bibf 1120, a potent triple angiokinase inhibitor, in models of human non-small cell lung cancer is augmented by chemotherapy[J]. J Thoracic Oncol, 2007, 2(8): S380. |
| [13] | Hilberg F, Brandsetter I, Roth G J. In vitro and in vivo efficacy of BIBF 1120, a small molecule triple angiokinase inhibitor[J]. Clin Cancer Res, 2005, 11(23 suppl): A 19. |
| [14] | Roth G J, Heckel A, Colbatzky F, et al. Design, synthesis, and evaluation of indolinones as triple angiokinase inhibitors and the discovery of a highly specific 6-Methoxycarbonyl-Substituted Indolinone (BIBF 1120)[J]. J Med Chem, 2009, 52(14): 4466-4480. |
| [15] | Harter P, Huober J, Pfisterer J, et al. A phase I dose escalation and pharmacokinetic study of BIBF 1120 in combination with paclitaxel and carboplatin in patients with advanced gynecological malignancies[J]. Am Soc Clin Oncol, 2007, 43(3): 3561. |
| [16] | Du Bois A, Huober J, Stopfer P, et al. A phase I open-label dose-escalation study of oral BIBF 1120 combined with standard paclitaxel and carboplatin in patients with advanced gynecological malignancies[J]. Ann Oncol, 2010, 21(2): 370-375. |
| [17] | Von Pawel J, Kaiser R, Eschbach C, et al. A double blind phase II study of BIBF 1,120 in patients suffering from relapsed advanced non-small cell lung cancer (NSCLC)[J]. Am Soc Clin Oncol, 2007, 43(3): 7635. |
| [18] | Ledermann J A, Rustin G J, Hackshaw A, et al. A randomized phase II placebocontrolled trial using maintenance therapy to evaluate the vascular targeting agent BIBF 1120 following treatment of relapsed ovarian cancer (OC)[C]. Orlando: American Society Clinical Oncology Annual Meeting, 2009-06-01: 5501. |
| [19] | Mross K, Büchert M, Frost A, et al. Vascular effects, efficacy and safety of nintedanib in patients with advanced, refractory colorectal cancer: a prospective phase I subanalysis[J]. BMC Cancer, 2014, 14: 510-519. |
 2015, Vol. 38
2015, Vol. 38

