2. 广州医科大学药物研究中心, 广东 广州 510182
2. The Pharmaceutical Research Center of Guangzhou Medical University, Guangzhou 510182, China
人体产生的自由基及其诱导的氧化反应与多种疾病密切相关,并可加速人体衰老。衰老始终对人类的健康构成重大威胁。研究发现[1, 2],衰老程度与人体产生的自由基及其诱导的氧化反应密切相关。人体内的各种氧化反应可以导致机体产生氧化损伤,诱发氧化应激,继而导致各类疾病,从而加速人的衰老。
近年来,寻找和开发天然植物抗氧化剂,消除氧自由基对机体的损害作用,已逐渐成为研究热点,我国中草药资源极其丰富,是天然抗氧化剂的重要来源之一。野牡丹Melastoma candidum D. Don在华南地区广泛存在,其活性成分为多糖、黄酮类、氨基酸、脂肪族、甾体、酚类、常量和微量元素、色素等[3],临床多利用其清热解毒、利湿消肿等功效,主治肠炎、痢疾等疾病[4],其中含量丰富的黄酮类化合物组分具有较高的抗氧化、抗衰老开发应用价值[5],但目前暂未有此方面的应用开发。
本文利用醇提结合超声浸提的方法提取野牡丹总黄酮,以维生素C(Vc)和芦丁为对照,采用自由基清除能力法(DPPH)和抗氧化剂还原能力法(FRAP)来评估野牡丹活性提取物的体外抗氧化活性,为野牡丹的开发利用提供依据。
1 仪器和试剂VGT—103A型超声波清洗器(深圳市威固特超声波科技开发有限公司);UV757CRT型紫外可见分光光度计(上海精密科学仪器有限公司);PHS—3C酸度计(上海佑科仪器公司);微量移液器(Eppendorf公司)。
二苯代苦味酰基自由基(1, 1-pheny-2- picrylhydrazyl,DPPH,Tokyo Chemical Industry,批号U6GVH-HK);FRAP工作液(300 mmol/L醋酸盐缓冲液,10 mmol/L TPTZ,20 mmol/L FeCl3,临用时现配);TPTZ(2, 4, 6-tripyridyl-s-trizine,萨恩化学技术有限公司,批号BI130025);Vc(中国医药集团上海化学试剂公司,批号20120628);芦丁(成都曼思特生物科技有限公司,批号11040302);野牡丹提取液(自制)。
2 方法 2.1 野牡丹提取液总黄酮的测定野牡丹提取液总黄酮的测定采用铝盐显色 法[6]。精密称取芦丁对照品12.5 mg,置于100 mL量瓶中,用体积分数为50%甲醇溶液定容至刻度,摇匀,配成质量浓度为0.125 mg/mL的芦丁标准贮备液,分别准确吸取1.0、2.0、3.0、4.0、5.0 mL于10 mL量瓶中,加入0.3 mL质量分数为5%NaNO2溶液,摇匀,静置5 min后,加质量分数为10%AlCl3甲醇溶液0.3 mL,摇匀静置5 min,再加1.0 mol/L NaOH溶液4.0 mL,用50%甲醇定容至刻度,此时芦丁的质量浓度依次为12.5、25.0、37.5、50.0、62.5 μg/mL,摇匀静置10 min,采用试剂为空白参比,在200~800 nm波长扫描,选择最佳吸收峰波长,并在此波长下绘制工作曲线。
称取50 g经烘干粉碎后过50目筛的野牡丹药材粗粉,按液固体积比5∶1加入95%乙醇,水浴加热回流1 h后,滤过,收集滤液,重复操作一次;取滤渣按液固体积比10∶1加入体积分数50%乙醇浸提过夜后超声波提取1 h,滤过,收集滤液;合并滤液,减压真空浓缩到200 mL,得野牡丹提取液。吸取0.1 mL野牡丹提取液,置于10 mL量瓶中,按上述显色方法测定吸光度值,代入芦丁标准曲线,计算提取液总黄酮的量,结果以芦丁当量/干材料表示,单位为mg/g。
2.2 DPPH自由基法评估野牡丹的抗氧化活性DPPH自由基是一种稳定存在的有机自由基,其乙醇溶液呈深紫色,在特定波长处有强吸收,当加入抗氧化剂后吸收峰值下降,下降程度直接反映样品清除自由基能力的大小[7]。各物质对DPPH•的清除能力大小是其抗氧化能力强弱的评价指标之一,可用清除率表示,清除率高则抗氧化能力强。
2.2.1 最佳吸收波长的选择分别将Vc、芦丁、野牡丹提取液和DPPH自由基无水乙醇溶液混合,待反应稳定后,采用试剂空白作为参比,在200~800 nm波长扫描,选择最佳测定吸收波长。
2.2.2 DPPH自由基与待测样品的紫外吸收精密称取5.0 mg DPPH,采用无水乙醇定容至100 mL,配成质量浓度为50 mg/L的DPPH无水乙醇溶液作为标准贮备液,本溶液需要临用时现配。
精密移取50 mg/L的DPPH无水乙醇溶液4.0 mL,加入质量浓度分别为5、10、20、40、60、80、100、200 μg/mL野牡丹提取液(以总黄酮计)1.0 mL,使得反应体系的终体积为5 mL,充分混匀,记录加入野牡丹提取液后1、3、5、10、15、20、25、30 min时在波长517 nm处测定吸光度值,同时平行测定空白对照管和试剂空白管的吸光度值,按下式计算对野牡丹提取液对DPPH自由基的清除率。
清除率=1-(Ai-Aj)/A0
A0为4.0 mL 50 mg/L DPPH•乙醇溶液+1.0 mL空白试剂的吸光度值;Ai为4.0 mL 50 mg/L DPPH•乙醇溶液+1.0 mL样液的吸光度值;Aj为4.0 mL无水乙醇溶液+1.0 mL样液的吸光度值。
分别配制质量浓度为5、10、20、40、60、80、100、200 μg/mL芦丁溶液和VC溶液作为对照检测液,按上述方法分别测定8个浓度下的两种对照检测液在不同时间对DPPH自由基的清除率。
为了更好的比较三者的抗氧化能力,以半数清除浓度(IC50)来表征其清除能力大小,将8个不同浓度的样品溶液测得的DPPH 自由基的清除率采用非线性回归分析得出各自的IC50值,IC50值越小,表示其清除自由基的能力越强[8]。
2.3 铁还原/抗氧化能力分析法评估野牡丹的抗氧化活性采用铁还原/抗氧化能力(Ferric reducing/ antioxidant power,FRAP)分析法评估所选野牡丹提取液的总抗氧化活性[9]。该分析方法的原理是抗氧化物质将Fe3+还原为Fe2+,Fe2+与三吡啶三吖嗪(TPTZ)结合生成蓝色络合物,该化合物在593 nm处有最大吸收,吸光度值的大小反应了该抗氧化剂的还原能力大小。
2.3.1 FRAP工作液的配制分别配制300 mmol/L的醋酸盐缓冲溶液(pH 3.6)、10 mmol/L的TPTZ溶液和20 mmol/L的FeCl3溶液,将上述3种溶液按体积比10∶1∶1混合,并水浴加热至37 ℃, 备用。
2.3.2 铁标准溶液的配制精密称取0.027 81 g FeSO4•7H2O粉末,用超纯水溶解,转移至100 mL量瓶中,配成浓度为1 mmol/L的贮备液。分别精密移取1.0、2.0、4.0、6.0、8.0、10.0 mL至10 mL量瓶中,配制成浓度为0.1、0.2、0.4、0.6、0.8、1.0 mmol/L的铁标准溶液,备用。
2.3.3 抗氧化活性的评估精密移取上述系列溶度铁标准溶液各0.1 mL,加入FRAP工作液3 mL,混匀37 ℃反应完全,使用超纯水作空白,于400~800 nm扫描得到最大吸收波长,于此波长处测定各吸光度值,绘制FeSO4的标准曲线。
分别配制质量浓度为5、10、20、40、60、80、100、200 μg/mL的野牡丹提取液、芦丁溶液和Vc溶液作为FRAP检测液。分别量取检测液0.1 mL,加入3 mL FRAP工作液,混匀后使用超纯水作空白,在最大吸收波长处测定其在37 ℃下反应不同时间的吸光度值,代入FeSO4标准曲线求算成当量FeSO4值,以对不同浓度的不同样品对Fe3+的还原能力随时间的变化关系进行比较研究,样品的当量FeSO4值越大表示其还原能力越强。
3 结果 3.1 野牡丹提取液总黄酮的测定野牡丹提取液总黄酮的测定采用硝酸铝显色法,以试剂参比为空白,在200~800 nm扫描发现在510 nm处有最大吸收,在该波长下测定吸光度无杂质干扰。测定芦丁对照品系列溶液的吸光度值,得回归方程为A=13.04C+0.012 2,R2= 0.999 2。测定野牡丹提取液的吸光度,根据标准曲线及稀释倍数测得野牡丹药材总黄酮提取率为9.72 mg/g。
3.2 最佳吸收波长的选择Vc、芦丁、野牡丹提取液和DPPH自由基无水乙醇溶液混合后经紫外扫描发现,DPPH自由基溶液的最大吸收波长在327 nm和517 nm附近。而野牡丹提取液、芦丁以及Vc溶液在517 nm处基本没有吸收,不会干扰DPPH自由基溶液在517 nm处吸收度的检测。因此本实验选择517 nm处的吸光度值来表征DPPH自由基的变化。
3.3 野牡丹提取液的抗DPPH自由基能力不同浓度的野牡丹提取液(以总黄酮计)对于DPPH自由基的清除率随时间变化见图 1。可以看出,低质量浓度时(总黄酮量为5~60 μg/mL)的野牡丹提取液,DPPH自由基清除率在20 min左右基本达到稳定,随着野牡丹提取液质量浓度的增加,DPPH自由基的清除率也逐渐提高,加入高质量浓度的野牡丹提取液时(总黄酮量为60 μg/mL以上),DPPH•清除率在5 min左右达到稳定,极高质量浓度时1 min左右就能达到稳定,达到稳定状态时DPPH自由基的清除率最高为83.80%。
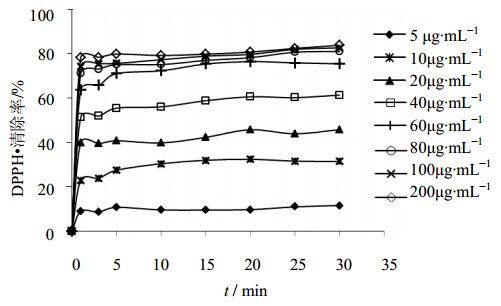 | 图 1 野牡丹提取液对DPPH自由基的清除作用Fig. 1 Effectof extract from M. candidum on DPPH scavenging activity |
芦丁溶液加入到DPPH自由基溶液中,其对于DPPH自由基的清除率随时间变化见图 2,低质量浓度(5~60 μg/mL)时,同样需要约20 min左右DPPH清除率才不会出现大幅度变化,高质量浓度(80~200 μg/mL)时,DPPH自由基清除率在5 min左右也能达到稳定,达到稳定状态时DPPH自由基的清除率最高为81.67%。
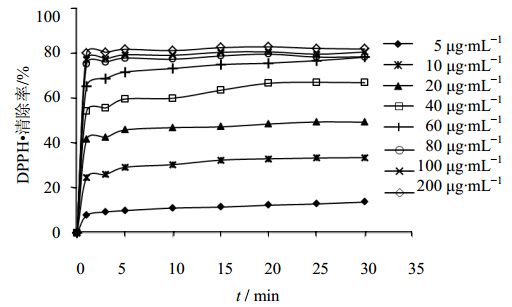 | 图 2 芦丁对DPPH自由基的清除作用Fig. 2 Effect of rutin on DPPH·scavenging activity |
Vc属于一种快速抗氧化剂,清除自由基的速度很快,向DPPH自由基溶液中加入Vc后DPPH自由基的清除率随时间变化见图 3,可以看出,Vc加入到DPPH自由基溶液中后,DPPH自由基清除率迅速上升,并且很快就可以达到稳定,即使是质量浓度低至5 μg/mL时,也能够在1 min左右即达到稳定,随着时间的延长DPPH自由基清除率变化很小。且Vc加入量从5 μg/mL增大到60 μg/mL时,DPPH自由基清除率升高的幅度很大,继续提高Vc的浓度,DPPH自由基清除率升高的幅度无明显 变化。
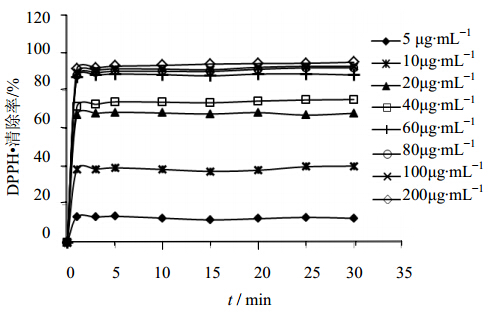 | 图 3 Vc对DPPH自由基的清除作用Fig. 3 Effect of Vc on DPPH·scavenging activity |
达到稳态(20 min)时Vc、芦丁、野牡丹提取液等3种抗氧化剂对DPPH自由基的清除作用见图 4,从图中可以看出,3种抗氧化剂对DPPH自由基的清除作用都随着质量浓度升高而逐渐增强,在质量浓度为100 μg/mL时,野牡丹提取液等3种抗氧化剂对DPPH自由基清除率均在80%以上,具有较强的自由基清除能力,IC50值见表 1。
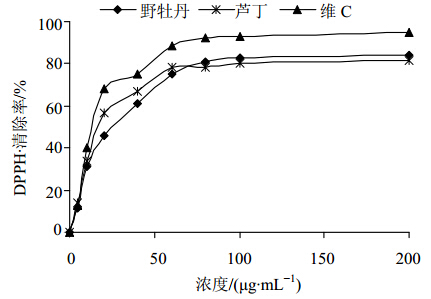 | 图 4 3种抗氧化剂对DPPH自由基的清除曲线Fig. 4 Curvesof scavenging effects of three antioxidants on DPPH· |
| 表 1 3种抗氧化剂对DPPH自由基清除能力比较 Table 1 Comparison of three antioxidants with DPPH·scavenging capacity |
表 1中所示的IC50值越小,样品清除自由基的能力越强。各样品清除DPPH自由基的能力为:Vc>芦丁>野牡丹提取液;质量浓度为100 μg/mL的样品溶液,最终自由基清除率大小为Vc>野牡丹提取液>芦丁,说明野牡丹提取液的抗氧化能力和芦丁相当。
将低质量浓度的野牡丹提取液、芦丁溶液(质量浓度为10~60 μg/mL)分别与DPPH自由基的清除率在达到稳态后(20 min的数据)进行线性回归,回归方程分别为SR=876.49C+24.28,R2=0.991 4(野牡丹提取液),和SR=886.71C+27.47,R2=0.973 3(芦丁),说明两种样品对DPPH自由基的清除率分别与总黄酮和芦丁的质量浓度具有一定的相关性。
3.4 FRAP法评估野牡丹的抗氧化活性铁标准溶液加入FRAP工作液显色后,最大吸收波长为593 nm,于此波长测定系列铁标准溶液的吸光度值,得FeSO4标准溶液的标准曲线为A=0.583 7C+0.121 6,R2=0.999 6,结果线性良好,方法可靠。
不同浓度的野牡丹提取液(浓度以总黄酮计)、芦丁溶液和Vc溶液对Fe3+的还原能力随时间的变化见图 5~7。比较研究发现,当野牡丹提取液和芦丁加入到FRAP工作液中后,FeSO4当量随样品浓度的增加而增加,不同质量浓度的样品待测液在30 min后仍有升高的趋势,并未达到稳定平衡状态,单位时间内低浓度的野牡丹提取液对应的FeSO4当量升高幅度与芦丁相近,高浓度的野牡丹提取液对应的FeSO4当量升高幅度明显高于芦丁,说明野牡丹提取液的抗氧化能力可能优于芦丁。而Vc为快速抗氧化剂,向FRAP工作液中加入不同浓度的Vc溶液后,FeSO4当量都迅速增大,1 min即迅速达到稳定,随着时间的延长FeSO4当量变化不大,而增加Vc的加入量,当量FeSO4明显升高。
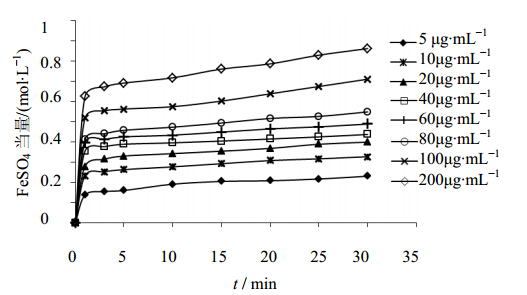 | 图 5 不同浓度的野牡丹提取液还原Fe3+能力曲线图Fig. 5 Curvesof Fe3+ reducing power of extract from M. candidum at different concentration |
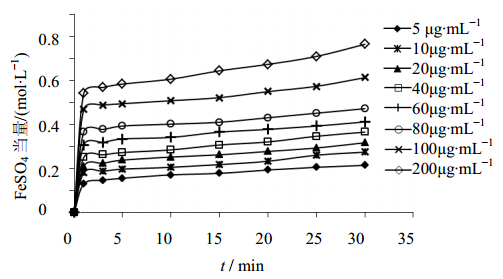 | 图 6 不同浓度的芦丁溶液还原Fe3+能力曲线图Fig. 6 Curvesof Fe3+ reducing power of rutin at different concentration |
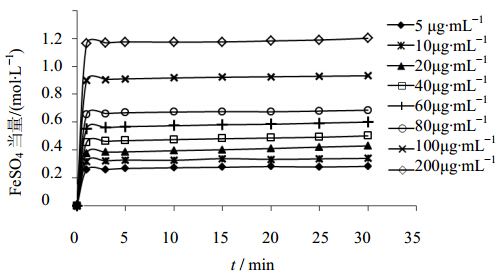 | 图 7 不同浓度的Vc溶液还原Fe3+能力曲线图Fig. 7 Curvesof Fe3+ reducing power of Vc at different concentration |
野牡丹提取液、芦丁溶液对铁离子的还原能力与质量浓度(10~100 μg/mL)也呈良好的量效关系,回归得到的线性方程分别为:Y=6.036 1X+0.167 9,R2=0.992 6(野牡丹提取液液),Y=5.361 5X+0.120 8,R2=0.993 9(芦丁)。
以对应0.5 mol/L FeSO4当量对应的各样品质量浓度来比较各个样品的相对抗氧化能力,结果分别为:野牡丹提取液中总黄酮的质量浓度55 μg/mL;芦丁质量浓度70 μg/mL;Vc的质量浓度37 μg/mL;各个样品的相对抗氧化能力为:Vc>野牡丹提取液>芦丁。
4 结论本实验采用DPPH自由基清除率和FRAP模型,以Vc和芦丁作为比较对照,测定了野牡丹提取液的抗氧化活性。发现野牡丹提取液对DPPH自由基有较好的清除率,对Fe3+具有较好的还原能力,其抗氧化活性在一定浓度范围内与黄酮的含量具有较好的相关性。野牡丹药材强的抗氧化能力可能与其含有较高的黄酮类成分有关,野牡丹药材具有的强抗氧化能力,有进一步研究和开发的价值。
| [1] | Perera R M, Bardeesy N. Cancer: when antioxidants are bad [J]. Nature, 2011, 475(7354): 43-44. |
| [2] | Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants in normal physiological functions and human disease [J]. Int J Biochem Cell Biol, 2007, 39: 44-84. |
| [3] | Joffry S M, Yob N, Rofiee M S, et al. Melastoma malabathricum (L. ) Smith ethnomedicinal uses, chemical constituents, and pharmacological properties: a review [J]. Evidence-based Compl Altmed, 2012, 9(1): 1-48. |
| [4] | 国家医药管理局《中华本草》编委会. 中华本草 [M]. 第5卷. 上海: 上海科技出版社, 20005. |
| [5] | Lee M H, Lin R D, Shen L Y, et al. Monoamine oxidase B and free radical scavenging activities of natural flavonoids in Melastoma candidum D. Don [J]. J Agric Food Chem, 2001, 49(11): 5551-5555. |
| [6] | Jia Z, Tang M, Wu J. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals [J]. Food Chem, 1999, 64: 555-559. |
| [7] | Chen Y, Wang M F, Rosen R T, et al. 2, 2-dipheny-l 1-picryl-hydrazyl radical scavenging active components from Polygo-num multiflorum Thunb. [J]. J Agric Food Chem, 1999, 47: 2226-2228. |
| [8] | Mishra K, Ojha H, Chaudhury N K, et al. Estimation of antiradical properties of antioxidants using DPPH assay: A critical review and results [J]. Food Chem, 2012, 130(4): 1036-1043.Benzie I F, Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAPassay [J]. Anal Biochem, 1996, 239: 70-76. |
 2014, Vol. 37
2014, Vol. 37


