2. 天津医科大学 药学院, 天津 300070;
3. 天津药物研究院, 天津 300193
2. College of Pharmacy, Tianjin Medical University, Tianjin 300070, China;
3. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
通用名:vibegron
别名:MK-4618、KRP114V
CAS:1190389-15-1
化学名:(6S)-N-[4-([(2S,5R)-5-[(R)-Hydroxy (phenyl) methyl]pyrrolidin-2-yl]methyl)phenyl]-4-oxo-4,6,7,8- tetrahydropyrrolo[1,2-a]pyrimidine-6-carboxamide
分子式:C26H28N4O3
相对分子质量:444.53
结构见图 1
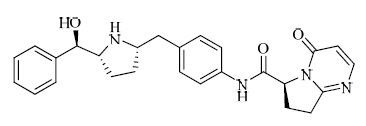
|
图 1 vibegron的结构 Fig. 1 Structure of vibegron |
原研公司:Merck Sharp & Dohme Corp.
药理分类:β3肾上腺素能受体激动剂
适应症:膀胱过度活动、尿急、尿失禁
目前阶段:Ⅱ期临床
给药途径:口服
2 相关背景膀胱过度活动症是排尿功能障碍常见的临床表现之一,治疗的目的在于抑制膀胱逼尿肌的过度活动,从而增加膀胱容量。目前临床上常用的治疗药物主要包括M受体阻滞剂、α1受体阻滞剂、β3受体激动剂。作为治疗肥胖、糖尿病的潜在治疗手段[1-3],虽然β3肾上腺素能受体激动剂进入临床研究的数量很多,但这些药物未表现出持续的疗效[4]。此外,由于其临床动力学表现不佳及其在心血管方面的副作用,对此系列化合物的研究未能继续进行。然而,在过去的10年间,研究显示β3肾上腺素能受体激动剂对人和大鼠逼尿肌存在一定的作用,能够对人和大鼠的逼尿肌的肌肉产生松弛作用[5-6]。
膀胱过度活动症常伴有尿频和夜尿增多症状,可伴有急迫性尿失禁,严重影响患者的日常生活和社会活动,已成为困扰人们的一大疾病,影响着全世界数百万人的生活质量。在过去的几十年中,毒蕈碱拮抗剂(抗胆碱能药)是治疗膀胱过度活动症的常用药物,能够缓解其引起的各种症状。但是副作用口干和便秘未能有效的缓解[7]。近些年,一种具有很强选择性的β3肾上腺素能受体激动剂作为膀胱过度活动症的潜在治疗手段有了很大的发展。其中索拉勃隆具有良好的安全性和耐受性,并且对女性的膀胱过度活动症具有良好疗效[8]。vibegron是一种作用机制新颖的尿失禁治疗药物,改变了30多年前采用传统的抗胆碱药物治疗尿失禁的思路,提高膀胱的充盈以及贮尿能力,目前已经完成了临床前毒性研究,完成了Ⅱ期临床试验。
3 合成路线[9](4S,5R)-4-甲酰基-2,2-二甲基-5-苯基噁唑烷-3-羧酸叔丁酯通过Witting反应、氢化反应将4位的醛基进行碳链延长得到化合物2;化合物2通过Witting反应将对硝基苄基与醛基对接得到化合物3;化合物3在酸性条件下环合,然后对裸露的氨基进行Boc保护得到化合物4;通过氢化反应将化合物4的硝基还原成氨基得到化合物5;化合物5在缩合剂HOBT和EDCI的作用下酰化得到化合物6;然后利用TFA脱除四氢吡咯氮的保护剂得到目标化合物vibegron。合成路线见图 2。
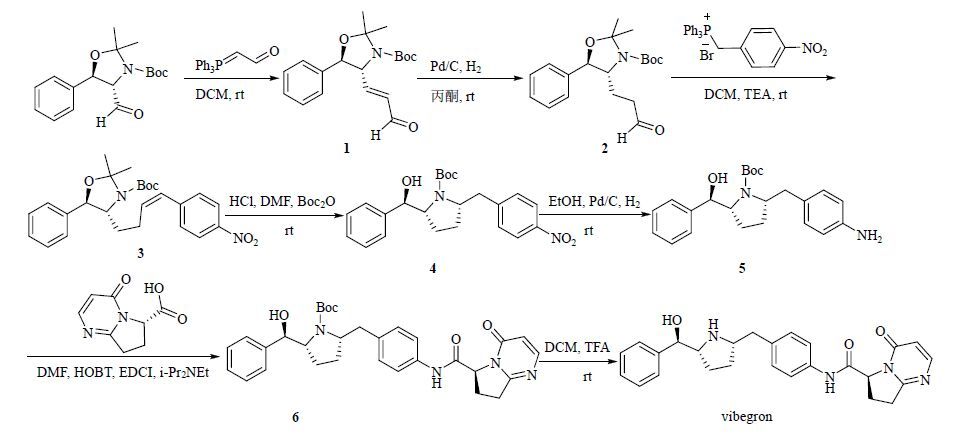
|
图 2 vibegron的合成路线 Fig. 2 Synthesis route of vibegron |
4 药理作用
vibegron的发现是基于其基本结构吡咯烷衍生的酰胺的系列化合物进一步优化的结果。构象研究表明,同其他药物相比,vibegron苯乙酰胺α位的取代基团稠合的五元环能够显著提高β3肾上腺素能受体激动剂的效能[10]。在大于100个脱靶结合测定的大组中,vibegron显示与转运蛋白结合;同时由于其亲脂性较其他类似药物小,降低了磷脂病的风险。另一方面在对逼尿肌的松弛测试方面显示,其对大鼠和人类逼尿肌的松弛作用类似[11]。通过对大鼠血浆循环甘油和游离脂肪酸水平的测量,最低有效剂量为0.3 mg/kg,但循环甘油和游离脂肪酸增加的最小剂量为0.3~1.0 mg/kg,从而进一步证实其降低磷脂病的风险[12]。同时研究表明,vibegron存在肝、肾、胆及其代谢物等多种消除途径,进一步表明其存在低风险的治病性[13]。细胞色素P450、CYP3A4、mRNA的研究表明其具有良好的选择性,不会有显著地抑制或诱导作用,不会增加药物之间的相互作用从而降低药物毒性[14]。
5 临床研究[15] 5.1 Ⅰ期临床2012年7月,默沙东公司开展了一项名为NCT01628042的Ⅰ期临床研究。本研究将调查肾功能受损对vibegron的血浆药动学的影响,以确定在膀胱过度活动症参与者的临床试验中的指导用药,并指导对具有不同程度肾损伤的个体的潜在给药剂量调整的建议。其研究种类为干预性研究,采用非随机分配和非盲的方式,同时单剂量给药。参与临床实验的人数为32例,剂量为100 mg/次,1次/d。平均分成4组,分别为严重肾功能不全参与者、中度肾功能不全参与者、轻度肾功能不全参与者和健康匹配对照参与者。每组8例,其中女性均为2例,男性均为6例。分别绘制其药时浓度曲线、最大血浆浓度曲线和表观全身清除率。在所有的参与者中,不良事件发生率为0。
2013年1月,默沙东公司开展了一项名为NCT01737684的Ⅰ期临床研究。本研究旨在研究具有中度肝功能不全者的(通过单一口服给药)的药动学,并辅以具有相同体质量指数的健康参与者作为匹配对照。其研究种类为干预性研究,采用非随机分配和非盲的方式,干预模型为平行分配,同时单剂量给药。参与临床实验的人数为16例,剂量为100 mg/次,1次/d。平均分成2组,分别为中度肝肾功能不全参与者和健康匹配对照参与者。每组8人,其中女性均为1例,男性均为7例。分别绘制其药时浓度曲线、表观清除率、表观分布容积最大血浆浓度曲线、最大血浆浓度曲线、时间曲线和表观端子半衰期曲线。在所有的参与者中,严重不良事件发生率为0。副反应为潮红,其中中度肾功能不全参与者潮红发生率为0,健康对照组潮红发生率为12.5%。
5.2 Ⅱ期临床2011年3月,默沙东公司开展了一项名为NCT01314872的Ⅱ期临床研究,旨在研究同对照组相比,vibegron在服药8周后能否明显减少膀胱过度活动症患者的排尿次数。这是一个两部分、随机、双盲安慰剂和主动控制的临床试验,用以研究男性和女性膀胱过度活动症患者。第1部分的参加者不参加第2部分的实验。完成第1部分或第2部分的参加者有资格参加可选的1年安全延长实验。其主要研究目的是安全性和有效性。1 395例患者随机分为两部分,其中第1部分随机分为7组,共8周实验,分别为安慰剂、vibegron 3、15、50、100 mg、托罗特定 4 mg、对照组(托罗特定4 mg前4周,安慰剂后4周)。第2部分随机分为4组,共4周实验,分别为安慰剂、vibegron 100 mg、托罗特定4 mg、联合组(vibegron 100 mg和托罗特定4 mg)。实验数据显示,通过观察第8周排尿基线的变化,vibegron 100 mg剂量组具有显著的疗效,也优于对照组,随着剂量的增加,疗效基本呈上升趋势,但发生不良事件的比例基本上不变。同时数据显示,随着时间的延长,严重不良反应的发生呈上升趋势(以vibegron 100 mg为例:由0%(8周)上升至3.23%(52周)),但总体维持在较安全水平。副反应的发生率也呈上升趋势(以vibegron 100 mg为例:由4.46%(4周)上升至22.15%(8周),再升至29.44%(52周))但总体可控,风险系数较低,而且副反应分布较为广泛,没有特异性危害。
6 安全性vibegron已经实施了基于ICHM3(R2)指导原则的一系列的非临床实验,证实了其在人类当中口服的可实施性。其在一系列的遗传毒理学研究(微生物诱变实验、染色体畸变试验、大鼠骨髓微核诱导体内实验)中被证明是非致癌和非致突变的。重复剂量口服毒性研究对SD大鼠进行了6个月持续研究,对食蟹猴进行了长达9个月的研究用以支持临床Ⅲ期研究。研究显示vibegron具有良好的耐受性。同时在食蟹猴上做了长达3个月的广泛的眼科研究和9个月的心电图评估研究。在CD1小鼠中进行了维持3个月的研究用以支持2年致癌性研究的剂量选择实验。另外,在大鼠和家兔中对胚胎的发育也进行了相应的研究以确定其对胎儿及其生育能力的影响。同时为了研究vibegron与tolterodine在临床上的联合用药情况,一项在猴子中进行的口服重复联合用药的实验正在进行。在结束的Ⅰ期和Ⅱ期临床实验当中,未发生严重的不良事件,副反应发生的概率也比较低,也未发现vibegron对某一器官组织或某一生理过程具有诱导和抑制作用,可以预见在临床用药上的安全性还是比较高的[16]。
7 结语随着老龄化的加剧,尿频、尿急、尿失禁正成为困扰着老年人健康的常见疾病,也严重的影响了老年人的生活质量。同时,老龄化进程与膀胱功能的改变和临床症状息息相关。由于β3肾上腺素能受体激动剂在调节人和大鼠逼尿肌舒张过程中起主要作用,在人和大鼠体内主要分布在脂肪、胃肠道、膀胱和前列腺,在心脏和血管平滑肌当中的量很少,在呼吸器官中未见分布,可以预见其副作用应比其他药物要低。临床Ⅰ期和Ⅱ期实验也辅证了这一观点。vibegron在改善老年人生活质量方面和未来的经济效益方面都具有良好的应用前景和市场前景。
| [1] |
Weber A E.
β3-Adrenergic receptor agonists for the treatment of obesity[J]. Annu Rep Med Chem, 1998, 33(2) : 193–202.
( 0) 0)
|
| [2] |
Cernecka H, Sand C, Michel M C.
Features of β3-adrenoceptor Pharmacology[J]. Mol Pharmacol, 2014, 86(3) : 479–484.
( 0) 0)
|
| [3] |
Ursino M G, Vasina V, Raschi E, et al.
The β3-adrenoceptor as a therapeutic target:current perspectives[J]. Pharmacol Res, 2009, 59(2) : 221–234.
( 0) 0)
|
| [4] |
Baker J G.
The selectivity of β-adrenoceptor agonists at the human β1, β2, and β3 adrenoceptors[J]. Br J Pharmacol, 2010, 160(10) : 1048–1061.
( 0) 0)
|
| [5] |
Gillespie J I, Rouget C, Palea S, et al.
Beta adrenergic modulation of spontaneous microcontractions andelectrical in isolated strips of rat urinary bladder from normal animals[J]. N-S Arch Pharmacol, 2015, 38(6) : 719–726.
( 0) 0)
|
| [6] |
Hicks A, McCafferty G P.
Selective β3-adrenergic receptor agonist, relaxation and increases micturition reflex threshold in the dog[J]. Pharmacol Exp Ther, 2007, 323(2) : 202–209.
( 0) 0)
|
| [7] |
Abrams P, Andersson K E.
Muscarinic receptor antagonists for overactive bladder[J]. BJU Int, 2007, 100(8) : 987–1006.
( 0) 0)
|
| [8] |
Martin M, Von Keitz A.
Potential future addition to the β3 adrenoceptor agonist armamentarium for the management of overactive bladder[J]. Drugs, 2015, 24(3) : 413–419.
( 0) 0)
|
| [9] |
Merck Sharp & Dohme Corp. Merck process for preparing beta 3 agonists and intermediates[P]. WO:2014150639, 2014-09-25.
( 0) 0)
|
| [10] |
Moyes C R, Berger R, Goble S D, et al.
Synthesis and evaluation of conformationally restricted acetanilides as potent and selective[J]. J Med Chem, 2014, 57(11) : 1437–1453.
( 0) 0)
|
| [11] |
Nagabukuro H, Degenhardt A, Villa K L, et al.
Correlation between pharmacologically-induced changes in cystometric parameters and spinal c-Fos expression in rats[J]. Auton Neurosci, 2010, 156(1/2) : 19–26.
( 0) 0)
|
| [12] |
Weyer C, Gautier J F, Danforth, E.
Development of adrenoceptor agonists for the treatment of obesity and diabetes-an update[J]. Diabetes Metab, 1999, 25(1) : 11–21.
( 0) 0)
|
| [13] |
Vose C W, Ings R M.
Drug metabolism in the handbook of medicinal chemistry[J]. Drug Metab Dispos, 2015, 43(2) : 163–181.
( 0) 0)
|
| [14] |
Sinz M, Wallace G.
Current industrial practices in assessing CYP450 enzyme induction[J]. Curr Top Med Chem, 2011, 11(3) : 382–403.
( 0) 0)
|
| [15] |
4 Studies for vibegron[EB/OL]. (2016-08-10)[2016-11-30]. https://clinicaltrials.gov/ct2/results?term=Vibegron&Search=Search.
( 0) 0)
|
| [16] |
Scott D, Cheng Z, Nam Fung Kar, et al.
Discovery of vibegron:a potent and selective β3 adrenergic receptor agonist for the treatment of overactive bladder[J]. J Med Chem, 2016, 59(5) : 609–623.
( 0) 0)
|
 2017, Vol. 32
2017, Vol. 32


