2. 河北北方学院附属第一医院 老年科, 河北 张家口 075000
2. Department of Geriatrics, The First Affiliated Hospital of Hebei North University, Zhangjiakou 075000, China
溶菌酶是免疫系统的一种碱性蛋白酶,能与许多内、外源性物质结合,发挥抗菌、抗病毒、消炎、消肿等生物功能[1]。溶菌酶是药物发挥药效的一种重要载体,常作为模型蛋白用于研究药物小分子与蛋白质相互作用,为研究药物在体内的分布、代谢、药效的发挥等提供依据。牡荆苷是金莲花的主要药效成分,属于黄酮碳苷类,可延缓脑组织萎缩,提高脑组织中抗氧化酶的活性和降低丙二醛、脂褐素水平,改善海马区神经细胞结构的功能[2]。本研究在模拟人体生理条件下,采用荧光光谱法和同步荧光光谱法研究牡荆苷与溶菌酶的相互作用,探索其猝灭机制,获得两者作用参数(结合常数、结合位点数、结合距离),并探讨共存金属离子对牡荆苷-溶菌酶体系相互作用的影响,同时利用同步荧光光谱考察牡荆苷对溶菌酶构象的影响。
1 仪器和试剂F-7000荧光光度计(日本日立公司);电子天平(北京赛多利斯仪器系统有限公司);Biohit加样器(芬兰Biohit公司);pHS-3C数字酸度计(上海雷磁仪器厂);电热恒温水槽(上海精宏实验设备有限公司);Na2HPO4-NaH2PO4(PBS)缓冲溶液(0.02 mol/L,pH 7.40,内含0.15 mol/L NaCl);溶菌酶(美国Sigma公司,货号12650-88-3,相对分子质量14 000,用PBS配成10.1 μmol/L);牡荆苷(河北北方学院药物研究所提供,质量分数>98%,用PBS配制1.15 mmol/L);ZnCl2、FeCl3、CuCl2·3H2O均为分析纯,实验用水为二次蒸馏水。
2 方法与结果 2.1 实验方法在系列10 mL量瓶中移取10.1 μmol/L溶菌酶溶液1.0 mL和0、10、20、30、40、50、60 μL牡荆苷溶液,用PBS缓冲溶液加至刻度,摇匀。将量瓶置于300、305、310 K恒温水浴中30 min。移取混合溶液3 mL于1 cm石英池中,280 nm为激发波长,记录290~500 nm波长的发射光谱。在△λ=15、60 nm下扫描荧光激发光谱,分别得到溶菌酶中酪氨酸残基和色氨酸残基的同步荧光光谱。
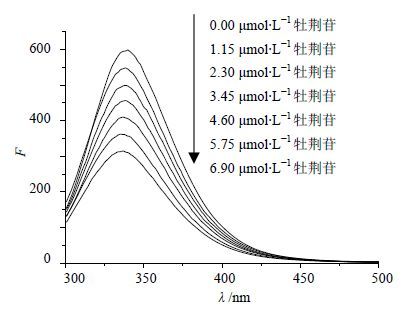
2.2 牡荆苷与溶菌酶相互作用的荧光光谱及荧光猝灭及机制溶菌酶分子中含有酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe),所以其具有较强的内源性荧光。固定溶菌酶溶液的浓度,以280 nm为激发波长,在290~500 nm测定不同浓度牡荆苷与溶菌酶相互作用的荧光光谱,结果见图 1。可见增加牡荆苷的浓度,溶菌酶的荧光强度有规律的降低,同时伴随345 nm处最大荧光发射峰峰位的蓝移。由此推测牡荆苷与溶菌酶发生结合作用,导致溶菌酶荧光猝灭。
|
图 1 310 K时牡荆苷对溶菌酶荧光猝灭图 Fig. 1 Fluorescence spectra of vitexin on lysozyme at 310 K |
荧光猝灭分为动态猝灭过程和静态猝灭过程两类[3]。动态猝灭是猝灭剂分子与荧光物质激发态分子之间的相互作用,使其荧光猝灭的过程。其过程遵循Stern-Volmer方程[4]:
F0/F=1+KSV[Q]
静态猝灭过程应符合Lineweaver-Burk双倒数方程[5]:
(F0-F)-1=F0-1+KLB0-1 F-1[Q]
F0、F分别为牡荆苷和溶菌酶作用前和作用后的荧光强度,[Q]为牡荆苷的浓度,KSV为Stern-Volmer动态猝灭常数,KLB为静态荧光猝灭的速率常数。
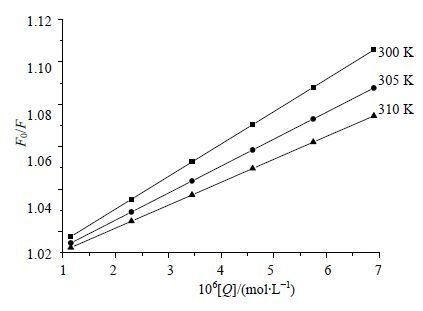
以(F0-F)-1对[Q] -1作图,可求得KLB,结果见表 1。以F0/F对牡荆苷浓度[Q]作图,见图 2,可得不同温度下的KSV。
| 表 1 牡荆苷与溶菌酶作用的相关参数 Table 1 Correlating parameters of interaction between vitexin and lysozyme |
|
图 2 牡荆苷对溶菌酶荧光猝灭的Stern-Volmer图 Fig. 2 Stern-Volmer plots of fluorescence quenching of lysozyme by vitexin |
可见KSV随着温度的升高而降低,KLB随温度增大而增大,初步推测牡荆苷与溶菌酶形成不发光的复合物而导致荧光猝灭,其猝灭机制为静态猝灭。此外,牡荆苷的荧光猝灭速率常数远大于各类猝灭剂对生物大分子的最大动态荧光猝灭常数(200 L/mol),进一步证实牡荆苷与溶菌酶的猝灭过程是由于两者形成不发光复合物而引起的静态猝灭。因此,牡荆苷对溶菌酶的荧光猝灭作用是由于生成牡荆苷-溶菌酶复合物引起的静态猝灭。
2.3 牡荆苷与溶菌酶结合位点数、结合常数的确定对于静态猝灭过程,荧光强度与猝灭剂的关系可由静态猝灭公式表示[6]:
lg(F0-F)/F=lgK+nlg[Q]
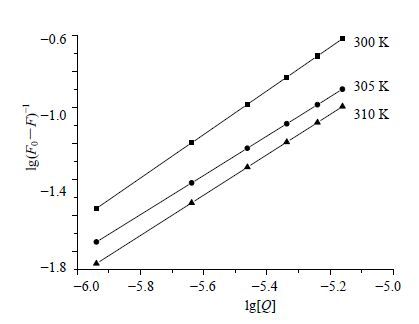
以lg(F0-F)/F对lg[Q]作图,见图 3,可计算牡荆苷与溶菌酶的结合常数(K)和结合位点数(n),结果见表 1。牡荆苷与溶菌酶K的数量级均为1×105,表明两者之间具有很强作用力;牡荆苷与溶菌酶结合位点数接近1,表明两者有1个结合位点数。
|
图 3 不同温度下牡荆苷对溶菌酶的双对数图 Fig. 3 Double logarithm plots of fluorescence quenching of lysozyme by vitexin |
2.4 牡荆苷与溶菌酶结合的热力学性质
药物小分子与生物大分子之间作用力主要包括疏水作用力、氢键、范德华力、静电引力等[7]。相同实验条件下分别测定在300、305、310 K下牡荆苷与溶菌酶作用的相关热力学参数。根据牡荆苷与溶菌酶作用前后的熵变和焓变的相对大小,确定两者的作用力类型。
ln(K2/K1)=ΔH(1/T1-1/T2)/R
ΔG=RTlnK
ΔS=(ΔH-ΔG)/T
由热力学公式可得到300、305、310 K下牡荆苷与溶菌酶的热力学参数,结果见表 2。
| 表 2 牡荆苷与溶菌酶结合热力学参数 Table 2 Thermodynamics parameters of binding of vitexin and lysozyme |
根据热力学参数与作用力的关系[8],△rHm>0,△rSm>0,可判定牡荆苷与溶菌酶作用力为典型的疏水作用。
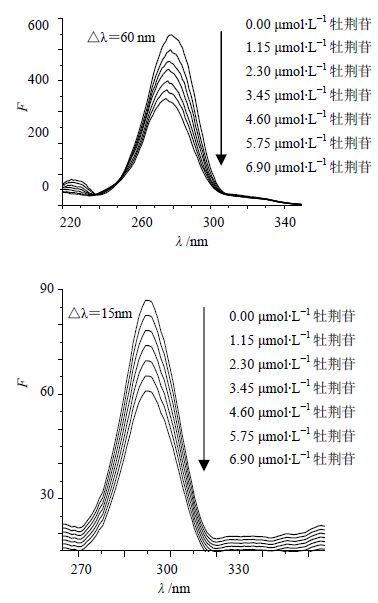
2.5 牡荆苷对溶菌酶构象的影响溶菌酶的内源性荧光主要来自分子中的色氨酸和酪氨酸,分别固定△λ=15、60 nm,测定溶菌酶中酪氨酸和色氨酸残基的同步荧光光谱[9],可以考察牡荆苷对溶菌酶构象的影响,结果见图 4。
|
图 4 牡荆苷与溶菌酶作用的同步荧光光谱图 Fig. 4 Synchronous fluorescence spectra of interaction between vitexin and lysozyme |
色氨酸残基的荧光强度发生有规律的明显降低,且降低程度比酪氨酸更明显,说明溶菌酶的荧光主要是色氨酸残基贡献,推测牡荆苷与溶菌酶的结合位点接近于色氨酸残基。酪氨酸残基的荧光有规律的降低,但不明显,且最大荧光发射峰未发生红移或蓝移,说明牡荆苷对酪氨酸残基影响很小。此外,色氨酸的最大发射波长发生蓝移,表明牡荆苷加入使色氨酸残基附近的微环境发生了改变。由此说明牡荆苷的加入使溶菌酶的构象发生改变。
2.6 共存金属离子对牡荆苷与溶菌酶相互作用的影响人体本身具有许多微量金属元素,其中Cu2+、Zn2+、Fe3+等金属离子与人体的生存、代谢等息息相关。试验考察Cu2+、Zn2+、Fe3+等金属离子(与牡荆苷的物质的量比为1:1)对牡荆苷与溶菌酶相互作用的影响,结果见表 3。
| 表 3 共存金属离子对牡荆苷与溶菌酶结合参数的影响 Table 3 Effect of common metal ions on binding parameters of vitexin and lysozyme at 310 K |
可见在金属离子存在时,牡荆苷与溶菌酶的结合常数和结合位点数均减小,说明金属离子与牡荆苷存在相互竞争作用,缩短牡荆苷在血浆中的储留时间,可以短时间内增加其临床疗效。Cu2+和Zn2+对牡荆苷与溶菌酶的结合常数的影响大于Fe3+的影响,推测这种影响可能与牡荆苷的结构本身有关。此外,有无金属离子存在,结合位点数均接近1,说明牡荆苷与溶菌酶只有1个结合位点。
3 讨论本实验采用荧光光谱法考察牡荆苷与溶菌酶的相互作用,并探讨金属离子对两者相互作用的影响,结果表明牡荆苷对溶菌酶猝灭机制为静态猝灭。有无金属离子对牡荆苷与溶菌酶的结合常数和结合位点数均有不同程度的影响,推测金属离子可能在牡荆苷与溶菌酶之间以“离子架桥”方式参与两者的结合过程。此外,金属离子按照结合常数改变程度大小的排序为Zn2+>Cu2+>Fe3+,金属离子使两者结合常数减小,说明金属离子与牡荆苷存在竞争作用,可以缩短其在血浆中的储留时间,增加其疗效。
同步荧光结果表明,牡荆苷使色氨酸残基附近的极性减弱,疏水环境增强,肽链的伸展程度有所减少;牡荆苷使溶菌酶构象发生改变,且牡荆苷与溶菌酶的结合位点在色氨酸附近。
| [1] |
Zhang H M, Xu Y Q, Zhou Q H, et al.
nvestigation of the interaction between chlorophenols and lysozyme in solution[J]. J Photochem Photobiol B, 2011, 104(3) : 405–413.
DOI:10.1016/j.jphotobiol.2011.04.008 ( 0) 0)
|
| [2] |
蒋伟, 屈海琪, 袁丹华, 等.
金莲花中荭草苷和牡荆苷对D-半乳糖致衰老小鼠脑损伤的保护作用[J]. 中草药, 2012, 43(7) : 1376–1380.
( 0) 0)
|
| [3] |
Ding F, Huang J L, Lin J, et al. A study of the binding of C.I. Mordant Red 3 with bovine serum albumin using fluorescence spectroscopy[J]. Dyes and Pigments, 2009, 82(1):65-70.
( 0) 0)
|
| [4] |
董露, 易忠胜, 伍智蔚, 等.
2'-羟基-2,4-二溴二苯醚与人血清白蛋白作用机制的光谱研究与计算模拟[J]. 高等学校化学学报, 2015, 36(3) : 516–522.
( 0) 0)
|
| [5] |
Lan Y X, Liu M X, Chen S Z, et al.
Spectrophotometric studies on the interaction between chlorogenic acid, neochlorogenic acid, cryptochlorogenic acid and lysozyme[J]. J Chin Pharm Sci, 2014, 23(8) : 543–547.
( 0) 0)
|
| [6] |
滕跃, 刘美, 邹路易, 等.
2-巯基苯并咪唑与溶菌酶作用机理的研究[J]. 分析测试学报, 2014, 33(12) : 1431–1435.
( 0) 0)
|
| [7] |
刘保生, 韩荣, 李志云, 等.
硝基羟乙唑与溶菌酶反应机制的荧光光谱研究[J]. 发光学报, 2015, 36(12) : 1458–1463.
( 0) 0)
|
| [8] |
郑茂东, 颜娟, 庞茜茜, 等.
荧光光谱法研究卡铂与牛血清白蛋白的相互作用[J]. 现代药物与临床, 2016, 31(5) : 587–590.
( 0) 0)
|
| [9] |
张海容, 刘晓燕, 李慧卿, 等.
药物青蒿素与溶菌酶相互作用研究[J]. 分析科学学报, 2013, 29(4) : 539–542.
( 0) 0)
|
 2017, Vol. 32
2017, Vol. 32

