2. 解放军第94医院 药学科, 江西 南昌 330000;
3. 澳门大学 健康科学学院, 澳门 999078;
4. 暨南大学 药学院 中药及天然药物研究所, 广东 广州 510632
2. Department of Pharmacy, NO. 94 Hospital of PLA, Nanchang 330002, China;
3. Faculty of Health Sciences, University of Macau, Macau 999078, China;
4. Institute of Traditional Chinese Medicine and Natural Products, College of Pharmacy, Jinan University, Guangzhou 510632, China
京尼平是从栀子中提取的环烯醚萜化合物,是化学结构不稳定的天然产物。很多研究旨在寻求稳定而又能保留甚至增加其生物活性的京尼平衍生物。已证实,京尼平及其稳定衍生物栀子酰胺A均能激活神经元型一氧化氮合成酶的活性,调控神经细胞中一氧化氮(NO)的平衡,从而发挥其神经保护作用[1-2]。众所周知,NO是一种较小的生物活性分子,能参与脑内许多生理功能的调节,尽管其化学结构简单,却能以相对特异的方式控制神经元的功能或生理功能,但过量NO的存在却能产生神经毒性。前期工作发现,1-O-异丙基京尼平衍生物CHR20、CHR21与京尼平一样都是一氧化氮合成酶激活剂,然而却可以对硝普钠诱导的PC12细胞损伤起保护作用[3]。作为外源性NO供体,过量硝普钠的存在将产生NO神经毒性,是研究NO毒性的体外模型[4]。因此,京尼平衍生物是否都具有这个特点以及其结构规律是本研究关注的科学问题。本研究针对5个京尼平衍生物开展相关研究,旨在筛选京尼平衍生物对抗硝普钠诱导细胞损伤作用,并从抗氧化酶基因表达的变化探讨京尼平衍生物的保护作用机制。
1 试剂和仪器 1.1 细胞株高分化的PC12细胞株购自中国科学院上海细胞库。
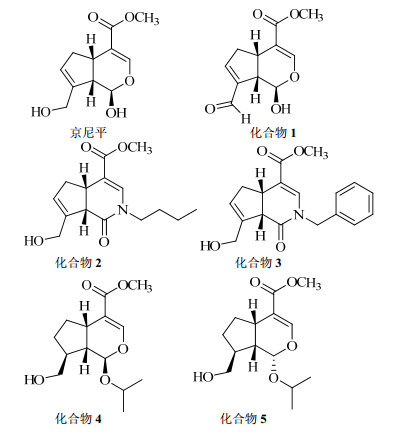
1.2 主要试剂二甲基亚砜(DMSO,编号D2650)、2', 7'-二氯荧光黄双乙酸盐(DCFH-DA,编号D6883)荧光探针为Sigma公司产品;Goldview Ⅰ型核酸染色剂(Solarbio公司);DMEM培养基、胎牛血清(FBS)、马血清(HS)购于美国Gibco公司;硝普钠(编号S0015)、胰蛋白酶(编号C0201)、PSA(编号C0222)、Hoechst 33258(编号C1011)购自碧云天生物科技有限公司;TRNzol Universal总RNA提取试剂(编号DP424)、RT-PCR(编号KR108-01)试剂、PCR试剂(编号KT207-01)购于天根生化科技有限责任公司;丙二醛(MDA)检测试剂盒购于南京建成生物科技有限公司;京尼平衍生物(4aS, 7aS)-7-甲酰基-1-氧代-1, 4a, 5, 7a-四氢环戊烯[c]吡喃-4-羧酸甲酯(化合物1)、(4aS, 7aS)-2-丁基-7-(羟甲基)-1-氧代-1, 4a, 5, 7a-四氢-1H-环戊烯[c]吡啶-4-羧酸甲酯(化合物2)、(4aS, 7aS)-2-苄基-7-(羟甲基)-1-氧代-2, 4a, 5, 7a-四氢-1H-环戊烯[c]吡啶-4-羧酸甲酯(化合物3)、1R-异丙基-6, 7-二氢京尼平(化合物4)、1S-异丙基-6, 7-二氢京尼平(化合物5)由暨南大学药学院陈河如课题组合成,质量分数均>90%,结构见图 1。
|
图 1 京尼平及其衍生物的化学结构 Fig. 1 Structure of genipin and its derivatives |
1.3 主要设备
紫外分光光度计(Ultrospec 1100 pro);Heraeus Labo fuge 400R高速离心机;TC-5000型PCR仪(英国Techne);奥林巴斯IX71荧光倒置显微镜;UVP凝胶成像系统(美国Upland CA公司)。
2 方法 2.1 PC12细胞的培养和传代[5]将水浴锅调至37.0~37.5 ℃,待水浴温度稳定后,取出液氮中冻存的细胞迅速放入水浴锅,将细胞液面浸至水面以下轻轻摇动至完全融化。然后1 000 r/min离心3 min,弃上清,加入适量的完全培养基重悬细胞,吹打均匀后移入细胞培养瓶中,以10% FBS、5% HS、0.2% PSA的DMEM高糖培养液置于CO2培养箱内培养复苏的细胞。每2~3天更换培养液1次。待细胞融合率达80%以上时,即可进行传代和后续的细胞处理实验。
2.2 MTT法检测细胞活力[6-7]PC12细胞按每孔1×104个细胞的密度接种于96孔板。每孔的培养基体积为100 μL,37 ℃、5% CO2及饱和湿度条件下培养24 h后,换液为不含血清的DMEM培养基,采用62.5~1 000.0 μmol/L硝普钠处理PC12细胞24 h,考察硝普钠对PC12细胞的毒性作用。
将种板的细胞分为对照组、模型组(750 μmol/L硝普钠)和京尼平衍生物组。其中京尼平衍生物组用750 μmol/L硝普钠预先处理2 h后,分别加入终浓度分别为0、0.3、1、3、10、30 μmol/L京尼平衍生物,处理24 h后,加10 mg/mL MTT 10 μL,继续培养4 h后去上清液,每孔加入150 μL DMSO,微振荡后,用全自动酶标仪在570 nm波长处读取吸光度(A)值,计算细胞存活率。
细胞存活率=检测孔的A值/对照孔的A值
2.3 Hoechst染色法检测细胞凋亡状态细胞处理结束后,吸出细胞培养基,每孔加入50 μL固定液固定10 min。吸去固定液后,用PBS洗涤2遍,每孔加入Hoechst 33258染色液50 μL,染色10 min。吸去染色液,用PBS洗涤2遍,每孔加入80 μL PBS。通过荧光显微镜在激发波长330~380 nm观察凋亡细胞的形态学的变化。
2.4 DCFH-DA法检测细胞内活性氧(ROS)水平将处理好的48孔细胞培养板加DCFH-DA 200 μL(培养基配制,终浓度10 μmol/L),37 ℃避光处理30 min,抽掉培养基,PBS洗2遍,ArrayScanVTI高内涵细胞成像分析系统(Thermo Fisher Scientific公司)随机检测25个视野下荧光强度。检测荧光激发波长设为488 nm和发射波长设为525 nm。
细胞ROS水平=检测孔的平均荧光强度值/对照孔的平均荧光强度值
2.5 MDA水平的测定分别对96孔板PC12细胞预处理药物2 h进行硝普钠损伤共处理12 h;然后按组别收取96孔板中的处理组细胞和正常对照细胞。96孔板中的细胞2 500 r/min离心5 min后,分离上清,用ddH2O重悬后涡旋1 min使细胞充分破裂,按照MDA试剂盒说明书分别测定培养液和细胞的MDA水平。
2.6 RT-PCR检测京尼平衍生物诱导抗氧化基因表达PC12细胞按6×105/孔接种于6孔板,每孔的培养基体积为2 000 μL,37 ℃、5% CO2及饱和湿度条件下培养12 h后,用化合物4加硝普钠或不加硝普钠共处理PC12细胞12 h,按照Trizol试剂盒说明提取肝组织总mRNA,mRNA浓度通过紫外分光光度计测定。取2 μg总RNA逆转录成cDNA,然后进行PCR扩增。采用RT-PCR法检测其对谷氨酰半胱氨酸合成酶(GCLC)、锰超氧化物歧化酶(MnSOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、血红素氧合酶1(HO-1)等抗氧化基因mRNA表达的影响。选用核糖体蛋白L19(RPL-19)作为内参,循环温度为55 ℃,循环数为35的20 μL反应体系:1.5 μL cDNA,10×PCR buffer 2 μL,2.5 mmol/L dNTP 2 μL,10μmol/L Random Primer 2 μL,上下游引物(表 1)20 μmol/L各加0.5 μL及Taq酶1 μL,纯水补容至20 μL。
| 表 1 抗氧化酶和内参基因引物序列 Table 1 Primer sequences of antioxidant genes and internal control |
2.7 统计学处理
应用SPSS 16.0软件,对各项数据进行统计学分析。全部计量资料用x±s表示,多组比较用方差分析(单因素方差分析、LSD法),组间比较、组内比较用t检验。
3 结果 3.1 不同剂量硝普钠对PC12细胞存活率的影响当硝普钠的剂量为250 μmol/L时,细胞基本能正常生长;当剂量500 μmol/L时,开始显示神经毒性,细胞存活率为(75.4±6.7)%(P<0.05);从细胞毒性造模的角度考虑,选择硝普钠剂量为750 μmol/L造模,见表 2。
| 表 2 硝普钠对PC12细胞的损伤作用(x±s,n=6) Table 2 Damage effects of sodium nitroprusside on PC12 cells (x±s, n=6) |
3.2 京尼平衍生物对PC12细胞存活率的影响
化合物1、2、3在所检测的浓度范围内均没有显示保护作用;而化合物4、5在3 μmol/L浓度下,开始对硝普钠诱导的细胞损伤具有显著的抑制作用;在10 μmol/L浓度时,作用效果达到最佳,而且呈显著的剂量效应,差异具有统计学意义(P<0.05、0.01),见表 3。
| 表 3 京尼平衍生物对硝普钠诱导的PC12细胞存活率的影响(x±s,n=6) Table 3 Effect of genipin derivatives on cell survival rate of sodium nitroprusside-induced PC12 cells (x±s, n=6) |
3.3 Hoechst染色法观察
分别比较化合物4、5处理后细胞形态上的差异,见图 1。对照组细胞细胞核饱满,染色均匀;给予硝普钠处理后则可见细胞核皱缩,Hoechst染色亮度增加,甚至可见核碎裂;分别给予10 μmol/L化合物4、5处理后,可以一定程度上逆转硝普钠的毒性作用,细胞核浓染现象得到明显改善。

|
图 1 PC12细胞形态改变(Hoechst染色) Fig. 1 Morphological changes of PC12 cells (Hoechst staining) |
3.4 京尼平衍生物对ROS、MDA水平的影响
过量硝普钠的存在将提升细胞内ROS、MDA水平,进而对细胞造成损伤。利用荧光探针DCFH-DA、MDA检测试剂盒分别检测硝普钠处理、化合物4、5预处理后硝普钠再处理情况下细胞内ROS、MDA水平,见表 4。以对照组细胞内ROS、MDA水平为100%计算,单独用硝普钠处理的模型组ROS水平是对照组的1.95倍,分别用10 μmol/L化合物4、5预处理后能显著减弱硝普钠诱导的PC12细胞内ROS水平,差异具有统计学意义(P<0.05、0.01)。
| 表 4 京尼平衍生物对硝普钠诱导的PC12细胞内ROS、MDA水平的影响(x±s,n=6) Table 4 Effect of genipin derivatives on levels of ROS and MDA in sodium nitroprusside-induced PC12 cells (x±s, n=6) |
不同处理组细胞内MDA水平变化情况与ROS类似。与对照组比较,模型组细胞内MDA水平是对照组的3.82倍,而10 μmol/L化合物4、5预处理能显著降低硝普钠诱导的PC12细胞内MDA水平(P<0.05、0.01),见表 4。
3.5 京尼平衍生物诱导抗氧化蛋白基因表达硝普钠诱导的ROS、MDA水平升高可能与细胞内调控氧化态的抗氧化蛋白有关。化合物4、5对ROS、MDA的调控作用可能通过调控细胞抗氧化蛋白水平来实现。实验通过RT-PCR法检测氧化应激相关基因水平的变化来揭示相关作用,结果见图 2、表 5。结果表明,硝普钠增加了GCLC、GPX、HO-1的mRNA表达水平,降低了CAT的mRNA表达水平(P<0.05);10 μmol/L化合物4、5显著增加硝普钠诱导的GPX mRNA表达(P<0.05)。但30 μmol/L化合物4、5明显抑制GPX mRNA表达;在同等条件下却进一步升高GCLC mRNA表达水平;另外30 μmol/L化合物4、5预处理明显提升被硝普钠下调的CAT mRNA表达水平(P<0.05)。各药物组对硝普钠提升的HO-1 mRNA表达水平没有影响;硝普钠、化合物4、5处理组均对PC12细胞的MnSOD mRNA表达水平无明显影响。

|
图 2 京尼平衍生物对PC12细胞抗氧化酶基因表达的影响 Fig. 2 Effects of genipin derivatives on antioxidant expression in sodium nitroprusside-induced PC12 cells |
| 表 5 京尼平衍生物对硝普钠诱导的PC12细胞损伤抗氧化酶基因表达水平的影响(x±s,n=6) Table 5 Effects of genipin derivatives on antioxidant expression levels in sodium nitroprusside-induced PC12 cells (x±s, n=6) |
4 讨论
神经退行性疾病包括阿尔茨海默病、帕金森病、亨廷顿舞蹈病等,氧化应激、线粒体损伤、泛素-蛋白酶体功能障碍、兴奋性毒性、炎症反应都可能是神经退行性疾病的致病原因。在正常生理状态下,NO主要是一种神经信使分子,其在神经组织、细胞内的浓度通过神经元型一氧化氮合成酶(nNOS)来调控[8-9]。当发生病理变化时,NO大量产生,能够像谷氨酸一样启动一个神经毒性级联反应,过量谷氨酸通过N-甲基-D-天冬氨酸(NMDA)受体作用在脑缺血中介导细胞死亡,NMDA受体的激活和由此产生细胞内Ca2+水平的增加可能引起更多形式的谷氨酸神经毒性,从而导致精神性疾病。NO主要通过还原型亚硝酸离子和超氧阴离子形成过氧化亚硝酸阴离子导致神经毒性作用。
在本研究中,建立的硝普钠诱导PC12细胞损伤模型中,硝普钠产生过量NO,导致神经毒性而使细胞凋亡[10]。在此模型下,采用MTT法对京尼平衍生物进行筛选,得到化合物4、5能够剂量相关性地对抗硝普钠诱导的PC12细胞凋亡。通过Hoechest染色从形态学角度再次验证这一结果。ROS连锁反应是脑神经元损伤的主要机制之一,硝普钠可以诱导ROS产生造成神经细胞氧化损伤[5]。MDA是氧自由基作用于生物膜中的多不饱和脂肪酸引发脂质过氧化反应的终产物,其水平的高低反映了受自由基攻击的严重程度,可以作为评价脂质过氧化反应强弱的指标。实验发现化合物4、5能剂量相关性地降低硝普钠处理后PC12细胞中ROS、MDA水平,明显减轻细胞氧化损伤程度。在正常情况下,机体中有抗氧化酶的广泛分布,如SOD、CAT、GPX等在防止氧代谢物的损伤中具有重要作用。实验通过半定量RT-PCR法检测化合物4、5对各种抗氧化酶的基因水平的影响,结果证实硝普钠增加细胞氧化应激水平的同时代偿性地增加了GCLC、GPX、HO-1 mRNA表达水平,而抑制CAT mRNA表达水平,对PC12细胞的MnSOD mRNA表达水平无明显影响。随着化合物4、5剂量增加,对GPX mRNA表达量先升高后降低,在同等条件下却进一步升高GCLC mRNA表达水平。另外化合物4、5明显提升被硝普钠下调的CAT mRNA表达水平。因此化合物4、5可能通过促进抗氧化酶GPX、GCLC、CAT mRNA的转录从而抵抗硝普钠诱导的氧化损伤及凋亡,该作用可能与其增强细胞抗氧化酶系统、抗ROS的防御能力有关。
| [1] |
Yamazaki M, Chiba K, Mohri T, et al.
Activation of the mitogen-activated protein kinase cascade through nitric oxide synthesis as a mechanism of neuritogenic effect of genipin in PC12h cells[J]. J Neurochem, 2001, 79(1) : 45–54.
( 0) 0)
|
| [2] |
Luo J, Wang R K, Huang Z, et al.
Synthesis of stable genipin derivatives and studies of their neuroprotective activity in PC12 cells[J]. ChemMedChem, 2012, 7(9) : 1661–1668.
DOI:10.1002/cmdc.v7.9 ( 0) 0)
|
| [3] |
Wang R K, Yang J, Liao S F, et al.
Stereoselective reduction of 1-O-isopropyloxygenipin enhances its neuroprotective activity in neuronal cells from apoptosis induced by sodium nitroprusside[J]. ChemMedChem, 2014, 9(7) : 1397–1401.
DOI:10.1002/cmdc.v9.7 ( 0) 0)
|
| [4] |
张浪, 赖永长, 汪海涛, 等.
芦丁对神经细胞氧化损伤的保护作用[J]. 中药材, 2014, 4(37) : 640–644.
( 0) 0)
|
| [5] |
Liu J Z, Wang A H, Li L L, et al.
Oxidative stress mediates hippocampal neuron death in rats after lithium-pilocarpine-induced status epilepticus[J]. Seizure, 2010, 19(3) : 165–172.
DOI:10.1016/j.seizure.2010.01.010 ( 0) 0)
|
| [6] |
Parker G C, Li X, Anguelov R A, et al.
Survival motor neuron protein regulates apoptosis in an in vitro model of spinal muscular atrophy[J]. Neurotox Res, 2008, 13(1) : 39–48.
DOI:10.1007/BF03033366 ( 0) 0)
|
| [7] |
Zheng W H, Quirion R.
Comparative signaling pathways of insulin-like growth factor-1 and brain-derived neurotrophic factor in hippocampal neurons and the role of the PI3 kinase pathway in cell survival[J]. J Neurochem, 2004, 89(4) : 844–852.
DOI:10.1111/jnc.2004.89.issue-4 ( 0) 0)
|
| [8] |
Jeong H S, Kim S W, Baek K J, et al.
Involvement of Ras in survival responsiveness to nitric oxide toxicity in pheochromocytoma cells[J]. J Neurooncol, 2002, 60(2) : 97–107.
DOI:10.1023/A:1020627106602 ( 0) 0)
|
| [9] |
Li C Q, Pang B, Kiziltepe T, et al.
Nitric oxide promotes survival of cerebral cortex neurons with simultaneous addition of[Fe (Ⅱ)(β-citryl-L-glutamate)] complex in primary culture[J]. Chem Res Toxicol, 2006, 19(3) : 399–406.
DOI:10.1021/tx050283e ( 0) 0)
|
| [10] |
Hamada-Kanazawa M, Narahara M, Takano M, et al.
Nitric oxide promotes survival of cerebral cortex neurons with simultaneous addition of[Fe (Ⅱ)(β-citryl-L-glutamate)] complex in primary culture[J]. Biol Pharm Bull, 2013, 36(7) : 1068–1079.
DOI:10.1248/bpb.b12-00991 ( 0) 0)
|
 2017, Vol. 32
2017, Vol. 32



