银屑病是皮肤科常见并易反复发作的慢性炎症性皮肤病,目前病因尚未完全清楚,可能与遗传因素、免疫因素、感染因素、内分泌、神经精神因素等有关[1]。寻常型银屑病是银屑病最常见的一种类型,临床表现为皮肤反复起红斑,鳞屑,伴瘙痒。病程迁延和反复给患者身心健康带来严重的负担。临床上轻度银屑病以外用药物治疗为主,如糖皮质激素乳膏、卡波三醇、地蒽酚、他克莫司等,对于重症银屑病则需要系统用药。甲氨蝶呤是治疗重症银屑病的常用药物[2],但长期应用有一定副作用。白芍总苷是从白芍根部提取的一种新型免疫抑制剂,在多种免疫性疾病中得到广泛应用[3-5],且具有护肝作用[6]。为了研究两者联用是否有协同治疗作用,本研究旨在观察白芍总苷联合甲氨蝶呤治疗重症寻常型银屑病的临床疗效及对血清炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-18(IL-18)水平的影响。
1 资料与方法 1.1 一般资料选取2012年3月—2015年12月荆州市中心医院皮肤科收治的重度寻常型银屑病患者96例。其中男58例,女38例;年龄28~64岁,平均(38.5±15.4)岁;既往银屑病史6~26年,平均(12.4±5.4)年。所有患者均符合重度寻常型银屑病诊断标准[1]。所有患者均签署知情同意书。
排除标准:对本研究药物过敏者;3个月内接受过系统糖皮质激素、抗癌药、免疫抑制剂及生物制剂治疗;妊娠或哺乳期妇女;有肝肾功能障碍患者;血液系统疾病患者;有慢性腹泻及消化性溃疡的患者;严重未控制的高血压、糖尿病患者;恶性肿瘤患者。
1.2 药物甲氨蝶呤片由上海上药信谊药厂有限公司生产,规格2.5 mg/片,产品批号2011078、20121118及20130256;白芍总苷胶囊由宁波立华制药有限公司生产,规格0.3 g(含芍药苷不少于104 mg)/片,产品批号20110143、20121054、20130126。
1.3 分组和治疗方法所有患者随机分为对照组和治疗组,每组各48例。其中对照组男28例,女20例;年龄27~63岁,平均(36.2±5.1)岁,病程7~25.4年,平均(12.4±3.5)年。治疗组男30例,女18例;年龄29~65岁,平均(36.8±5.3)岁,病程8~26年,平均(13.6±3.9)年。两组患者在性别、年龄、病程及治疗前病情严重程度方面比较差异无统计学意义,具有可比性。
对照组口服甲氨蝶呤片,2.5 mg/次,间隔12 h,3次/周。治疗组在对照组基础上口服白芍总苷胶囊,0.6 g/次,3次/d。两组患者连续治疗12周。两组患者皮肤干燥、脱屑,均给予凡士林外用。停药指标:出现严重肝肾功能损害、血液系统受累、严重的胃肠道反应等不能耐受的患者。
1.4 临床疗效判定标准观察指标包括红斑,鳞屑、皮损浸润程度、皮损面积,采用严重性指数(PASI)评分标准[7]记录治疗前后的分数,并以此为基础计算疗效指数。PASI评分标准:红斑+鳞屑+浸润程度,每个特点用0~4分评价;面积评分:4个躯体部位(头部、躯干、上肢、下肢)分别以0~6分评价。

|
临床疗效根据疗效指数判定,痊愈:疗效指数>90%;显效:疗效指数60%~89%;有效:疗效指数30%~59%;无效:疗效指数<30%。
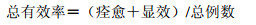
|
空腹抽取静脉血5 mL,离心,分离血清,保存在−20 ℃冰箱备用。血清TNF-α、IL-18水平检测采用酶联免疫吸附实验(ELISA)法,具体操作方法按照试剂盒说明书进行。治疗过程中每4周复查血常规、肝肾功能。
1.6 不良反应观察两组在治疗过程中有无恶心、呕吐、口腔溃疡、骨髓抑制、肝肾功能损害等不良反应发生。
1.7 统计学方法采用SPSS17.0软件进行统计分析,计量资料以x±s表示,采用t检验,计数资料的比较用χ2检验。
2 结果 2.1 两组临床疗效比较治疗后,对照组痊愈13例,显效20例,总有效率为68.75%;治疗组痊愈18例,显效26例,总有效率为91.67%,两组总有效率比较差异有统计学意义(P<0.05),见表 1。
| 表 1 两组临床疗效比较 Table 1 Comparison on clinical efficacies between two groups |
2.2 两组PASI评分比较
治疗后,两组PASI评分均较治疗前显著下降,同组治疗前后比较差异有统计学意义(P<0.05);且治疗组PASI评分的下降程度明显优于对照组,两组比较差异具有统计学意义(P<0.05),见表 2。
| 表 2 两组PASI评分比较(x±s,n =48) Table 2 Comparison on PASI scores between two groups(x±s, n =48) |
2.3 两组TNF-α和IL-18比较
治疗后,两组血清TNF-α及IL-18水平均明显降低,同组治疗前后比较差异有统计学意义(P<0.05);且治疗组这些观察指标的下降程度明显优于对照组,两组比较差异具有统计学意义(P<0.05),见表 3。
| 表 3 两组TNF-α和IL-18比较(x±s,n =48) Table 3 Comparison on TNF-α and IL-18 between two groups(x±s, n =48) |
2.4 两组不良反应比较
治疗过程中对照组发生口腔溃疡3例,肝功能损害6例,白细胞轻度减少2例,胃肠道不适3例,对照组不良反应发生率为29.16%;治疗组发生口腔溃疡0例,肝功能损害1例,白细胞减少0例,胃肠道不适6例,不良反应发生率为14.58%,两组不良反应发生率比较差异有统计学意义(P<0.05)。
3 讨论目前大多数人认为银屑病是免疫或炎症介导的疾病。炎症因子及免疫细胞功能紊乱参与病情的发生发展。TNF-α和IL-18是重要的前炎性因子,IL-18可调节多种细胞发育及细胞因子的分泌,能促进外周单个核细胞产生γ-干扰素(IFN-γ)、白细胞介素-2(IL-2)和粒细胞巨噬细胞集落刺激因子等细胞因子,增强自然杀伤细胞(NK细胞)和辅助性T细胞1(Th1细胞)的细胞毒作用,促进T细胞的增殖,并在Th1细胞分化和免疫反应中有促进和调节作用。TNF-α由激活的单核-巨噬细胞所分泌,具有趋化中性粒细胞迁移,活化局部免疫细胞,导致免疫失衡,在该病发病中起重要作用,抗TNF-α抗体的生物制剂用于治疗银屑病。
寻常型银屑病是临床最常见的银屑病类型,根据银屑病皮损面积占体表面积的比分为轻度(<2%)、中度(2%~10%)、重度(>10%)[1]。2014中国银屑病治疗专家共识[8]对重度银屑病需系统用药治疗,如阿维A,免疫抑制剂,生物制剂等。甲氨蝶呤是经典的免疫抑制剂,治疗费用低,疗效稳定,是治疗重症银屑病的系统用药之一。目前认为甲氨蝶呤通过影响表皮细胞和各种免疫细胞起作用,抑制表皮细胞增殖,减少血液中T淋巴细胞及单核细胞数量,甲氨蝶呤可通过抑制二氢叶酸还原酶,抑制角质形成细胞脱氧核糖核酸(DNA)的合成,具有抗增生作用。在体外实验中,甲氨蝶呤还可以通过诱导免疫细胞凋亡及抑制免疫细胞激活发挥抗炎效应[9]。小剂量甲氨蝶呤在治疗银屑病有较好的疗效,安全性高,耐受性好[10]。在本研究中,对照组患者应用小剂量甲氨蝶呤间断口服12周,虽然也取得较好的疗效,血清TNF-α和IL-18水平较治疗前明显下降,但同时部分患者也出现了口腔溃疡、血细胞轻度减少等不良反应。
白芍总苷是从白芍根部提取的化合物,主要含有芍药苷、芍药内酯苷、羟基芍药苷、苯甲酰药苷等。白芍性凉,味苦,微酸;入肝、脾经,具有平抑肝阳、柔肝止痛、养血收阴的功效。现代药理研究表明,白芍总苷具有抗炎、镇痛、护肝和免疫调节作用,在皮肤科的多种疾病中应用广泛[11]。白芍总苷主要作用于免疫应答的上游,抑制抗原提呈,无细胞毒性及骨髓抑制等不良反应[12],对自身免疫过程中的多个环节都存在调节作用。白芍总苷可抑制T淋巴细胞的活化。在动物实验中[13],白芍总苷可调节Th1/Th2细胞亚群平衡,可上调Th1细胞功能,下调Th2细胞功能,发挥免疫调节作用。而在慢性荨麻疹的研究中,白芍总苷可抑制炎症介质(PEG2、白三烯等)的合成及释放,诱导调节性T细胞的生成[14]。在白芍总苷治疗系统性红斑狼疮中发现[15],其可下调炎性因子TNF-α和INF-α的表达水平,发挥抗炎作用。动物实验中白芍总苷还具有抗血管增生作用[16]。
本研究结果显示白芍总苷与甲氨蝶呤联用可增强抗炎及免疫抑制作用,提高疗效。治疗组总有效率为91.67%,明显高于对照组的68.75%。联合用药组血清炎性因子TNF-α和IL-18水平下降程度更明显,表明白芍总苷可通过降低炎性因子TNF-α和IL-18的水平而发挥治疗作用,两者联用具有协同作用。单独使用甲氨蝶呤治疗银屑病也有疗效,但不良反应常见,对照组的不良反应发生率达到29.16%,治疗组的不良反应发生率为14.58%,联合用药可明显减少甲氨蝶呤的不良反应,两者联用具有互补作用。
综上所述,白芍总苷联合甲氨蝶呤治疗重症寻常型银屑病有较好的临床疗效,可降低TNF-α及IL-18水平,减少药物不良反应,具有一定的临床推广应用价值。
| [1] |
赵辩.
临床皮肤病学[M]. 南京: 江苏科技出版社, 2010 : 1008 -1015.
( 0) 0)
|
| [2] |
李常兴, 张锡宝, 黄振明, 等.
甲氨蝶呤治疗中、重度银屑病疗效观察[J]. 临床皮肤科杂志 , 2006, 35 (5) : 327–328.
( 0) 0)
|
| [3] |
焦晓燕, 郭在培, 陈涛, 等.
白芍总苷治疗过敏性紫癜的临床疗效观察[J]. 临床皮肤科杂志 , 2013, 42 (8) : 500–502.
( 0) 0)
|
| [4] |
徐芳.
环磷酰胺结合白芍总苷治疗系统性红斑狼疮的临床效果研究[J]. 陕西医学杂志 , 2015, 44 (8) : 1081–1082.
( 0) 0)
|
| [5] |
张宇虹, 郭在培, 焦晓燕, 等.
白芍总苷治疗寻常性银屑病的临床疗效观察[J]. 临床皮肤科杂志 , 2011, 40 (7) : 433–435.
( 0) 0)
|
| [6] |
赵侠, 田图磊.
白芍总苷对大鼠酒精性脂肪肝的保护作用及其机制[J]. 山东医药 , 2014, 51 (41) : 25–27.
( 0) 0)
|
| [7] |
Feldman S R, Krueger G G.
Psoriasis assessment tools in clinical trials[J]. Ann Rheum Dis , 2005, 64 (s2) : 65–73.
( 0) 0)
|
| [8] |
中华医学会皮肤性病分会银屑病学组.
中国银屑病治疗专家共识(2014)[J]. 中华皮肤科杂志 , 2014, 47 (3) : 213–215.
( 0) 0)
|
| [9] |
Meephansan J, Ruchusatsawat K, Sindhupak W, et al.
Effect of methotrexate on serum levels of IL-22 in patients with psoriasis[J]. Eur J Dermatol , 2011, 21 (4) : 501–504.
( 0) 0)
|
| [10] |
Yélamos O, Puig L.
Systemic methotrexate for the treatment of psoriasis[J]. Expert Rev Clin Immunol , 2015, 11 (5) : 553–563.
DOI:10.1586/1744666X.2015.1026894 ( 0) 0)
|
| [11] |
王小艳, 陈星宇, 张洪英.
白芍总苷在皮肤科中的应用进展[J]. 中国中西医结合皮肤性病学杂志 , 2015, 14 (4) : 262–264.
( 0) 0)
|
| [12] |
Zhou Z, Lin J, Huo R, et al.
Total glucosides of paeony attenuated functional maturation of dendritic cells via blocking TLR4/5 sign in vivo[J]. Int Immunopharmacol , 2102, 14 (3) : 275–282.
( 0) 0)
|
| [13] |
李传应, 王春, 魏伟.
白芍总苷对小鼠慢性皮炎-湿疹的治疗作用及其部分机制[J]. 中国药理学通报 , 2008, 24 (10) : 1366–1369.
( 0) 0)
|
| [14] |
李月清, 王英杰.
白芍总苷对慢性荨麻疹T细胞免疫功能的影响[J]. 中外健康文摘 , 2012, 9 (5) : 66–67.
( 0) 0)
|
| [15] |
梁小红.
白芍总苷对系统性红斑狼疮患者IL-8、TNF-α和INF-α表达的影响[J]. 中国现代药物应用 , 2008, 2 (24) : 64–66.
( 0) 0)
|
| [16] |
丁娟.
白芍总苷对BALB/c银屑病小鼠皮肤组织及外周血VEGF mRNA表达的影响[J]. 实用药物与临床 , 2015, 18 (10) : 1161–1163.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31

