2. 天津海光药业股份有限公司, 天津 300457;
3. 河南大学 药学院, 河南 开封 475000
2. Tianjin Haiguang Pharmaceutical Co., Ltd., Tianjin 300457, China;
3. Shool of Pharmacy, Henan University, Kaifeng 475000, China
阿哌沙班,化学名为l-(4-甲氧基苯基)-7-氧代- 6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-甲酰胺,是由百时美施贵宝公司和辉瑞公司联合研制的一种新型口服直接Xa因子抑制剂。于2011年3月在欧盟批准上市,商品名Eliquis,临床用于预防进行择期髋关节或膝关节置换术的成年患者出现的静脉血栓栓塞症[1-2]。临床研究表明,与每日注射1次依诺肝素相比,每日口服两次阿哌沙班对预防全膝和全髋关节置换术后出现的静脉血栓栓塞症效果更好,且不会增加出血风险[3-4]。本品具有安全性高、不必接受监测以调整剂量、可口服、无交叉耐药性及不良反应少等优点,有望成为口服抗血栓的一线药物[5]。
通过对阿哌沙班原料药进行质量研究,发现阿哌沙班成品中有3个较大杂质,通过精制很难除去,在阿哌沙班产品的LC-MS图谱中,这3个杂质的保留时间分别为16.926、2.752、14.236 min,其分子离子峰分别为489.2、461.2、475.2,结合阿哌沙班的反应机制及文献资料[6],推测这3个杂质可能是l-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-甲酸乙酯(1)、l-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶- 1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-甲酸)(2)、l-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶- 1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-甲酸甲酯)(3)。本课题组对这3个化合物进行了合成,并进行了纯化方法的考察,通过纯化使得这3个杂质的质量分数均大于98%,利用LC-MS、1H-NMR和13C-NMR确证结构,通过HPLC进一步证实了这3个化合物为阿哌沙班的主要杂质,这对建立和完善阿哌沙班的分析方法,制定已知杂质的限度,提高质量标准,具有重要意义。
本实验以2-氯-2-[2-(4-甲氧基苯基)亚肼基]乙酸乙酯和5,6-二氢-3-(4-吗啉基)-1-[4-(2-氧代-1-哌啶基)苯基]-2(1H)-吡啶酮为起始原料,经过环合、水解得到目标化合物1,目标化合物1分别经过水解和取代反应得到目标化合物2和3。目标化合物的合成路线见图 1。
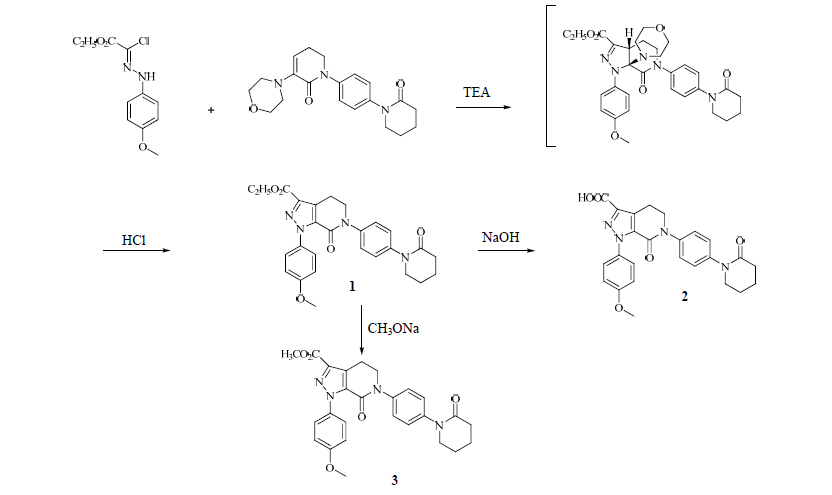
|
图 1 目标化合物的合成路线 Fig. 1 Synthesis route of target compounds |
1 仪器与试剂
Agilent 1200高效液相色谱仪;Bruker 400 MHz 核磁共振仪;2-氯-2-[2-(4-甲氧基苯基)亚肼基]乙酸乙酯(质量分数>98%);5,6-二氢-3-(4-吗啉基)-1-[4-(2-氧代-1-哌啶基)苯基]-2(1H)-吡啶酮(质量分数>98%);其他试剂均为国产分析纯。
2 方法与结果 2.1 l-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-甲酸乙酯)(1)的合成[7]室温条件下,向配有球形冷凝管、温度计、恒压滴液漏斗、机械搅拌的2 L四口瓶中,加入2-氯- 2-[2-(4-甲氧基苯基)亚肼基]乙酸乙酯(60 g,0.23 mol),醋酸乙酯1 200 mL,搅拌,完全溶解后,继续加入5,6-二氢-3-(4-吗啉基)-1-[4-(2-氧代-1-哌啶基)苯基]-2(1H)-吡啶酮(61 g,0.17 mol),通氮气保护,搅拌15 min后得悬浊液,滴加三乙胺80 mL,滴毕,加热升温至65 ℃,保温反应8 h后,降温至20 ℃,滴加4 mol/L盐酸72 mL,滴毕,加热升温至45 ℃,反应3 h后,降温至25 ℃,加入碳酸氢钠溶液调pH值至6,静置,分液,有机层用水洗(200 mL×2),无水硫酸钠干燥,次日,滤过,滤液蒸干。得化合物1粗品(70 g),收率84%,归一化法测得质量分数为92.5%。
2.2 化合物1的纯化室温条件下,向配有球形冷凝管、温度计的1 L四口瓶中,加入化合物1粗品(70 g),乙醇700 mL,磁力搅拌,回流温度下至溶清,加入活性碳0.8 g,脱色30 min,热滤,滤液冷却至室温,析晶4 h,滤过,抽干,得浅黄色固体(60 g),收率86%,面积归一化法测得质量分数为99.3%。ESI-MS m/z:489.2 [M+H]+。1H-NMR(400 MHz,DMSO-d6)δ:1.32(3H,t,J=7.2 Hz,CH3),1.83(4H,m,CH2×2),2.37(2H,t,J=6.4 Hz,CH2),3.19(2H,t,J=6.4 Hz,CH2),3.57(2H,t,J=5.2 Hz,CH2),3.79(3H,s,OCH3),4.06(2H,t,J=6.8 Hz,CH2),4.33(2H,m,CH2),6.99(2H,d,J=6.8 Hz,Ar-H),7.26(2H,d,J=6.8 Hz,Ar-H),7.34(2H,d,J=8.8 Hz,Ar-H),7.47(2H,d,J=7.2 Hz,Ar-H)。13C-NMR(100 MHz,DMSO-d6)δ:14.12,20.84,21.09,22.95,32.54,50.65,50.76,55.43,60.55,87.11,87.98,113.41,125.95,126.28,126.69,132.40,132.96,138.39,139.61,141.41,156.32,159.26,161.33,168.79。
2.3 l-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-甲酸)(2)的合成室温条件下,向配有球形冷凝管、温度计的500 mL四口瓶中,加入化合物1(20 g,0.041 mol),醋酸乙酯200 mL,磁力搅拌,升温至45 ℃,溶解至澄清后,滴加入10%氢氧化钠水溶液32 mL,滴加完毕,45 ℃搅拌30 min后,加入水100 mL,醋酸乙酯50 mL,转移至分液漏斗中,分出水层,室温下滴加2 mol/L盐酸25 mL,滴加过程中有浅黄色固体产生,滴毕,室温下搅拌2 h,滤过,抽干,水洗,得化合物2粗品(13 g),收率88%,归一化法测得质量分数为96%。
2.4 化合物2的纯化室温条件下,向配有球形冷凝管、温度计的250 mL四口瓶中,加入化合物2粗品(13 g),乙醇150 mL,磁力搅拌,回流温度下至溶清,加入活性碳0.2 g,搅拌脱色30 min,热滤,滤液冷却至室温析晶4 h,滤过,抽干,得浅黄色固体(11 g),收率85%,归一化法测得质量分数为99.1%。ESI-MS m/z:461.2 [M+H]+。1H-NMR(400 MHz,DMSO-d6)δ:1.84(4H,m,CH2×2),2.37(2H,t,J=6.4 Hz,CH2),3.17(2H,t,J=6.8 Hz,CH2,),3.57(2H,t,J=5.6 Hz,CH2),3.79(3H,s,CH3),4.05(2H,t,J=6.4 Hz,CH2),6.98(2H,d,J=9.2 Hz,Ar-H),7.26(2H,d,J=8.8 Hz,Ar-H),7.33(2H,d,J=8.8 Hz,Ar-H),7.47(2H,d,J=8.8 Hz,Ar-H),13.15(1H,s,COOH)。13C-NMR(100 MHz,DMSO-d6)δ:20.84,21.17,22.95,32.54,50.71,50.76,55.42,113.38,125.94,126.27,126.63,126.76,132.50,132.84,139.26,139.68,141.36,156.43,159.17,162.83,168.79。
2.5 l-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-甲酸甲酯)(3)的合成[8]室温条件下,向配有球形冷凝管、温度计的500 mL四口瓶中,加入化合物1(20 g,0.041 mol),DMF 160 mL,甲醇80 mL,磁力搅拌,室温下搅拌溶清后,加入原甲酸三甲酯4 mL,三氟乙酸1.5 mL,升温至45 ℃反应0.5 h后,滴加25%甲醇钠的甲醇溶液24.8 g,滴加完毕,反应1 h,将反应液滴加入1 000 mL冰水中,析出絮状固体,继续搅拌2 h,滤过,抽干,得化合物3粗品12 g。收率90%,归一化法测得质量分数为97%。
2.6 化合物3的纯化室温条件下,向配有球形冷凝管、温度计的250 mL四口瓶中,加入化合物3粗品(12 g),甲醇120 mL,磁力搅拌,回流温度下至溶清,加入活性碳0.2 g,脱色30 min,热滤,滤液冷却至室温,析晶4 h,滤过,抽干,得浅黄色固体(10 g),收率83%,归一化法测得质量分数为99.2%。ESI-MS m/z:475.2 [M+H]+。1H-NMR(400 MHz,DMSO-d6)δ:1.83(4H,m,CH2×2),2.37(2H,t,J=6.0 Hz,CH2),3.18(2H,t,J=6.4 Hz,CH2),3.57(2H,t,J=4.4 Hz,CH2),3.79(3H,s,CH3),3.86(3H,s,CH3),4.06(2H,t,J=6.4 Hz,CH2),6.99(2H,d,J=9.2 Hz,Ar-H),7.27(2H,d,J=8.4 Hz,Ar-H),7.34(2H,d,J=8.8 Hz,Ar-H),7.49(2H,d,J=8.8 Hz,Ar-H)。13C-NMR(100 MHz,DMSO-d6)δ:20.84,21.05,22.94,32.54,50.62,50.75,51.76,55.41,113.40,125.92,126.26,126.61,126.79,132.37,132.93,138.19,139.60,141.40,156.30,159.26,161.79,168.78。
2.7 HPLC色谱条件色谱条件:Agilent Zobrax Eclipse Plus C18色谱柱(150 mm×4.6 mm,5 μm);流动相:30 mmol/L乙酸铵(A)-乙腈(B),梯度洗脱,0~3 min,80%A,3~15 min,80%A→70%A,15~22 min,70%A→40%A,22~35 min,40%A→80%A;柱温:35 ℃;体积流量:1.0 mL/min;检测波长:280 nm。
在上述条件下,化合物1、2、3的保留时间分别为16.926、2.752、14.236 min,阿哌沙班产品中3个主要杂质的保留时间分别为16.929、2.758、14.239 min,将化合物1、2、3加入到阿哌沙班中进行高效液相色谱分析,结果显示对应的杂质峰都明显增加,即可确定化合物1、2、3即为阿哌沙班中的3个主要杂质。见图 2。
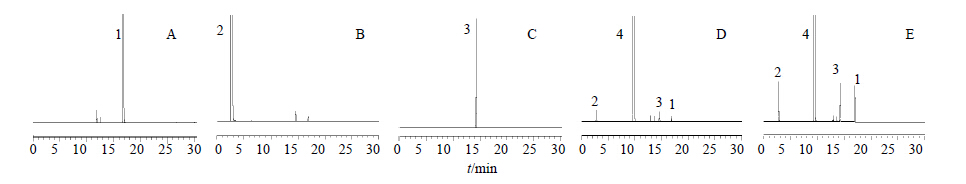
|
图 2 化合物1(A)、化合物2(B)、化合物3(C)、阿哌沙班(D)和化合物1、2、3+阿哌沙班混合物(E)的HPLC色谱图 Fig. 2 HPLC chromatograms of compound 1 (A),compound 2 (B),compound 3 (C),apixaban (D),and compounds 1,2,and 3 + apixaban (E) 1-化合物1 2-化合物2 3-化合物3 4-阿哌沙班 1-compound 1 2-compound 2 3-compound 3 4-apixaban |
3 讨论
药品是特殊的商品,药品杂质是影响药品质量的重要因素,故应该弄清杂质的来源、性质、检测方法及其限量,同时改善工艺条件,降低杂质的产生,并制定相应法规,从多方面保证和提高药品的质量,减少药物的不良反应[9-10]。 通过对阿哌沙班3个杂质的合成以及结构分析,发现化合物1和3的产生与反应体系中甲醇钠的用量和反应时间相关,而化合物2的产生与反应体系中的水分相关,且化合物2是降解杂质,根据仿制药申报要求,在原料药中,这3个已知杂质的限度均需要小于千分之一,如果仅依靠精制方法使这3个杂质符合限度要求很难,且多次精制严重影响原料药的收率,造成成本过高。结合这3个杂质的性质及生成原理,可以通过控制反应中甲醇钠的用量和反应时间以及反应体系中的水分来减少这3个杂质的产生,从而使粗品中这3个杂质一次精制,阿哌沙班原料药的纯度能达到99.6%以上。
| [1] |
Wittkowsky A K.
New oral anticoagulants:a practical guide for clinicians. J Thromb Thrombolysis , 2010, 29 (2) : 182–191.
DOI:10.1007/s11239-009-0409-0 ( 0) 0)
|
| [2] |
许昕, 薛晓文. 开发中的新型口服抗凝血药-Xa因子抑制剂[J].
许昕, 薛晓文.
开发中的新型口服抗凝血药-Xa因子抑制剂. 药学与临床研究 , 2010, 18 (3) : 294–298.
( 0) 0)
|
| [3] |
王磊, 钟静芬, 时惠麟. 口服Xa因子直接抑制剂阿哌沙班的临床研究进展[J].
王磊, 钟静芬, 时惠麟.
口服Xa因子直接抑制剂阿哌沙班的临床研究进展. 上海医药 , 2012, 33 (17) : 17–20.
( 0) 0)
|
| [4] |
Ramirez A, Mudryk B, Rossano L, et al.
A mechanistic study on the amidation of esters mediated by sodium form amide. J Org Chem , 2012, 77 (1) : 775–779.
DOI:10.1021/jo2021828 ( 0) 0)
|
| [5] |
Maxwell1 B D, Tran S B, Chen S Y, et al.
The syntheses and in vitro biotransformation studies of[14C]apixaban,a highly potent,selective,efficacious and orally bioavailable inhibitor of blood coagulation factor Xa. J Label Compd Radiopharm , 2011, 54 (18) : 418–425.
( 0) 0)
|
| [6] |
Landge S B, Jadhav S A, Dahale S B, et al.
Development and validation of stability indicating RP-HPLC method on core shell column for determination of degradation and process related impurities of apixaban-an anticoagulant drug. AJAC , 2015, 6 : 539–550.
DOI:10.4236/ajac.2015.66052 ( 0) 0)
|
| [7] |
王冠, 郭晔堃, 钟静芬, 等. 阿哌沙班合成路线图解[J].
王冠, 郭晔堃, 钟静芬, 等.
阿哌沙班合成路线图解. 中国医药工业杂志 , 2012, 43 (2) : 157–159.
( 0) 0)
|
| [8] |
Ramirez A, Mudryk B, Rossano L, et al.
A mechanistic study on the amidation of esters mediated by sodium. J Org Chem , 2012, 77 (1) : 775–779.
DOI:10.1021/jo2021828 ( 0) 0)
|
| [9] |
李真, 龚培力, 曾繁典, 等. 药物杂质及其对安全性的影响[J].
李真, 龚培力, 曾繁典, 等.
药物杂质及其对安全性的影响. 中国临床药理学杂志 , 2001, 17 (6) : 451–453.
( 0) 0)
|
| [10] |
胡向青, 郝福, 李志刚, 等. 药物中杂质及有害物质控制限度的研究进展[J].
胡向青, 郝福, 李志刚, 等.
药物中杂质及有害物质控制限度的研究进展. 现代药物与临床 , 2014, 29 (9) : 953–964.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


