螺内酯属于醛固酮竞争性抑制剂,与高效利尿药物(如噻嗪类)联合应用,既能提高药物的疗效,又能减少钾的排出,防止电解质紊乱[1]。螺内酯联合呋塞米用于治疗舒张性心力衰竭[2]及肝硬化复发性腹水[3],其作用机制为能促进水、钠、氯排除,缓解腹水,避免低血钾症或高血钾症[4]。Lasilactone是由法国赛诺菲安万特制药公司开发的保钾利尿剂,用于原发性高血压、慢性充血性心力衰竭和肝硬化导致的水肿等疾病的治疗[5]。本研究以螺内酯和呋塞米的溶出度为指标,采用单因素试验优选复方呋塞米螺内酯片的最佳处方。
1 仪器与试剂UV-1801紫外-可见分光光度计(北京瑞利分析仪器公司),pHS-2C酸度计(上海理达仪器厂),KQ-100超声波清洗器(昆山市超声仪器有限公司),ZRS-8G智能溶出仪(天津大学无线电厂),TDP单冲压片机(上海第一制药机械厂),ZB-lE智能崩解仪(天津市天大天发科技有限公司)。
呋塞米对照品、原料药(东北制药厂有限公司提供,质量分数>99.72%),螺内酯对照品、原料药(浙江新华制药有限公司提供,质量分数>99.47%);微晶纤维素PH101(批号140301)、乳糖(批号140506)、交联聚维酮(批号140603)、淀粉(批号130511)、硬脂酸镁(批号140407)均由安徽山河辅料有限公司提供;其他化学试剂均为分析纯。
2 方法与结果 2.1 溶出度的测定 2.1.1 色谱条件[6]Thermo Syncronis C18色谱柱(250 mm×4.6 mm,5 m);流动相:乙腈-1%冰醋酸水(60∶40);检测波长:238 nm;体积流量1.0 mL/min,柱温:30℃ ;进样量:20 μL。
2.1.2 专属性试验称取螺内酯对照品12.5 mg,精密称定,置25 mL量瓶中,加溶出介质稀释至刻度,摇匀,即得500 μg/mL贮备液。精密量取上述母液1.0 mL,置10 mL量瓶中,用溶出介质(pH 1.0盐酸溶液且含有0.1%十二烷基硫酸钠的缓冲溶液)稀释至刻度,摇匀,作为螺内酯对照品溶液。称取呋塞米对照品5.0 mg,精密称定,置25 mL量瓶中,以pH 5.8磷酸盐缓冲溶液溶解并稀释至刻度,摇匀,得200 μg/mL的贮备液。精密量取上述母液1.0 mL,置10 mL量瓶中, 用溶出介质稀释至刻度,摇匀,作为呋塞米对照品溶液。按处方比例称取空白辅料适量,用溶出介质配制成一定浓度的溶液,滤过,取续滤液作为空白辅料溶液。精密吸取溶剂、空白辅料溶液、螺内酯和呋塞米对照品溶液各20 μL,注入液相色谱仪,记录色谱图。结果溶剂和辅料对螺内酯和呋塞米的测定无干扰。
2.1.3 线性关系考察取以上制备的500 μg/mL螺内酯对照品贮备液适量,以溶出介质稀释,配制5.0、10.0、20.0、25.0、30.0、40.0、50.0、60.0 μg/mL螺内酯系列对照品溶液。精密吸取上述各溶液20 μL,注入液相色谱仪,记录峰面积。以峰面积对质量浓度进行线性回归,得回归方程Y=47 459.4 X+51 632.9,r=1.000。结果表明呋塞米在5.0~60.0 μg/mL与峰面积呈良好的线性关系。
取200 μg/mL呋塞米对照品贮备液适量。以溶出介质稀释,配制2.0、4.0、8.0、10.0、12.0、16.0、20.0 μg/mL呋塞米系列对照品溶液。精密吸取上述各对照品溶液20 μL,注入液相色谱仪,记录峰面积。以峰面积对质量浓度进行线性回归,得回归方程Y=94 279.75 X+34 727.6,r=0.999 9,结果表明呋塞米在2.0~20.0 μg/mL时与峰面积呈良好的线性关系。
2.1.4 溶出均一性试验取复方呋塞米螺内酯片6片,以0.1% SDS、0.1 mol/L HCl为溶出介质,平行操作6次,测定螺内酯和呋塞米溶出度,结果RSD值分别为1.55%、2.51%;结果表明,此方法溶出均一性良好。
2.1.5 稳定性试验取复方呋塞米螺内酯片溶出样品溶液,于室温下避光放置,分别于0、1、2、4、6、8、10 h进样测定,记录螺内酯和呋塞米峰面积,结果螺内酯峰面积RSD值<2.0%,呋塞米峰面积RSD值<2.0%,表明溶液8 h内稳定。
2.1.6 回收率试验称取螺内酯对照品25.0、40.0、50.0 mg,各3份,精密称定,置100 mL量瓶中,加入处方量混合空白辅料,以溶出介质稀释至刻度,摇匀,滤过。分别精密移取上述溶液1.0 mL,置10 mL量瓶中,溶出介质稀释至刻度,作为供试品溶液。精密称取螺内酯对照品适量,用流动相配制成50 μg/mL溶液,作为对照品溶液。精密吸取供试品、对照品溶液各20 μL注入液相色谱仪,记录峰面积,计算回收率,结果平均回收率为101.86%,RSD值为1.24%(n=9)。
称取呋塞米对照品约10.0、16.0、20.0 mg,各3份,精密称定,置100 mL量瓶中,加入处方量混合空白辅料,溶出介质稀释至刻度,超声使其完全溶解,滤过;分别精密移取上述溶液1 mL,置10 mL量瓶中,溶出介质稀释至刻度,作为供试品溶液;精密称取呋塞米对照品适量,用流动相配制20 μg/mL溶液,作为对照品溶液。精密吸取供试品和对照品溶液各20 μL注入液相色谱仪,记录峰面积,计算回收率,结果平均回收率为101.31%,RSD值为1.58%(n=9)。
2.1.7 测定法[7]按照《中国药典》2015年版二部附录XC第三法,以pH 1.0盐酸溶液且含有0.1%十二烷基硫酸钠的缓冲溶液为溶出介质,转速为75 r/min,分别于5、10、15、20、30、45、60 min量取溶液10 mL,滤过,取续滤液作为供试品溶液;另取螺内酯对照品溶液,分别精密移取上述两种溶液各20 μL注入液相色谱仪,记录峰面积,以外标法计算螺内酯的溶出度。
按照《中国药典》2015年版二部附录XC第三法,以pH 5.8磷酸盐缓冲溶液为溶出介质,转速为50 r/min,依法操作,经30 min后,取溶液10 mL,滤过,取续滤液作为供试品溶液;另取呋塞米对照品溶液,分别精密移取上述两种溶液各20 μL注入液相色谱仪,记录峰面积,以外标法计算呋塞米的溶出度。
2.2 制备工艺流程参考lasilactone胶囊的说明书[4],制定制剂制备工艺:称取处方量的呋塞米、螺内酯原料药,备用;称取处方量微晶纤维素、乳糖、交联聚维酮、十二烷基硫酸钠,与呋塞米、螺内酯原料药混合均匀;以8%淀粉浆制软材,并过20目筛网进行制粒;将湿颗粒在60 ℃条件下,干燥1.5~2 h;取干燥后的颗粒以16目筛网进行整粒;加入处方量的硬脂酸镁,混合均匀,以8 mm浅凹冲压片,即得。
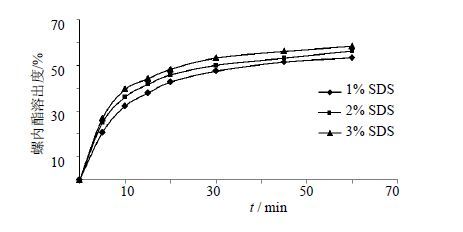
2.3 表面活性剂用量筛选本制剂中螺内酯静电作用强,且为难溶性药物,因此需要加入表面活性剂SDS以消除静电作用,同时促进螺内酯的溶出释放。以SDS为表面活性剂,按照工艺制备片剂,考察其在处方中所占的比例为1%、2%、3%时对溶出度的影响,结果见图 1。结果表明,当SDS的用量为1%、2%时,消除静电作用较弱,用量为3%时能够达到消除静电的作用,且能够促进螺内酯的溶出。因此将表面活性剂SDS的用量定为3%。
|
图 1 SDS不同用量对螺内酯溶出度的影响 Fig. 1 Effect of different amounts of SDS on dissolution |
2.4 填充剂的选择
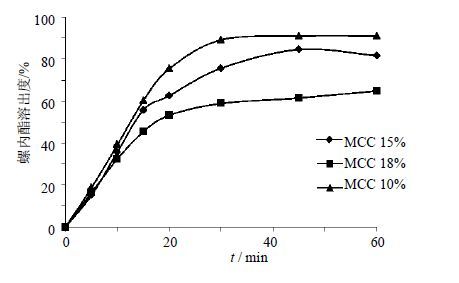
选择微晶纤维素和乳糖作为填充剂,调节两者的比例,考察混合填充剂对压片成形性的影响,见表 1,对螺内酯溶出度的影响见图 2。结果表明,当微晶纤维素的比例为0、5%时,压片过程中出现黏冲现象,片剂成型性较差,因此不再考察其溶出度情况。随着微晶纤维素比例的增加,处方可压性和外观亮泽度均上升,崩解时间随微晶纤维素量的增加,崩解时间变长,且随微晶纤维素比例的增加,螺内酯溶出度降低,因此选定微晶纤维素的比例为10%。
| 表 1 微晶纤维素与乳糖在处方中的比例 Table 1 Proportion of MCC and lactose in prescription |
|
图 2 微晶纤维素的比例对螺内酯溶出度的影响 Fig. 2 Effect of proportion of MCC in prescription on dissolution of spironolactone |
2.5 崩解剂的选择
片剂常用的崩解剂有交联聚维酮(PVPP)、低取代羟丙甲纤维素(L-HPC)、交联羧甲基纤维素纳(CCNa)、羧甲基淀粉钠(CMS-Na)。实验以崩解时限为指标考察L-HPC、PVPP、CCNa、CMS-Na在相同用量(5%)情况下的崩解行为,比较片剂的崩解效果,结果见表 2。
| 表 2 不同崩解剂的崩解效果比较(n= 6) Table 2 Comparison of various types of disintegrates ondisintegrate time (n = 6) |
结果表明,L-HPC崩解较慢,PVPP崩解性能最为优越,CCNa、CMS-Na较PVPP稍差。因此选用PVPP作为崩解剂并考察其加入方法。
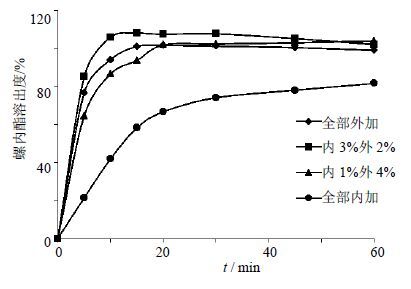
将崩解剂分别以全部外加法、内1%外4%法、内3%外2%法、全部内加法制备制剂,考察崩解剂不同的加入方法对压片和螺内酯溶出度的影响,见图 3。结果表明,当崩解剂PVPP全部外加法时,片剂可压性差,压力不合格;当崩解剂PVPP内1%外4%法时,片剂出现裂片情况;当PVPP加入方法为内3%外2%时,制剂溶出完全,溶出效果较好。因此最终选择5% PVPP并且以内3%外2%法加入作为崩解剂。
|
图 3 PVPP不同加入方式对螺内酯溶出度的影响 Fig. 3 Effect of various adding ways of PVPP on dissolution |
2.6 最优处方条件
将各辅料分别过80目筛,备用;称取处方量呋塞米、螺内酯原料药,备用;称取3%处方量十二烷基硫酸钠与呋塞米、螺内酯原料药混合均匀;称取处方量微晶纤维素、乳糖(10%∶46.5%)以及3/5处方量的交联聚维酮与前一步混合物进行混合;以8%淀粉浆制软材,过20目筛网进行制粒;将湿颗粒在60 ℃,干燥1.5~2 h;取干燥后的颗粒以16目筛网进行整粒;将0.5%处方量的硬脂酸镁和2/5处方量的PVPP加入上述干颗粒中,混合均匀,以8 mm浅凹冲,压片即得。按最优处方工艺制备3批片剂,考察外观、硬度、溶出度,见表 3。结果表明样品外观光洁,硬度较好,溶出度符合要求。
| 表 3 验证试验结果 Table 3 Result of verification test |
2.7 稳定性考察
将批号150406复方呋塞米螺内酯片置于适宜的密封洁净容器中,分别在40、60 ℃恒温干燥箱内放置10 d,在0、5、10 d取样,进行外观性状、溶出度的检测,见表 4。结果表明,复方呋塞米螺内酯片在40、60 ℃恒温加速考察10 d,外观性状未发生改变,溶出情况稳定。
| 表 4 稳定性试验结果 Table 4 Results of stable test |
3 讨论
实验以溶出度为指标,对复方呋塞米螺内酯片处方工艺进行优化。螺内酯的水溶性较差,为提高溶解度,将原料过80筛。处方中使用了十二烷基硫酸钠,有助于提高药物的溶出度,并消除部分静电作用。通过筛选微晶纤维素与乳糖的比例,优选出适宜的比例进行压片,使片剂成型性、可压性良好,溶出度符合要求。
对复方呋塞米螺内酯片进行初步稳定性考察结果表明,其稳定性良好,但还需要对其进行加速试验及长期试验,考察其质量的稳定性,为进一步放大研究提供参考。
| [1] |
Pitt B, Zannad F, Remme W J, et al. The effect of spironolactone on the morbidity and mortality in patients with severe heart failure[J].
N Eng J Med,1999, 341 (10) : 709-717.
( 0) 0)
|
| [2] |
赵晓雪, 李卉, 杨玲, 等. 合适剂量呋塞米和螺内 酯联合治疗老年舒张性心力衰竭的临床疗效[J].
中国 老年学杂志,2015, 35 (22) : 6394-6396.
( 0) 0)
|
| [3] |
林兴达. 螺内酯联合呋塞米治疗肝硬化复发性腹水的 疗效观察[J].
医学信息,2012, 25 (9) : 390-391.
( 0) 0)
|
| [4] |
刘建军. 如何理解肝硬化腹水患者限钠与补钠问题[J].
临床肝胆杂志,2009, 25 (3) : 163-166.
( 0) 0)
|
| [5] |
Lasilactone. The Royal Society of Medicine, January 2002. p325.
( 0) 0)
|
| [6] |
颜雨, 张勉, 李超. 高效液相色谱法测定螺内酯 的含量[J].
中国药业,2010, 19 (17) : 27-28.
( 0) 0)
|
| [7] |
中国药典 [S]. 二部. 2015: 1588.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


