复方愈麻美芬缓释片为复方制剂,含愈创甘油醚、盐酸伪麻黄碱和氢溴酸右美沙芬,是感冒、镇咳、祛痰的有效治疗药物。本研究观察了复方愈麻美芬缓释片单次、多次给药后在健康志愿者体内的药动学,探讨药物在人体内的吸收、分布、代谢和排泄的特点,评价制剂的缓释特征,为临床用药提供参考依据。
1 材料 1.1 药品受试制剂:复方愈麻美芬缓释片,每片含愈创甘油醚600 mg,盐酸伪麻黄碱60 mg,氢溴酸右美沙芬30 mg,批号071101,由天津药物研究院研制。
参比制剂:愈创甘油醚片,山西远景康业制药有限公司生产,规格200 mg/片,批号070201;布洛伪麻片,沈阳圣元药业有限公司生产,每片含布洛芬0.2 g、盐酸伪麻黄碱30 mg,批号20070903;氢溴酸右美沙芬片,广州白云山光华制药股份有限公司生产,规格15 mg/片,批号T27013。
1.2 仪器美国Finnigan公司TSQQuantum型液相色谱-质谱联用仪(LC/MS/MS),配有电喷雾离子化电离源(ESI),以及Xcalibur 1.4控制软件,Lcquan 2.0数据处理系统,美国Sur-veyor液相泵及自动进样器。
1.3 受试者健康男性(34±2)岁,身高(172±2)cm,体质量(65.0±3.9)kg,体质量指数19~24。受试者无既往病史和药物过敏史,精神状况良好,无烟酒嗜好,试验前各项体检证明其心、肝、肾功能正常,并愿意签署知情同意书。试验经有关部门批准。
2 方法与结果 2.1 血浆中愈创甘油醚、伪麻黄碱、右美沙芬和O-去甲右美沙芬的LC/MS/MS法测定按照人体药动学研究的有关指导原则[1-2],采用LC/MS/MS法测定受试者服药后血浆中愈创甘油醚、伪麻黄碱、右美沙芬和O-去甲右美沙芬的浓度(酶水解后的总浓度)。
愈创甘油醚的线性范围为2.00~2 000.00 ng/mL,定量下限浓度为2.00 ng/mL;在4.00、100、1 800 ng/mL浓度下的日内精密度RSD值均小于6.7%,日间精密度RSD值均小于10.2%,准确度(RE)在−5.8%~5.2%。
伪麻黄碱的线性范围为0.25~500.00 ng/mL,定量下限浓度为0.250 ng/mL;在0.50、5.00、90.00、450.00 ng/mL浓度下的日内精密度RSD值在1.7%~5.0%,准确度(RE)在−9.6%~11.1%。
右美沙芬线性范围为0.05~50.00 ng/mL。在0.100、1.00、18.0、45.0 ng/mL浓度下日内精密度RSD值在1.9%~6.8%,准确度(RE)在−9.4%~3.4%。
O-去甲右美沙芬的线性范围为1.00~400 ng/mL,定量下限浓度为1.00 ng/mL,在2.0、20.0、360.0 ng/mL浓度下的日内精密度RSD值在4.2%~9.3%,日间精密度RSD值在5.2%~11.0%,准确度(RE)在0.5%~2.7%。
2.2 单次给药的药动学试验 2.2.1 给药方案与血样采集采用自身对照的双周期交叉试验设计,12名受试者试验前禁食10 h以上。试验当日晨采空白血样,然后空腹口服受试制剂或参比制剂,受试制剂每人1片,相当于愈创甘油醚600 mg、盐酸伪麻黄碱60 mg、氢溴酸右美沙芬30 mg;参比制剂每人愈创甘油醚片3片、布洛伪麻片2片、氢溴酸右美沙芬片2片;用250 mL温开水送服,服药后2 h内禁止饮水,服药4 h后统一进食标准餐。服药后10、20、40 min以及1.0、1.5、2.0、3.0、4.0、6.0、8.0、12、16、24、36 h由前臂取静脉血4 mL,置肝素化试管中,3 500 r/min离心10 min,分离血浆于另一带塞试管中,−20 ℃冷冻。第1周期试验结束1周后进行第2周期试验。
2.2.2 药动学参数计算采用梯形法计算AUC0-t、AUC0-∞值;tmax、Cmax值采用实测值;以血药浓度对时间作半对数曲线,取消除相时间点进行线性拟合,计算消除速率常数(ke)、t1/2。
| $\text{F}\left( 单次给药 \right)=\text{AU}{{\text{C}}_{0-t}}受试制剂\text{/AU}{{\text{C}}_{0-t}}参比制剂$ |
采用方差分析比较受试制剂和参比制剂的主要药动学参数(AUC、Cmax)的差异,计算受试制剂和参比制剂AUC几何均值比的90%置信区间。tmax采用非参数统计方法。
2.2.4 血药浓度-时间曲线的制备和药动学参数的计算12名受试者参加本次试验,1名受试者中途退出,11名受试者完成试验。受试者单剂量口服试验制剂和参比制剂后,血浆中愈创甘油醚、伪麻黄碱、右美沙芬、O-去甲右美沙芬的平均浓度-时间曲线见图 1。药动学参数见表 1。
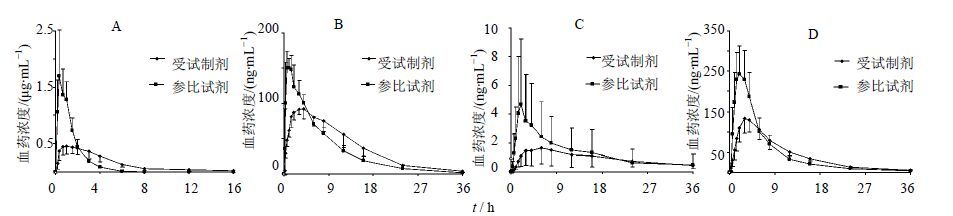
|
图 1 受试者单次给药后愈创甘油醚(A)、伪麻黄碱(B)、右美沙芬(C)和O-去甲右美沙芬(D)血药浓度-时间曲线 Fig. 1 Plasma concentration -time curves of guaifenesin (A),pseudoephedrin (B),dextromethorphan (C),and O-dextrorphan (D) after subjects received a single administration |
| 表 1 受试者单次给药后各成分的药动学参数(x±s,n = 11) Table 1 Pharmacokinetic parameters of various components of healthy volunteers after single administration (x±s,n = 11) |
2.2.5 生物利用度分析
单次给药时受试制剂和参比制剂为等剂量给药,方差分析结果显示其中愈创甘油醚、伪麻黄碱和O-去甲右美沙芬的AUC均无显著性差异,愈创甘油醚AUC0-t的几何均值比为90.0%(90%置信区间为82.4%~98.2%),伪麻黄碱AUC0-t的几何均值比为111.3%(90%置信区间为99.4%~124.7%),O-去甲右美沙芬AUC0-t的几何均值比为88.9%(90%置信区间为76.9%~102.7%)。相对生物利用度均符合>80%的要求。而3种成分的Cmax均显著下降(P<0.05),tmax均显著延长(P<0.05)。结果表明复方愈麻美芬缓释片具有明显的缓释特征,且吸收程度并没有明显下降。
2.3 多次给药的药动学试验 2.3.1 给药方案与血样采集采用自身对照的双周期交叉试验设计。单次给药的药动学试验结束,经充足的清洗期后进行多次给药试验。受试者空腹口服受试制剂或参比制剂,受试制剂2次/d,1片/次,连续给药5 d,日剂量为愈创甘油醚1 200 mg、盐酸伪麻黄碱120 mg、氢溴酸右美沙芬60 mg;参比制剂3次/d,每8小时1次,每次愈创甘油醚片、布洛伪麻片、氢溴酸右美沙芬片各1片,连续给药5 d,日剂量为愈创甘油醚600 mg,盐酸伪麻黄碱90 mg,氢溴酸右美沙芬45 mg。用250 mL温开水送服。受试者服药前至少禁食2 h,服药后继续禁食、禁水2 h,连续服药5 d(第5天受试制剂仍需服药2次,参比制剂仍需服药3次)。受试者于服药后第3、4、5天早服药前及第5天服药后20、40 min,1.0 、1.5、2、3、4、6、8、10、12(服药前采血)、12.5、13、14、15、16、18、20、24、28、36、48 h由前臂取静脉血4 mL;参比制剂采血点:多次服药的第3、4、5天早服药前及第5天服药后20、40 min,1.0、1.5、2、3、4、6、8(服药前采血)、8.33、8.67、9.0、9.5、10、11、12、14、16(服药前采血)、16.5、17、18、19、20、22、24、28、36、48 h由前臂取静脉血4 mL。采集的全血置肝素化试管中,3 500 r/min离心10 min,分离血浆于另一带塞试管中,−20 ℃冷冻。第1周期试验结束1周后进行第2周期试验。
试验期间受试者在病房休息,期间禁烟酒、含咖啡因类饮料,避免剧烈运动。在全部试验结束后1周内采用LC/MS/MS法测定血浆中愈创甘油醚、伪麻黄碱、右美沙芬浓度和O-去甲右美沙芬浓度。
2.3.2 药动学参数计算采用梯形法计算AUCss值;tmax、Cmax、Cmin值采用实测值;Cav=AUCss/ι,(ι=24 h),DF=(Cmax−Cmin)/Cav。D为日给药剂量。F(多次给药)=(AUCss受试制剂/AUCss参比制剂)×(D参比制剂/D受试制剂)。
2.3.3 统计分析采用方差分析比较受试制剂和参比制剂主要药动学参数(AUC、Cmax)的差异,并计算受试制剂和参比制剂AUC几何均值比的90%置信区间。tmax采用非参数统计方法。
2.3.4 血药浓度-时间曲线的制备和药动学参数的计算12名受试者参加本次试验,1名受试者中途退出,11名受试者完成试验。受试者多剂量口服试验制剂和参比制剂后血浆中愈创甘油醚、伪麻黄碱、右美沙芬、O-去甲右美沙芬的平均浓度-时间曲线见图 2。受试制剂与参比制剂连续给药5 d,各成分血药浓度已达稳态,药动学参数见表 2。
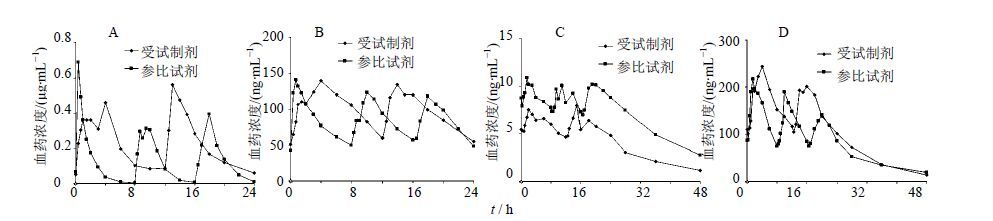
|
图 2 受试者多次给药后愈创甘油醚(A)、伪麻黄碱(B)、右美沙芬(C)和O-去甲右美沙芬(D)血药浓度-时间曲线 Fig. 2 Plasma concentration -time curves of guaifenesin (A),pseudoephedrin (B),dextromethorphan (C),and O-dextrorphan (D) after subjects received multiple administration |
| 表 2 受试者连续给药5 d达稳态后各成分的药动学参数(x±s,n = 11) Table 2 Pharmacokinetics parameters of volunteers administrated for 5 days (x±s,n = 11) |
2.3.5 生物利用度分析
多次给药时,受试制剂与参比制剂的日剂量不同,比例为愈创甘油醚2∶1,伪麻黄碱4∶3,右美沙芬4∶3。经剂量换算后的统计结果显示受试制剂与参比制剂中愈创甘油醚、伪麻黄碱和O-去甲右美沙芬的AUCss均无显著性差异,愈创甘油醚AUCss的几何均值比为77.8%(90%置信区间为66.1%~91.5%),伪麻黄碱AUCss的几何均值比为87.2%(90%置信区间为78%~97.4%),O-去甲右美沙芬AUCss的几何均值比为93.5%(90%置信区间为75.6%~115.6%)。尽管缓释片为2次/d给药,普通片为3次/d给药,但两者DF相似。
3 讨论右美沙芬是感冒复方中的常见成分,口服给药后在体内主要生成O-去甲右美沙芬,并进一步与葡萄糖醛酸结合。O-去甲右美沙芬是右美沙芬的主要活性成分。体内酶水解后O-去甲右美沙芬浓度远远高于原形药物右美沙芬浓度(50多倍),右美沙芬在体内药物浓度很低,且个体差异较大,一般均用O-去甲右美沙芬进行制剂评价[3, 4, 5],右美沙芬数据仅供参考。
评价复方愈麻方美芬缓释片的缓释特征是本实验的主要目的之一。目前无相应处方及相应释放机制的缓释制剂,因此本实验选择普通片做为参比制剂。由于市场无盐酸伪麻黄碱的单方普通制剂,只好选择了布洛伪麻片作为参比制剂之一。
在单次给药的试验设计中,采用等剂量给药的方式评价缓释片和普通片的相对生物利用度并评价缓释片的缓释特征。在多次给药时,则主要根据两种制剂的临床给药方案进行设计,这样更具有临床意义,因此2种制剂的日给药剂量不同,计算相对生物利用度时进行了剂量换算。
愈创甘油醚吸收和消除比较快,多次给药缓释片2次/d和普通片3次/d给药时均无蓄积;缓释片600 mg/次和普通片200 mg/次的达峰浓度相似,因此不会由于剂量过高增加不良反应的发生率。
| [1] |
国家食品药品监督管理局. 化学药物临床药代动力学 技术指导原则 [S]. 2005.
( 0) 0)
|
| [2] |
European Medicines Agency. Guideline on Bioanalytical Method Validation [S]. 2011: 7.
( 0) 0)
|
| [3] |
刘丹, 陈笑艳, 张逸凡, 等. 人血浆中O-去甲右美沙 芬的测定及药代动力学研究[J].
药学学报,2004, 39 (6) : 449-452.
( 0) 0)
|
| [4] |
Chen R, Wang H, Shi J, et al. Alternative methods for CYP2D6 phenotyping: comparison of dextromethorphan metabolic ratios from AUC, single point plasma, and urine[J].
Int J Clin Pharmacol Ther,2016, 54 (5) : 330-336.
( 0) 0)
|
| [5] |
Uehara S, Uno Y, Hagihira Y, et al. Marmoset cytochrome P450 2D8 in livers and small intestines metabolizes typical human P450 2D6 substrates, metoprolol, bufuralol and dextromethorphan[J].
Xenobiotica,2015, 45 (9) : 766-772.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31

