2. 山西大医院 普外科, 山西 太原 030032
2. Department of General Surgery, Shanxi Dayi Hospital, Taiyuan 030032, China
原发性肝癌是我国常见的恶性肿瘤之一。近年来,原发性肝癌的发病率和死亡率均呈上升趋势,已成为目前主要的肿瘤病因。随着中药现代化研究的深入,中药及其活性成分的抗肿瘤作用被不断发现,日益引起人们的重视。齐墩果酸是一种天然的五环三萜类化合物,主要来源于木犀科植物果实[1]。齐墩果酸具有广泛的生物学活性,包括保肝[2]、降糖[3]、调脂[4]、调节免疫[5]、抗氧化[6]、抗肿瘤[7-9]。本研究以齐墩果酸作用于人肝癌细胞HepG2,探讨其对肿瘤细胞抑制增殖、诱导细胞凋亡的影响,并分析凋亡过程中活性氧(ROS)及线粒体膜电位(MMP)的变化,为进一步的研究提供依据。
1 材料 1.1 细胞人肝癌细胞株HepG2购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 试剂齐墩果酸(货号O5504,质量分数≥97%)、二甲基亚砜(DMSO,货号V900090)、噻唑蓝试剂(MTT货号V900888)购自美国Sigma公司;标准胎牛血清FBS(货号PYG0001)、Dulbecco's Modified Eagle Medium(DMEM,货号PYG0003)购自武汉博士德生物工程有限公司;AnnexinV- FITC/PI细胞凋亡检测试剂盒(货号KGA107)、细胞凋亡线粒体膜电位检测试剂盒(JC-1,货号KGA603)、吖啶橙/溴化乙锭(AO/EB)双荧光染色试剂盒(货号KGA501)均购自南京凯基生物科技发展有限公司;活性氧检测试剂盒(DCFH-DA,上海碧云天生物科技公司,货号S0033)。
1.3 仪器HP-90型二氧化碳培养箱(力康生物医疗科技控股有限公司);双人单面垂直净化工作台(上海博讯实业有限公司);BDS200-PH型倒置生物显微镜(重庆奥特光学仪器有限责任公司);BX-51型荧光显微镜(日本Olympus公司);BS124S型精密电子天平(德国赛多利斯公司);Varioskan Flash型全波长多功能酶标仪(美国赛默飞世尔科技公司),Accuri C6型流式细胞仪(美国BD公司)。
2 方法 2.1 细胞培养HepG2细胞培养于含10% FBS的高糖DMEM培养液中,置于37 ℃、5% CO2的恒温培养箱中培养。1~2 d传代1次,取对数生长期HepG2细胞进行实验。
2.2 MTT法检测细胞增殖抑制率[10]取对数生长期的HepG2细胞,以5×104个/mL的密度、100 μL/孔接种于96孔细胞培养板中。实验设对照组、齐墩果酸组。齐墩果酸组分别加入终浓度为12.5、25.0、50.0、100.0、200.0 μmol/L齐墩果酸溶液;对照组加相同体积的培养液,每组设6个复孔,分别孵育12、24、48 h后,每孔加入20 μL MTT继续孵育4 h,弃去上清液,每孔加入100 μL DMSO,振荡器充分震荡10 min后,用酶标仪测定570 nm波长处吸光度(A)值,实验重复3次,计算细胞增殖抑制率。
| $抑制率=\left( {{A}_{对照}}-{{A}_{实验}} \right)/{{A}_{对照}}$ |
取对数生长期的HepG2细胞以5×104个/mL的密度种于6孔板内,孵育24 h至细胞贴壁,设置对照组、齐墩果酸组。齐墩果酸组分别加入终浓度为25.0、50.0、100.0 μmol/L齐墩果酸溶液,对照组加入相同体积的培养液,孵育12 h后,在光学显微镜下观察细胞形态变化。
2.4 荧光显微镜下观察AO/EB染色细胞形态变化细胞处理方法同2.3操作,每孔用磷酸缓冲盐(PBS)洗涤3次后,再加入1 mL培养基及5 μL AO/EB混合液,避光孵育5~10 min,荧光显微镜下观察细胞形态变化。
2.5 流式细胞仪检测细胞凋亡细胞处理方法同2.3操作,用不含EDTA的胰酶消化,用预冷的PBS缓冲液洗涤两次,1 000 r/min离心5 min收集1×105~5×105个细胞,分别加入5 μL荧光探针Annexin V-FITC、碘化丙啶(PI),并混匀,室温、避光、孵育5~10 min,1 h内采用流式细胞仪在488 nm激发波长、530 nm发射波长下进行检测。凋亡分析以右下象限早期凋亡细胞及右上象限晚期凋亡细胞作为凋亡细胞,调亡细胞数与总细胞数的比值即为细胞的凋亡率。实验重复3次。
2.6 流式细胞仪检测细胞内ROS[11]细胞处理方法同2.3操作,1 000 r/min离心5 min收集细胞,再用PBS缓冲液漂洗1次,离心。装载探针按照1∶1 000用无血清培养基稀释荧光探针DCFH-DA,终浓度为10.0 μmol/L,将收集好的细胞悬浮于DCFH-DA中,细胞培养箱内孵育20 min,再用无血清的培养基或PBS缓冲液洗涤3次。细胞内的ROS可将无荧光的DCFH氧化成发出绿色荧光的DCF,绿色荧光强度与细胞内ROS水平呈正比,采用488 nm激发波长、525 nm发射波长,流式细胞仪进行荧光强度检测,并经BD Accuri C6软件分析细胞内活性氧的水平。实验重复3次。
2.7 流式细胞仪检测细胞MMP[12]细胞处理方法同2.3操作,1 000 r/min离心5 min收集细胞,再用PBS漂洗1次,离心。将收集好的细胞悬浮于500 μL荧光探针JC-1中,培养箱中孵育20 min后,培养缓冲液(1×Incubation Buffer)洗涤两次,采用488 nm激发波长、530 nm发射波长下流式细胞仪检测红色和绿色荧光强度,并经BD Accuri C6软件分析,根据红绿荧光比值考察线粒体膜电位的变化。实验重复3次。
2.8 统计学分析实验数据均用x±s表示,通过SPSS 13.0软件进行统计分析,采用单因素方差分析。
3 结果 3.1 齐墩果酸对HepG2细胞增殖的影响齐墩果酸在浓度为12.5 μmol/L时即对HepG2细胞产生抑制作用。随着齐墩果酸浓度的升高,抑制率显著增加,呈现明显的时间与剂量相关性,见表 1。根据预试验及MTT法筛选结果,选择齐墩果酸作用HepG2细胞12 h,浓度为25.0、50.0、100.0 μmol/L的条件进行以下的实验。
| 表 1 齐墩果酸对HepG2细胞增殖的影响(x±s,n = 3) Table 1 Inhibition effects of oleanlic acid on growth of HepG2 cells (x±s,n = 3 ) |
3.2 光学显微镜下的细胞形态变化
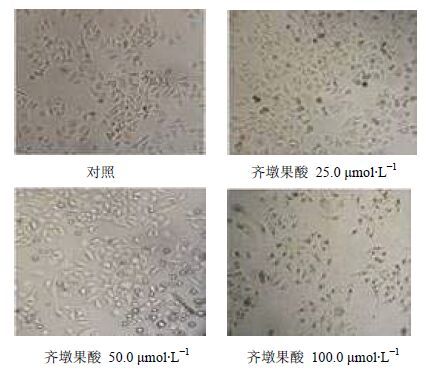
正常HepG2细胞贴壁生长良好、排列紧密且轮廓清楚;经不同浓度齐墩果酸处理后,细胞形态均发生变化,细胞变圆漂浮、间隙增大且碎片增多,并随着浓度的升高,细胞形态有明显变化,见图 1。
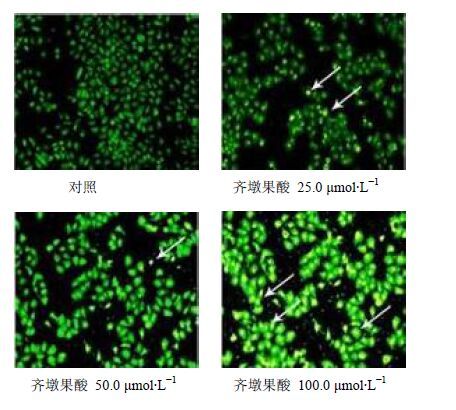
3.3 荧光显微镜下AO/EB染色后细胞形态变化正常细胞发绿色荧光且形态完整;经过齐墩果酸处理后的细胞发黄色荧光且形态模糊,并随着齐墩果酸浓度升高,早期凋亡细胞数量增加,见图 2。
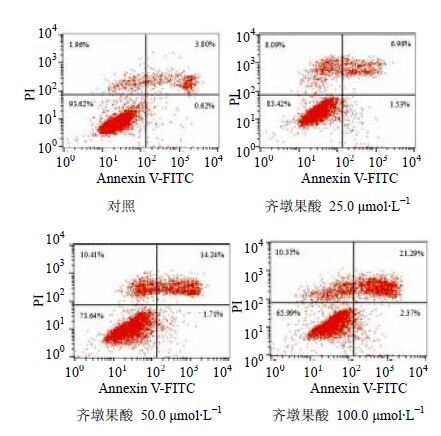
3.4 齐墩果酸对HepG2细胞凋亡的影响与对照组早期细胞凋亡率0.62%、晚期细胞凋亡率3.80%比较,齐墩果酸组凋亡率显著升高。细胞总凋亡率随着齐墩果酸浓度增加而升高,见表 2。
| 表 2 齐墩果酸对HepG2细胞细胞凋亡影响(x±s,n = 3) Table 2 Effects of oleanlic acid on apoptosis of HepG2 cells (x±s,n = 3 ) |
HepG2细胞在25.0 μmol/L齐墩果酸作用12 h后,早期细胞凋亡率为1.53%,晚期细胞凋亡率为6.96%;在50.0 μmol/L齐墩果酸时,早期细胞凋亡率为1.71%,晚期细胞凋亡率为14.24%;在100.0 μmol/L齐墩果酸时,早期细胞凋亡率为2.37%,晚期细胞凋亡率为21.29%。见图 3。
|
图 1 光学显微镜下HepG2细胞的形态变化 Fig. 1 Morphology of HepG2 cells under optical microscope |
|
图 2 荧光显微镜下HepG2细胞的形态变化 Fig. 2 Morphology of HepG2 cells under fluorescence microscopy |
|
图 3 齐墩果酸诱导HepG2细胞凋亡的流式细胞仪分析结果 Fig. 3 Results of flow cytometry on apoptosis of HepG2 cells treated with OA |
3.5 齐墩果酸对HepG2细胞内ROS的影响
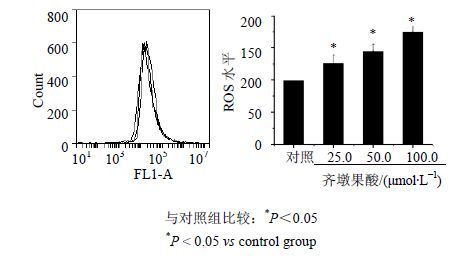
齐墩果酸在25.0~100.0 μmol/L浓度时,细胞中ROS水平随着齐墩果酸浓度的增加而升高,在100.0 μmol/L浓度时ROS水平升高到145.15%,见图 4。
|
图 4 齐墩果酸对HepG2细胞内ROS的影响(x±s,n = 3) Fig. 4 Effects of oleanlic acid on intracellular ROS levels of HepG2 cells (x±s,n = 3 ) |
3.6 齐墩果酸对HepG2细胞MMP的影响
细胞内的MMP水平随着齐墩果酸浓度的增加而降低,在100.0 μmol/L浓度时MMP降到正常值的51.79%,见表 3。
| 表 3 齐墩果酸对HepG2细胞内MMP影响(x±s,n = 3) Table 3 Effects of oleanlic acid on MMP levels of HepG2 cells (x±s,n = 3 ) |
4 讨论
齐墩果酸作为一种天然的五环三萜类化合物,具有较好的抗肿瘤活性,能对多种肿瘤细胞发挥作用,如白血病HL-60细胞[13]、人肺巨细胞癌PGCL3[14]、人肝癌细胞HuH7[15]。本研究探讨了齐墩果酸诱导肝癌HepG2细胞凋亡及其作用机制。
线粒体作为细胞能量产生的主要场所,在细胞有氧呼吸过程中会产生许多含氧物质,其中ROS作为一个典型代表,即线粒体是ROS产生的重要场所。有报道表明ROS在凋亡发生过程中起着重要的作用,许多抗肿瘤药物如多柔比星[16]、长春新碱[17]能够通过增加ROS水平诱导肿瘤细胞凋亡。同时大量文献也证实[18],线粒体膜电位在细胞凋亡中发挥关键的作用,并受到ROS水平的影响,线粒体在ROS产生过多或受到损伤时,会使孔道开放膜通透转变,造成线粒体膜电位下降,从而诱导细胞不可逆走向凋亡,发生系列的级联反应。本研究结果显示齐墩果酸能抑制HepG2细胞的增殖生长,对细胞生长抑制作用呈浓度和时间相关性,随着浓度的增加及作用时间的延长,抑制作用明显增强;细胞凋亡及形态学结果表明,齐墩果酸对HepG2细胞的增殖抑制作用是诱导其凋亡产生的,同时凋亡过程中伴有ROS、MMP的变化,表明齐墩果酸对HepG2细胞的抑制增殖和诱导凋亡可通过调节细胞中ROS和MMP发挥作用,而具体的凋亡信号通路和相关蛋白还有待进一步研究。
综上所述,本研究通过对齐墩果酸体外诱导人肝癌HepG2细胞凋亡,发现齐墩果酸可通过调节ROS和MMP抑制肿瘤细胞的增殖和诱导其凋亡,因此本研究可为肝癌药物的研发及疾病治疗提供有效依据,并有望为临床治疗提供新的途径。
| [1] |
中国药典[S]. 一部. 2015.
( 0) 0)
|
| [2] |
Kim K A, Lee J S, Park H J, et al. Inhibition of cytochrome P450 activities by oleanolic acid and ursolic acid in human liver microsomes[J].
Life Sci,2004, 74 (22) : 2769-2779.
( 0) 0)
|
| [3] |
Castellano J M, Guinda A, Delgado T, et al. Biochemical basis of the antidiabetic activity of oleanolic acid and related pentacyclic triterpenes[J].
Diabetes,2013, 62 (6) : 1791-1799.
( 0) 0)
|
| [4] |
Yunoki K, Sasaki G, Tokuji Y, et al. Effect of dietary wine pomace extract and oleanolic acid on plasma lipids in rats fed high-fat diet and its DNA microarray analysis[J].
J Agric Food Chem,2008, 56 (24) : 12052-12058.
( 0) 0)
|
| [5] |
Raphael T J, Kuttan G. Effect of naturally occurring triterpenoids glycyrrhizic acid, ursolic acid, oleanolic acid and nomilin on the immune system[J].
Phytomedicine,2003, 10 (6) : 483-489.
( 0) 0)
|
| [6] |
Somova L O, Nadar A, Rammanan P, et al. Cardiovascular, antihyperlipidemic and antioxidant effects of oleanolic and ursolic acids in experimental hypertension[J].
Phytomedicine,2003, 10 (2) : 115-121.
( 0) 0)
|
| [7] |
Shanmugam M K, Dai X, Kumar A P, et al. Oleanolic acid and its synthetic derivatives for the prevention and therapy of cancer:preclinical and clinical evidence[J].
Cancer Lett,2014, 346 (2) : 206-216.
( 0) 0)
|
| [8] |
孟艳秋, 聂慧慧, 王晓晨, 等. 齐墩果酸衍生物的合成及抗肿瘤活性的研究[J].
药学学报,2011, 46 (10) : 1215-1220.
( 0) 0)
|
| [9] |
魏鉴腾. 齐墩果酸的抗肿瘤作用及其作用机制研究[D]. 青岛:中国科学院海洋研究所, 2012.
( 0) 0)
|
| [10] |
Shan J, Xuan Y, Ruan S, et al. Proliferation-inhibiting and apoptosis-inducing effects of ursolic acid and oleanolic acid on multi-drug resistance cancer cells in vitro[J].
Chin J Integr Med,2011, 17 (8) : 607-611.
( 0) 0)
|
| [11] |
Wei J, Liu M, Liu H, et al. Oleanolic acid arrests cell cycle and induces apoptosis via ROS-mediated mitochondrial depolarization and lysosomal membrane permeabilization in human pancreatic cancer cells[J].
J Appl Toxicol,2013, 33 (8) : 756-765.
( 0) 0)
|
| [12] |
Tang X H, Gao J, Fang F, et al. Hepatoprotection of oleanolic acid is related to its inhibition on mitochondrial permeability transition[J].
Am J Chin Med,2005, 33 (4) : 627-637.
( 0) 0)
|
| [13] |
张鹏霞, 李鸿梅, 陈东, 等. 齐墩果酸诱导人白血病HL-60细胞凋亡及细胞周期阻滞[J].
中国病理生理杂志,2008, 24 (10) : 1909-1911.
( 0) 0)
|
| [14] |
黄炜, 黄济群, 张东方, 等. 维甲酸、甘草酸和18β-甘草次酸抗人肺癌细胞增殖和侵袭的作用[J].
中国肿瘤,2003, 12 (11) : 665-668.
( 0) 0)
|
| [15] |
Shyu M H, Kao T C, Yen G C. Oleanolic acid and ursolic acid induce apoptosis in HuH7 human hepatocellular carcinoma cells through a mitochondrial-dependent pathway and downregulation of XIAP[J].
J Agric Food Chem,2010, 58 (10) : 6110-6118.
( 0) 0)
|
| [16] |
Mizutani H, Tada-Oikawa S, Hiraku Y, et al. Mechanism of apoptosis induced by doxorubicin through the generation of hydrogen peroxide[J].
Life Sci,2005, 76 (13) : 1439-1453.
( 0) 0)
|
| [17] |
Groninger E, Boer M D, De Graaf S S N, et al. Vincristine induced apoptosis in acute lymphoblastic leukaemia cells:a mitochondrial controlled pathway regulated by reactive oxygen species[J].
Int J Oncol,2002, 21 (6) : 1339-1345.
( 0) 0)
|
| [18] |
Lucken-Ardjomande S, Martinou J C. Newcomers in the process of mitochondrial permeabilization[J].
J Cell Sci,2005, 118 (3) : 473-483.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


