姜黄素是一种多酚类化合物,主要来源于姜科植物姜黄的干燥根茎[1-3]。由于其色泽稳定且毒性极低,已广泛应用于食品添加剂和染料中[4-5]。近年来大量研究发现,姜黄素的药理作用包括抗肿瘤、逆转肿瘤对化疗药物产生的多药耐药、抗炎、抗氧化、抗动脉粥样硬化、抗艾滋病毒等作用[6-7]。目前美国国立肿瘤研究所已将姜黄素列为第3代肿瘤预防药,并进行了前期的临床研究[8-10]。伊立替康是一种水溶性的、经过化学修饰的喜树碱类DNA拓扑异构酶(TOPO)抑制剂[11-13]。伊立替康及其活性代谢物7-乙基-10-羟基喜树碱(SN38)可与DNA的拓朴异构酶结合,引起DNA双链断裂,产生不可逆损伤,导致细胞死亡[14]。姜黄素与化疗药物的协同作用是目前的研究热点,已有的研究发现姜黄素可以通过不同作用机制增强化疗药物的疗效,逆转肿瘤细胞对化疗药物产生的多药耐药。本研究拟使用姜黄素联合伊立替康作用于结肠癌SW620细胞,观察姜黄素与伊立替康对SW620细胞是否具有协同杀伤作用,并研究其作用机制,为姜黄素和伊立替康的联合用于结肠癌的临床治疗和实验研究提供实验依据。
1 材料 1.1 药物与试剂姜黄素(质量分数98%,批号458-37-7)购于南京泽朗医药科技有限公司;盐酸伊立替康(质量分数99%,批号136572-09-3)购于武汉远启医药化工有限公司。
四甲基偶氮哇蓝(MTT,批号298-93-1)、二甲基亚砜(DMSO,批号67-68-5)购于美国Sigma公司;L-15培养基(批号L5520-500ML)购于美国Gibco公司;胎牛血清(批号HB0205)购于杭州四季青生物制品公司;Annexin V-FITC/PI细胞凋亡检测试剂盒(批号201208286001)购于南京凯基生物科技发展有限公司;拓扑异构酶I一抗(批号764-60-3)购于北京博奥森公司;HRp标记羊抗鼠二抗(批号074-1806)购于杭州格朗瑞生物科技有限公司。
1.2 仪器SpectraMax i3x多功能酶标仪购于奥地利Molecular Devices;FACS Callbur流式细胞仪购买于美国BD公司;蛋白电泳系统购买于美国Bio-Rad公司;JD801凝胶电泳图像分析系统购于江苏省捷达科技发展有限公司。
2 方法 2.1 细胞培养人结肠癌SW620细胞购自武汉大学中国典型培养物保藏中心;SW620细胞株在含有10%胎牛血清的L-15培养基中,37 ℃、5% CO2混合气体的培养箱中培养。
2.2 MTT法检测SW620细胞增殖的抑制作用取对数生长期细胞,密度为1×106/mL,以100 μL/孔接种于96孔培养板中,并置于37 ℃、5% CO2培养箱培养24 h。弃掉旧培养液,每孔加入含不同浓度药物的培养基200 μL,伊立替康组的质量浓度分别为0、5、10、30、50、100 μg/mL,姜黄素组的质量浓度分别为0、1、10、20、30 μg/mL,伊立替康+姜黄素联合组:5、50 μg/mL伊立替康分别与0、1、10、20、30 μg/mL姜黄素联合使用。每个药物质量浓度为4个平行孔,继续培养24 h,每孔加入MTT 20 μL,培养4 h后,弃旧培养液,每孔加入DMSO 180 μL,振荡10 min,全自动 酶标仪测定570 nm处的吸光度(A570 nm),计算细胞增殖抑制率。
抑制率=1-(A实验-A对照)/A对照
2.3 流式细胞术检测SW620细胞的凋亡率取对数生长期细胞,密度为1×106/mL,以1 mL/孔接种于6孔培养板中,并置于37 ℃、5% CO2培养箱培养24 h,弃去旧培养液,每孔加入含不同质量浓度药物的培养基1 mL,0、20 μg/mL姜黄素分别与5、50 μg/mL伊立替康联合使用。每个药物质量浓度为4个平行孔,继续培养24 h。收集细胞,离心、PBS洗涤,加入PBS悬浮细胞500 μL,加入Annexin V-FITC 5 μL,混匀后再加入PI染料15 μL,避光室温反应15 min。最后将细胞放入流式细胞仪检测细胞凋亡情况,并统计细胞凋亡率。
2.4 蛋白质印迹法检测细胞拓朴异构酶Ⅰ蛋白的表达情况取对数生长期细胞,密度为1×105/mL,以4 mL/瓶接种于培养瓶中,并置于37 ℃、5% CO2培养箱培养24 h,弃旧培养液,每孔加入含不同质量浓度药物的培养基,0、20 μg/mL姜黄素分别与5、50 μg/mL伊立替康联合使用。每个药物质量浓度为4个平行培养瓶,继续培养24 h。收集细胞,细胞裂解液裂解细胞提取蛋白质,并测定蛋白质浓度。根据说明书制备SDS-聚丙稀酰胺凝胶板,然后将样品上到凝胶孔中,再根据操作规程进行凝胶电泳分离蛋白。电泳结束后,用TBS漂洗NC膜1次,加入封闭缓冲液,置于振荡培养箱中进行封闭(26 ℃,80 r/min,2~4 h),弃掉封闭液后,用一抗稀释液进行杂交,再用二抗稀释液杂交,最后用ECL化学发光并进行图像采集和分析。
2.5 统计学分析采用SPSS 17.0软件进行统计分析,数据表示为x±s,两组之间的比较用独立样本t检验处理。
3 结果 3.1 姜黄素联合伊立替康对SW620细胞增殖的抑制作用与对照组比较,质量浓度大于10 μg/mL伊立替康组的SW620细胞抑制率显著升高,差异均具有统计学意义(P<0.05、0.01),见表 1。结果提示伊立替康对SW620细胞增殖的抑制作用呈浓度和时间相关性。
| 表 1 伊立替康对SW620细胞的抑制率影响 (x±s,n = 4) Table 1 Effect of irinotecan on inhibition rates of SW620 cell (x±s,n = 4 ) |
10~30 μg/mL姜黄素同样对SW620细胞增殖的抑制作用具有浓度和时间相关性,见表 2。
| 表 2 姜黄素对SW620细胞的抑制率影响 (x±s,n = 4) Table 2 Effect of curcumin on inhibition rates of SW620 cell (x±s,n = 4 ) |
5、50 μg/mL伊立替康分别与0~30 μg/mL姜黄素联合处理SW620细胞12、24、48 h,结果联合用药均有协同抑制细胞活性的作用,且呈浓度和时间相关性。高质量浓度比低质量浓度的伊立替康与姜黄素联合用药抑制效果显著(P<0.01),见表 3。
| 表 3 姜黄素联合伊立替康对SW620细胞的抑制率影响 (x±s,n = 4) Table 3 Effect of curcumin combined with irinotecan on inhibition rates of SW620 cell (x±s,n = 4 ) |
3.2 姜黄素联合伊立替康对SW620细胞凋亡率的影响
0、20 μg/mL姜黄素分别与0、5、50 μg/mL伊立替康联合处理SW620细胞12、24、48 h。其中处理24 h后,单独的5、50μg/mL伊立替康诱导的细胞凋亡率分别为(5.9±2.1)%、(29.8±2.5)%。20 μg/mL姜黄素联合5、50 μg/mL伊立替康分别诱导的细胞凋亡率分别为(33.6±3.5)%、(70.6±1.3)%(P<0.01),见表 4。提示姜黄素可以增强伊立替康诱导的SW620细胞凋亡率。
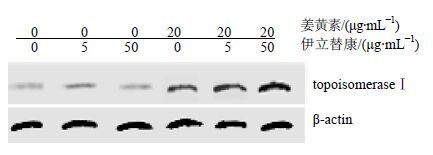
3.3 姜黄素联合伊立替康对SW620细胞内拓扑异构酶-Ⅰ蛋白表达的影响细胞内拓扑异构酶-Ⅰ蛋白为伊立替康作用细胞的靶点。通过蛋白质印记法检测姜黄素联合伊立替康对SW620细胞内拓扑异构酶-Ⅰ蛋白表达的影响。0、5、50 μg/mL伊立替康均几乎没有引起SW620细胞内拓扑异构酶-Ⅰ蛋白的表达,但是单独的20 μg/mL姜黄素可以诱导SW620细胞内拓扑异构酶- Ⅰ蛋白的表达,20 μg/mL姜黄素联合5、50 μg/mL伊立替康处理后,显著上调了SW620细胞内拓扑异构酶-Ⅰ蛋白的表达,见图 1。提示伊立替康与姜黄素协同诱导SW620细胞内拓扑异构酶-Ⅰ蛋白的表达。
| 表 4 姜黄素联合伊立替康对SW620细胞凋亡率的影响 (x±s,n = 4) Table 4 Effect of curcumin combined with irinotecan on apoptosis rats of SW620 cell (x±s,n = 4 ) |
|
图 1 姜黄素联合伊立替康对SW620细胞内拓扑异构酶-Ⅰ蛋白表达的影响 Fig. 1 Effect of curcumin combined with irinotecan on expression levels of topoisomerase in SW620 cell |
4 讨论
伊立替康是从我国特有植物喜树中提取的半合成喜树碱衍生物[15],目前已用于临床抗癌研究。结果发现其抗肿瘤的机制大致为:伊立替康及体内活性代谢物可与肿瘤细胞的拓扑异构酶活性部位结合,形成稳定的拓扑异构酶断裂复合物,抑制拓扑异构酶的活性,从而促使肿瘤细胞的凋亡。拓扑异构酶是真核细胞和原核细胞中的基本酶,广泛分布于细胞核内[8, 16]。大肠癌细胞经伊立替康作用后,细胞内拓扑异构酶表达的下调,使伊立替康的作用靶点减少,致使肿瘤细胞对伊立替康产生多药耐药性[17, 18]。
肿瘤产生多药耐药是降低化疗药物疗效重要原因。已有的研究发现,姜黄素主要是通过逆转运蛋白介导多药耐药途径、逆转酶介导的多药耐药途径、逆转抗凋亡基因介导的多药耐药途径及逆转基因修复介导的多药耐药途径等4种途径来实现的[19, 20]。此外,姜黄素还可以抑制相关激酶磷酸化,使拓扑异构酶在肿瘤细胞中处于高表达水平,使化疗药物与拓扑异构酶结合增加,逆转肿瘤细胞对化疗药物的多药耐药[21, 22]。
本研究中,发现伊立替康和姜黄素均对SW620细胞具有浓度和时间相关性的抑制作用,低质量浓度的伊立替康对细胞抑制效果较差,联合姜黄素后,可以明显增加伊立替康对SW620细胞抑制效果,且具有浓度和时间相关性。两药联合也可以协调诱导细胞凋亡。蛋白质印记法发现单独的伊立替康几乎不能诱导拓扑异构酶-Ⅰ的表达,联合用药后可以显著上调姜黄素诱导的拓扑异构酶-Ⅰ表达水平。因此,可以推测姜黄素协同诱导细胞凋亡率增加的机制为:姜黄素诱导了拓扑异构酶-Ⅰ表达,增加了伊立替康在细胞内的作用靶点,从而增强伊立替康对SW620细胞的抑制作用。
综上所述,伊立替康联合姜黄素可以协同增强对SW620细胞活性的抑制作用,并协同诱导SW620细胞凋亡,其作用机制可能与伊立替康、姜黄素上调拓扑异构酶-Ⅰ表达有关。
| [1] |
周瑶瑶, 张俊峰. 姜黄素在心血管疾病中的应用[J].
国际心血管病杂志,2015, 42 (1) : 41-43.
( 0) 0)
|
| [2] |
邓俊刚, 邓航. 姜黄素药理作用研究及其制剂研究概况[J].
华夏医学,2013, 26 (1) : 221-224.
( 0) 0)
|
| [3] |
Sun B, Ross S M, Trask O J, et al. Assessing dose- dependent differences in DNA-damage, p53 response and genotoxicity for quercetin and curcumin[J].
Toxicology In Vitro,2013, 27 (6) : 1877-1887.
( 0) 0)
|
| [4] |
Gupta S C, Kismali G, Aggarwal B B. Curcumin, a component of turmeric: from farm to pharmacy[J].
Biofactors,2013, 39 (1) : 2-13.
( 0) 0)
|
| [5] |
崔晶, 翟光喜, 娄红祥. 姜黄素的研究进展[J].
中南药学,2005, 3 (2) : 108-111.
( 0) 0)
|
| [6] |
鲁琼, 徐冉. 姜黄素的药理作用及在治疗膀胱癌中的研究进展[J].
中药药理与临床,2012, 28 (3) : 133-136.
( 0) 0)
|
| [7] |
李博, 姜秀秀, 叶明翔, 等. 姜黄素通过调控miRNAs发挥抗癌作用的研究进展[J].
现代生物医学进展,2013, 13 (26) : 5183-5186.
( 0) 0)
|
| [8] |
王家智. 姜黄素联合伊立替康对大肠癌lovo细胞体外生长的影响及作用机制的初步研究 [D]. 广州: 南方医科大学, 2013.
( 0) 0)
|
| [9] |
郭晓丹, 许建华. 姜黄素及其衍生物抗肿瘤作用的研究进展[J].
海峡药学,2011, 23 (6) : 15-18.
( 0) 0)
|
| [10] |
Divya C S, Pillai M R. Antitumor action of curcumin in human papillomavirus associated cells involves downregulation of viral oncogenes, prevention of NFkB and AP-1 translocation, and modulation of apoptosis[J].
Mol Carcinog,2006, 45 (5) : 320-332.
( 0) 0)
|
| [11] |
孙远, 王华萍, 周游, 等. 非喜树碱类DNA拓扑异构酶Ⅰ抑制剂的研究进展[J].
药学进展,2011, 35 (9) : 385-395.
( 0) 0)
|
| [12] |
王丽焱, 汤致强. 抗肿瘤药伊立替康的研究进展[J].
国外医学: 药学分册,2004, 31 (1) : 7-11.
( 0) 0)
|
| [13] |
Zhang M Q, Lin X, Li Y, et al. Irinotecan as a Second-line Chemotherapy for Small Cell Lung Cancer: a Systemic Analysis[J].
Asian Pac J Cancer Prev,2015, 16 (5) : 1993-1995.
( 0) 0)
|
| [14] |
Phelps M A, Sparreboom A. Irinotecan pharmacogenetics: a finished puzzle[J].
J Clin Oncol,2014, 32 (22) : 2287-2289.
( 0) 0)
|
| [15] |
赵静, 于鸿, 吴荻, 等. 新型伊立替康衍生物ZBH-1208的体外抗肿瘤活性及机制研究[J].
中国实验诊断学,2015, 19 (2) : 181-186.
( 0) 0)
|
| [16] |
赵群, 李勇, 王威, 等. 伊立替康对胃癌高侵袭转移细胞株OCUM-2MD3体外抗肿瘤作用的实验研究[J].
实用肿瘤杂志,2006, 21 (5) : 449-452.
( 0) 0)
|
| [17] |
高勇, 刘扬清, 易竹筠, 等. 伊立替康、奥沙利铂及氟尿嘧啶对人大肠癌LoVo细胞株作用的实验研究[J].
临床肿瘤学杂志,2008, 13 (3) : 217-221.
( 0) 0)
|
| [18] |
王淼舟, 李苏宜. 伊立替康联合热疗抑制人大肠癌细胞LOVO体外增殖作用的研究[J].
实用医学杂志,2007, 23 (7) : 941-943.
( 0) 0)
|
| [19] |
王磊, 柯红, 王一羽, 等. 姜黄素逆转P糖蛋白介导的膀胱肿瘤多药耐药的实验研究[J].
时珍国医国药,2009, 20 (3) : 707-708.
( 0) 0)
|
| [20] |
张炎, 鲁功成. 姜黄素逆转多药耐受糖蛋白介导的膀胱肿瘤多药耐药的实验研究[J].
临床泌尿外科杂志,2003, 18 (8) : 492-493.
( 0) 0)
|
| [21] |
玛依努尔·艾力, 哈木拉提·吾甫尔. 肿瘤细胞多药耐药性与天然药物的逆转作用[J].
新疆医科大学学报,2007, 30 (4) : 415-417.
( 0) 0)
|
| [22] |
叶玉梅, 徐承熊. 海南粗榧新碱衍生物HH07A对肿瘤细胞内DNA拓扑异构酶Ⅱ和蛋白激酶C活性的影响[J].
中国药理学与毒理学杂志,1997, 11 (3) : 211-214.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31

